着丝粒蛋白U在结直肠癌患者肠组织中的表达情况及临床意义
2024-06-03王若淳黄伟葛思佳陈婧宣晗颜杨姜佳炜肖明兵陆翠华刘肇修
王若淳 黄伟 葛思佳 陈婧 宣晗 颜杨 姜佳炜 肖明兵 陆翠华 刘肇修
[摘要] 目的 旨在探討着丝粒蛋白U(centromere protein U,CENPU)在结直肠癌患者肠组织中的表达情况,并结合生物信息学分析其表达水平对结直肠癌患者预后的影响。方法 通过实时荧光定量聚合酶链反应(quantitative real time polymerase chain reaction,qRT-PCR)、蛋白质免疫印迹(Western blot,WB)法以及免疫组织化学染色(immunohistochemistry,IHC)实验验证CENPU在组织中的表达情况。结合患者临床病例资料,通过单因素和多因素Cox回归分析CENPU的表达与结直肠癌患者临床病例参数的相关性;然后通过绘制受试操作者操作特征(receiver operating characteristic,ROC)曲线和Kaplan-Meier生存曲线,探究CENPU的表达对结直肠癌患者预后的预测作用。最后,通过生物信息学分析CENPU的表达对结直肠癌疾病进展影响的可能分子机制。结果 通过qRT-PCR、WB法以及IHC实验均发现,与正常组织比较,CENPU在结直肠癌患者癌组织中表达显著升高。Cox回归分析表明CENPU的表达与患者的年龄和TNM分期显著相关,是影响患者预后的危险因素。Kaplan-Meier生存曲线分析表明:CENPU高表达的结直肠癌患者的生存率显著降低。ROC曲线结果表明:基于CENPU的表达建立的模型具有较高的预测结直肠癌患者预后的能力。生物信息学分析结果表明:CENPI、CENPN、CENPD、CENPK、CENPP、CENPM、CENPQ、CENPH、NDC80以及ITGB3BP这10个基因与CENPU基因具有相互作用关系;CENPU参与DNA修复、MYC/TARGETS/V1以及PI3K/AKT/MTOR等信号通路。结论 结直肠癌患者癌组织中高表达的CENPU与患者的不良预后显著相关,提示CENPU有望成为结直肠癌患者早期诊断及预测预后的潜在靶点。
[关键词] 结直肠癌;着丝粒蛋白U;富集分析
[中图分类号] R735 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.11.001
Expression and clinical significance of CENPU in intestinal tissues of patients with colorectal cancer
WANG Ruochun1,2, HUANG Wei1, GE Sijia1, CHEN Jing1,2, XUAN Han1,2, YAN Yang1,2, JIANG Jiawei1,2, XIAO Mingbing1,2, LU Cuihua1, LIU Zhaoxiu1
1.Department of Gastroenterology, Affiliated Hospital of Nantong University, Nantong 226001, Jiangsu, China; 2.Clinical Medical Research Centre, Affiliated Hospital of Nantong University, Nantong 226001, Jiangsu, China
[Abstract] Objective To investigate the expression of centromere protein U (CENPU) in the intestinal tissues of patients with colon cancer, and to analyze the effect of CENPU expression level on the prognosis of patients with colon cancer combined with bioinformatics. Methods Firstly, the expression of CENPU in cancer tissues and normal tissues of colon cancer patients was analyzed by the expression of CENPU in tissues was further verified by real-time quantitative real time polymerase chain reaction (qRT-PCR), Western blot (WB) and immunohistochemistry (IHC). Combined with clinical data, univariate and multivariate Cox regression are used to analyze the correlation between CENPU expression and clinical case parameters of colon cancer patients. Then, the predictive effect of CENPU expression on the prognosis of colon cancer patients are explored by drawing receiver operating characteristic (ROC) curve and Kaplan-Meier survival curve. Finally, the possible molecular mechanism of the effect of CENPU expression on the progression of colon cancer are analyzed by bioinformatics. Results By qRT-PCR, WB and IHC experiments, we find that compared with normal tissues, the expression of CENPU in cancer tissues of colon cancer patients is significantly increased. Cox regression analysis show that the expression of CENPU is significantly correlated with the age and TNM stage of patients, and is a risk factor affecting the prognosis of patients. Kaplan-Meier survival curve analysis show that colon cancer patients with high CENPU expression has significantly lower survival rates. ROC curve show that the model based on CENPU expression has a high predictive power for the prognosis of colon cancer patients area under the curve(AUC=0.832). Bioinformatics analysis show that CENPI, CENPN, CENPD, CENPK, CENPP, CENPM, CENPQ, CENPH, NDC80 and ITGB3BP have significant interaction with CENPU gene. CENPU is involved in DNA repair, MYC/TARGETS/V1 and PI3K/AKT/MTOR signaling pathways. Conclusion High expression of CENPU in cancer tissues of patients with colon cancer is significantly associated with poor prognosis of patients, suggesting that CENPU is expected to be a potential target for early diagnosis and prognosis prediction of patients with colon cancer.
[Key words] Colon cancer; Centromere protein U; Prognosis; Gene set enrichment analysis
结直肠癌(colorectal cancer, CRC)是一种常见的胃肠道恶性肿瘤,多数发生在乙状结肠和直肠的交汇处[1]。发病年龄高峰为40~50岁,在男性和女性最常见恶性肿瘤中排第4位和第3位[2]。转移是结直肠癌患者死亡的主要原因,CRC远处转移主要发生在肝脏,其次是肺、骨、脑[3]。许多患者在发现时肿瘤已经转移到全身多处器官,预后极差。然而,尽管CEA、CA125和CA199等分子标志物已广泛应用于临床诊断和预后评估,但是仍没有标志物可用于为结直肠癌患者的早期诊断和管理提供关键信息[4]。因此,寻找早期诊断CRC的新的分子标志物至关重要。
最新研究表明,CENP家族的多种分子参与肿瘤的发生与进展。有研究发现,着丝粒蛋白(centromere protein A,CENPA)的翻譯后修饰能够调节着丝粒处的CENPA沉积、蛋白质的稳定性和CCAN(组成型着丝粒相关蛋白网络)募集[5]。着丝粒蛋白E(centromere protein E,CENPE)是一种驱动蛋白-7动粒靶向马达,可以运输到微管正端,从而维持稳定的动粒微管附着[6]。
着丝粒蛋白U(centromere protein U,CENPU)也称为髓性白血病因子1-相互作用蛋白(myeloid leukemia factor 1-interacting protein,MLF1IP),它在动粒蛋白组装和有丝分裂过程中有着重要的影响[7]。据报道,它的缺乏会导致小鼠和荷斯坦牛的胚胎死亡[8]。Hua等[9]发现,CENPU是一种新型的微管结合蛋白,通过与Hec1的相互作用在动粒-微管附着中发挥重要作用。目前许多研究已经表明,CENPU在恶性肿瘤的进展中发挥着重要作用,在多种肿瘤中表达增高。有研究发现,在膀胱癌的T24细胞中,CENPU的敲低可以抑制G1期细胞的增殖、集落形成,并导致细胞周期停滞,促进了细胞的凋亡[10]。Hanissian等[11]发现CENPU在各种胶质母细胞瘤细胞中表达增加,并在红白血病中起重要作用。这些均表明CENPU可能是各种肿瘤的驱动因素。尽管如此,目前对于CENPU在结直肠癌中的表达和预后作用的研究报道仍然较少。
本研究旨在探究CENPU在结直肠癌中的表达,并进一步分析其对结直肠癌患者远期预后的价值及对结直肠癌细胞恶性行为的影响,以探寻结直肠癌患者治疗的潜在靶点。
1 资料与方法
1.1 数据获取
从南通大学附属医院收集了66例结直肠癌患者的组织样本。这些组织样本的收集时间为:2010年1月8日到2011年6月9日,收集性别、年龄、细胞分化、TNM分期、肿瘤直径、远处转移等临床数据。本研究均经南通大学附属医院伦理委员会批准(伦理审批号:2023-K109-01),并取得全体患者的知情同意书。
1.2 实验方法
将结直肠癌组织和邻近组织固定,包埋在石蜡中,并切成4μm的切片。然后,将样品在100℃下加热15分钟以进行抗原修复。加入CENPU抗体(1∶200)作为一抗,4℃孵育过夜。第2天,用第二抗体免疫球蛋白G孵育,最后用二氨基联苯胺和苏木精染色。根据染色面积和染色强度进行评分(0~6分为低表达,7~12分为高表达)。照片在光学显微镜下观察。由两名经验丰富的病理学家独立评估切片。
从组织中提取出总mRNA,并将其逆转录为cDNA。然后通过SYBR Premix Ex Taq检测CENPU基因的表达情况。CENPU引物正向:3-GAAAAGAAA AGGCAGCGTATGA-5,反向:3-AATATGCTGCATT CCTAAGGG-5。以GAPDH作为内参,正向:3-CAG GAGGCATTGCTGATGAT-5,反向:3-GAAGGCTG GGGCTCATTT-5。反应条件:先95℃运行5min,然后95℃,10s;60℃,30s;95℃,15s;60℃,1min;共循环40次。
提取组织总蛋白,通过10%SDS-PAGE凝胶将蛋白质分离,并将其迁移到聚偏氟丙烯膜上,用5%脱脂牛奶封闭1.5h,然后在4℃下,与相应的一抗一起孵育过夜。第2天,将膜与稀释的二抗孵育1.5h。最后,将ECL发光溶液均匀涂抹在PVDF膜上显影。以GAPDH作为内参照。比较结直肠癌患者的癌组织与癌旁组织的蛋白质表达水平。
1.3 PPI网络、富集分析
使用STRING数据库(https://cn.string-db.org/)探索与CENPU相关枢纽基因的PPI网络,分析蛋白之间的相互作用。综合评分>0.4分的相互作用被认为差异有统计学意义。
使用GSEA包对CENPU进行功能富集分析,以确定有显著变化的通路。对于每一个单独的分析,对表达一致的通路进行t检验,计算各基因的平均差异表达量。参数设定为随机组合,并将其重复1000次,筛选出P<0.05的基因集,以此来确定显著富集的基因集。
1.4 统计学方法
采用Graphpad Prism8和SPSS Statistics 25.0对数据进行处理分析。采用Cox回归分析和Kaplan- Meier法分析CENPU表达对预后的影响。两组比较采用t检验或χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 CENPU在结直肠癌患者癌组织中高表达
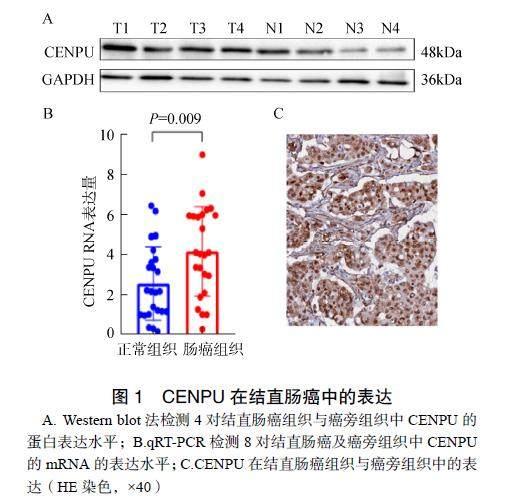
与正常组织比较,CENPU在癌组织中的表达水平显著升高,差异有统计学意义(P<0.001)。CENPU在癌组织中高表达,差异均有统计学意义(P均<0.01)。为了进一步验证CENPU在结直肠癌患者组织中的表达情况,扩大样本量,共收66例组织,制备成组织芯片,通过IHC实验检测CENPU的表达情况。结果显示,CENPU在癌旁组织的肠上皮细胞中弱或几乎不染色,而在癌组织中强染色,提示其在癌组织中高表达,且蛋白主要定位在细胞核中(图1)。
2.2 CENPU的表达与患者临床病理参数的相关性
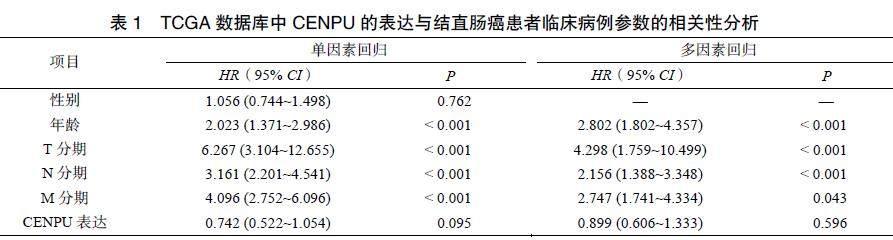
单因素Cox回归分析结果表明,CENPU的表达水平与患者的年龄和TNM分期显著相关;多因素Cox回归分析结果表明,患者的年龄、肿瘤TNM分期以及CENPU的表达水平是影响结直肠癌患者预后的危险因素(表1)。同时,66例结直肠癌患者的临床病例资料中CENPU的表達与患者的TNM分期相关(P=0.039,表2)。
A. Western blot法检测4对结直肠癌组织与癌旁组织中CENPU的蛋白表达水平;B.qRT-PCR检测8对结直肠癌及癌旁组织中CENPU的mRNA的表达水平;C.CENPU在结直肠癌组织与癌旁组织中的表达(HE染色,×40)
2.3 高表达CENPU与结直肠癌患者预后
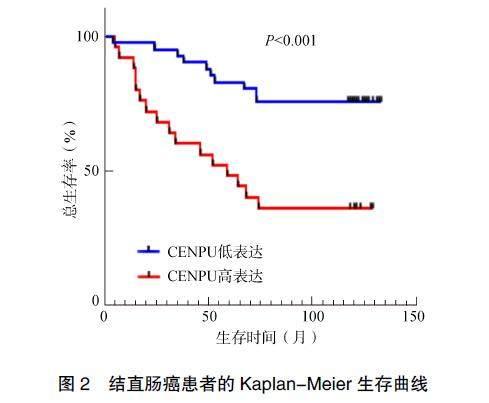
通过电话随访生存期,结合Kaplan-Meier生存曲线,分析CENPU的表达与患者总生存率的相关性。结果表明,与低表达CENPU的患者相比,高表达CENPU患者的生存率显著降低,差异有统计学意义(P<0.001,图2)。
2.4 生物信息学分析
基于CENPU的表达,进一步建立了结直肠癌预后预测模型,结果提示,风险评分的曲线下面积(area under the curve,AUC)为0.832,该模型具有较高的预测结直肠癌患者预后的能力(图3)。为了深入探究CENPU对结直肠癌患者预后影响的可能分子机制,首先利用STRING数据库,寻找与CENPU相互作用的基因。结果显示,CENPI、CENPN、CENPD、CENPK、CENPP、CENPM、CENPQ、CENPH、NDC80以及ITGB3BP这10个基因与CENPU基因具有相互作用关系。其次,通过GSEA富集分析发现:DNA修复、MYC/TARGETS/ V1、PI3K/AKT/MTOR、G2M检查点、有丝分裂纺锤体、糖酵解、WNT/BETA/ CATENIN、NOTCH、p53以及细胞凋亡与CENPU显著相关。第三将数据库中结直肠癌患者分为高表达和低表达CENPU组,对两组样本的转录基因进行分析,进一步探究两组样本的差异表达基因谱(图4)。
3 讨论
目前,结直肠癌在全世界恶性肿瘤中病死率排第3位,由于缺乏早期诊断技术,许多患者在发现时已是晚期,因此无法进行有效的手术治疗,从而导致预后不良[12-13]。肿瘤标志物对患者的早期发现、早期诊断、早期治疗至关重要[14]。所以,寻求有效的肿瘤标志物和预测预后的因素对于提高结直肠癌患者的生存率尤为重要。
本研究发现,CENPU表达升高与TNM分期、浸润深度、淋巴结转移、远处转移、肿瘤直径等指标有关。既往有研究发现,CENPU表达增高与卵巢癌患者预后不良密切相关[15]。还有研究发现,lncRNA GATA3-AS1/miR-495-3p/CENPU轴促进乳腺癌的进展[16]。此外,CENPU还可促进肝癌细胞增殖、侵袭和迁移[17]。因此,CENPU表达升高的患者总体生存率显著降低,预示着肿瘤分化程度越低、浸润程度更深、临床分期更晚以及淋巴结转移的风险增加,这表明CENPU可以影响患者的预后,可以作为结直肠癌患者的潜在预后标志物[18]。
通过基因富集分析,本研究发现CENPU参与了多种通路及代谢途径,包括DNA修复、Notch信号通路、PI3K/AKT/MTOR/通路和细胞凋亡等。其中,Notch信号通路在维持祖细胞/干细胞群的正常生长和分化以及凋亡这三者的平衡之间充分发挥着作用[19]。科学研究表明,Notch1家族包含四种不同类型的受体,分别是Notch1、Notch2、Notch3和Notch4,其中Notch4的异常激活可能会导致结直肠癌的发展[20]。此外,Notch1还与调节上皮间充质转化(epithelial-mesenchymal transition,EMT)的转录因子(如SLUG、SNAIL和TGF-β)有着密切的联系,形成了一个新的肿瘤微环境,从而加快了结直肠癌的转化[21]。磷脂酰肌醇3-激酶/蛋白质激酶B通路在多种癌症中起作用,它不仅可以调节细胞的生长、代谢、增殖,还可以促进癌细胞的侵袭和转移[22-23]。此外,有研究证实PIK3CA突变会对PI3K/AKT信号通路产生影响,促进结直肠癌细胞的增殖和转移[24]。因此,CENPU显著富集Notch、PI3K/AKT/MTOR等相关信号通路,高度提示了高表达的CENPU可能通过这些信号通路来调节肿瘤细胞的增殖、分化等,从而促进结直肠癌的发展。
然而本文也具有一定的局限性。首先,本研究通过TCGA数据库及南通大学附属医院收集了许多结直肠癌的组织样本。但是在分析这些临床数据时,由于每个患者的情况不同,本研究只是通过患者的初步随访数据来进行分析,结果可能存在一些偏倚,因此需要更多的样本来进行实验验证。其次,通过富集分析发现CENPU参与多种通路和代谢途径的发生和发展,但尚未深入研究,后续需要通过更多的实验来验证。
综上所述,TNM分期、浸润深度、淋巴结转移、远处转移等相关临床指标及患者的预后,这些都与结直肠癌组织中CENPU的高表達有关。这表明CENPU可以是一种致癌基因,也可以是结直肠癌的分子标志物,从而为临床治疗提供重要的参考依据。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] LIU Y, WU K, LAI H, et al. Clinical application of fluoroscopic guided percutaneous Antegrade ureteral stents placement for the treatment of malignant ureteral obstruction[J]. JoX-rs Technol, 2019, 27(3): 453–460.
[2] CAO Y, WANG X. Effects of molecular markers on the treatment decision and prognosis of colorectal cancer: a narrative review[J]. Gastrointest Oncol, 2021, 12(3): 1191–1196.
[3] KULKARNI N, KHALIL A, Bodapati S. Skeletal muscle metastasis from colorectal adenocarcinoma: A literature review[J]. World J Gastrointest Surg, 2022, 14(7): 696–705.
[4] ZHONG W, YU Z, ZHAN J, et al. Association of serum levels of CEA, CA199, CA125, CYFRA21-1 and CA72-4 and disease characteristics in colorectal cancer[J]. Pathol Oncol Res, 2015, 21: 83–95.
[5] SRIVASTAVA S, FOLTZ D R. Posttranslational modifications of CENP-A: marks of distinction[J]. Chromosoma, 2018, 127(3): 279–290.
[6] CRASKE B, WELBURN J P. Leaving no-one behind: how CENP-E facilitates chromosome alignment[J]. Essays Biochem, 2020, 64(2): 313–324.
[7] SHAO C, WANG Y, DUAN H, et al. Mitosis-related gene CENP-U as a potential biomarker in malignancy[J]. Ann Transl Med, 2021 Dec, 9(23): 1744.
[8] HOZ? C, ESCOUFLAIRE C, MESBAH-UDDIN M, et al. Short communication: A splice site mutation in CENPU is associated with recessive embryonic lethality in Holstein cattle[J]. J Dairy Sci, 2020, 103: 607–612.
[9] HUA S, WANG Z, JIANG K, et al. CENP-U cooperates with Hec1 to orchestrate kinetochore-microtubule attachment[J]. J Biol Chem, 2011, 286(2): 1627–1638.
[10] WANG S, LIU B, ZHANG J, et al. Centromere protein U is a potential target for gene therapy of human bladder cancer[J]. Oncol Rep, 2017, 38(2): 735–744.
[11] HANISSIAN S H, TENG B, Akbar U, et al. Regulation of myeloid leukemia factor-1 interacting protein (MLF1IP) expression in glioblastoma[J]. Brain Res, 2005, 1047: 56–64.
[12] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics[J]. CA Cancer J Clin, 2015, 65: 87–108.
[13] 汪晉, 郑磊, 丰茂坤, 等. ZC3H13和m6a甲基转移酶WTAP在结直肠癌中的表达水平及与预后的关系[J]. 热带医学杂志, 2022, 22(11): 1561–1566.
[14] 马玉, 马雅静, 李旭哲, 等.健康体检人群肿瘤标志物的异常状态: 分子水平肿瘤早期筛查的临床意义[J]. 临床与实验病理学杂志, 2017, 33(1): 12–17.
[15] LI H, ZHANG H, WANG Y. Centromere protein U facilitates metastasis of ovarian cancer cells by targeting high mobility group box 2 expression[J]. Am J Cancer Res, 2018, 8(5): 835–851.
[16] LIN S, ZHAO M, LV Y, et al. The lncRNA GATA3-AS1/ miR-495-3p/CENPU axis predicts poor prognosis of breast cancer via the PLK1 signaling pathway[J]. Aging (Albany NY), 2021, 13(10): 13663–13679.
[17] LIU Y, YAO Y, LIAO B, et al. A positive feedback loop of CENPU/E2F6/E2F1 facilitates proliferation and metastasis via ubiquitination of E2F6 in hepatocellular carcinoma[J]. Int J Biol Sci, 2022, 18(10): 4071–4087.
[18] 周岳, 韩博. p38蛋白表达与结直肠癌患者临床病理特征和预后的关系研究[J]. 检验医学与临床, 2022, 19(23): 3231–3234.
[19] QIAO L, WONG B C. Role of Notch signaling in colorectal cancer[J]. Carcinogenesis, 2009, 30: 1979–1986.
[20] WU G, CHEN Z, LI J, et al. NOTCH4 Is a novel prognostic marker that correlates with colorectal cancer progression and prognosis[J]. J Cancer, 2018, 9(13): 2374–2379.
[21] JACKSTADT R, VAN HOOFF S R, LEACH JD, et al. Epithelial NOTCH signaling rewires the tumor microenvironment of colorectal cancer to drive poor- prognosis subtypes and metastasis[J]. Cancer Cell, 2019, 36: 319–336.
[22] DUNLAP J, LE C, SHUKLA A, et al. Phosphatidylinositol- 3-kinase and AKT1 mutations occur early in breast carcinoma[J]. Breast Cancer Res Treat, 2010, 120: 409–418.
[23] SAMUELS Y, ERICSON K. Oncogenic PI3K and its role in cancer[J]. Curr Opin Oncol, 2006, 18: 77–82.
[24] ZHU YF, YU B H, LI D L, et al. PI3K expression and PIK3CA mutations are related to colorectal cancer metastases[J]. World J Gastroenterol, 2012, 18(28): 3745–3751.
(收稿日期:2023–08–06)
(修回日期:2024–02–17)
