高剂量酒糟摄入对山羊肾脏组织氧化指标、炎性因子、转录谱的影响
2023-12-08罗怡茜李亚均何凯锋张芝金郭灵君张德志李前勇
罗怡茜,李亚均,何凯锋,张芝金,郭灵君,张德志,,李前勇,*
(1.西南大学 动物医学院,重庆 荣昌 402460;2.重庆市兽医科学工程研究中心,重庆 荣昌 402460)
酒糟是玉米、小麦、高粱等谷物酿造后的残渣,是乙醇工业的一种副产物,营养价值十分丰富,蛋白质、能量、磷和脂肪等物质含量高[1-2],且因其产量巨大和价格低廉,无论在国内还是国外,都广泛被应用于各种动物养殖中[2-5]。用酒糟作为饲料添加物,常见添加量在10%~80%不等。研究表明,饲喂羔羊时,在日粮中添加DM 60%的干酒糟可溶物而不会影响干物质采食量,且20%为最佳添加量[6]。MANTHEY等[7]的试验表明,在限量饲喂日粮中加入50%的干酒糟代替草料可以保持小母牛的生长性能。多项研究表明,在饲草中加入适量的酒糟不影响甚至提高动物的生长性能[8-11]。一些养殖者饲喂牛、羊时,其酒糟在饲料中的比例经常达到50%~70%,个别甚至超过80%,加之饲喂时间过长,牛、羊容易发生酒糟中毒。目前关于动物酒糟中毒的报道只有关于其病因、症状、病理变化、防治方法等方面,其酒糟中毒的机理尚不清楚。
肾脏是机体重要的代谢器官,研究表明,动物发生酒糟中毒时,其肾脏会肿胀变性、质地变脆[12-13],因此,肾脏是鉴定动物酒糟中毒相关候选基因的重要器官。转录组测序是确定关键基因功能的重要手段。近期,转录组测序技术发展迅速而且被广泛应用于动物研究。本研究用荣昌本地山羊为模型动物,对照组按照《肉羊饲养标准》(NY/T816-2004)推荐的山羊饲养标准饲喂,试验组用酒糟代替日粮中75%蛋白质和能量成分,试验期为90 d。分别用生化法、ELISA法、转录组测序检测山羊肾脏氧化指标、炎性指标、转录谱的变化,以探讨高剂量酒糟饲喂对山羊肾损伤的机制,以期为动物酒糟中毒的预防和治疗提供科学参考。
1 材料与方法
1.1 试验试剂RNAiso PlusAL61152A、TB Green®Premix Ex TaqTMⅠ IIAL92617A 、PrimeScriptTMRT reagent Kit with gDNA EraserAL21113A、RNAfreed-H2OAKG1198A 购自宝日医生物技术(北京)有限公司;Goat 白细胞介素-1β(IL-1β)试剂盒BPE93040、Goat 白细胞介素-6(IL-6)试剂盒BPE93046、Goat 肿瘤坏死因子α(TNF-α)试剂盒BPE93092购自上海朗顿生物科技有限公司;谷胱甘肽过氧化物酶(GSH-Px)测试盒A005、过氧化氢酶(CAT)测定试剂盒A007-1、黄嘌呤氧化酶(XOD)测定试剂盒A002、总超氧化物歧化酶(T-SOD)测试盒A001-1、总抗氧化能力(T-AOC)检测试剂盒A015-2、总蛋白(TP)测定试剂盒A045-2-2购自南京建成生物工程研究所。
1.2 试验仪器Real-Time PCR扩增仪,购自美国Thermo SCIENTFIC公司;全自动雪花制冰机IMS-20,购自常熟市雪科电器有限公司;冷冻离心机,购自赛默飞世尔科技公司;Bio-RAD S1000TM96 PCR,购自美国Bio-RAD公司;恒温培养箱 HPX-9082MBE,购自上海博迅实业有限公司医疗设备厂;Elixir/Rios纯水仪,购自上海揽宝仪器设备有限公司;Infinite 200 Pro酶标仪,购自德国Tecan公司;分析天平AB104-N,购自梅特勒-托利多仪器(上海)有限公司。
1.3 实验动物及样品采集在重庆荣昌某山羊养殖场选取体质量相近(14.16±1.30) kg、健康的本地山羊。随机分为2组,每组3只。对照组按《肉羊饲养标准》(NY/T816-2004)推荐的山羊饲养标准饲喂;试验组用酒糟代替日粮中75%蛋白质和能量成分,试验日粮组成见表1。90 d后,将羊颈动脉放血致死后取下肾脏,一部分用生理盐水冲洗,另一部分用无水乙醇冲洗,分装后放入液氮1 h后转入-80℃冰箱保存备用。
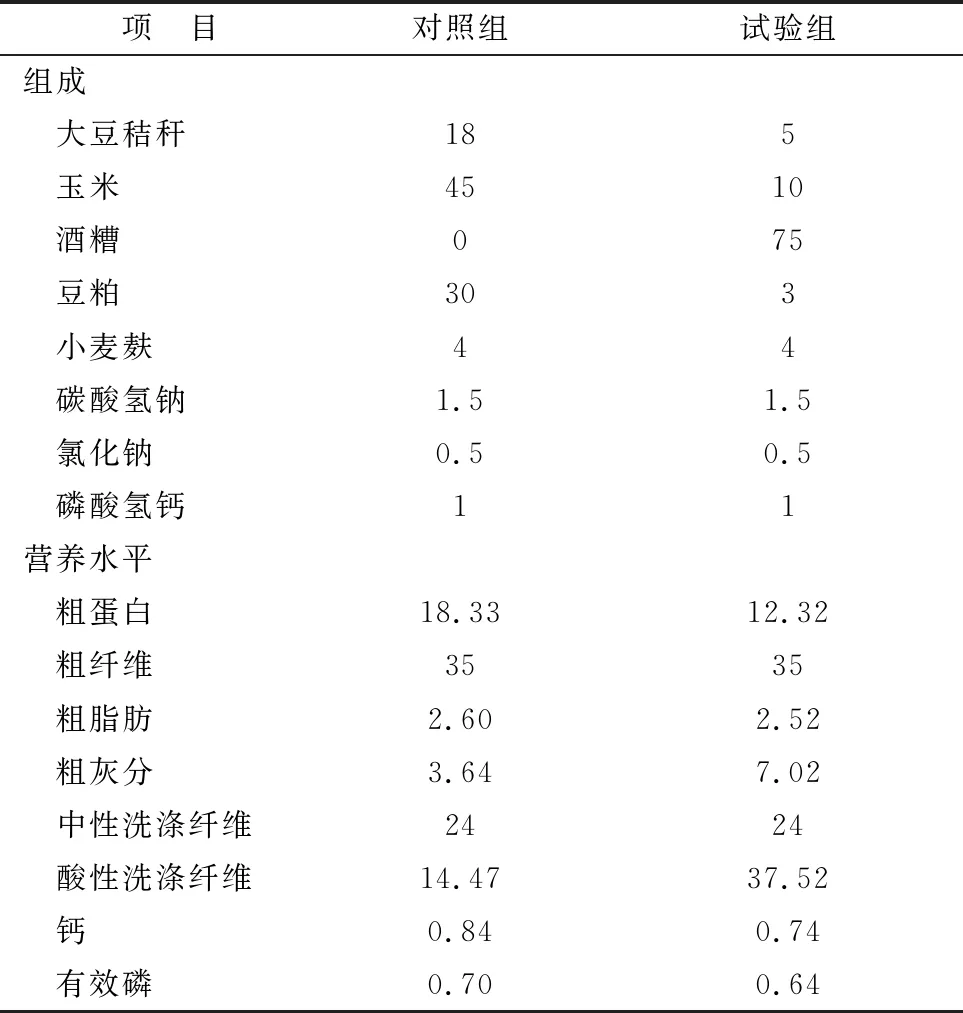
表1 试验日粮组成及营养水平 %
1.4 肾脏组织炎性因子的检测将肾脏组织从冰箱取出后,按ELISA试剂盒说明书进行IL-6、IL-1β、TNF-α含量的检测。
1.5 肾脏组织氧化指标的检测将肾脏组织从冰箱取出后,按试剂盒说明书进行T-SOD、CAT、GSH-Px、XOD、T-AOC含量的检测。
1.6 转录组测序
1.6.1测序 将肾脏组织放入预冷的研钵中研磨成粉末,总RNA采用TRIzol(北京天根生化有限公司)方法提取。在1%琼脂糖凝胶上检测RNA降解和污染。RNA用Agilent 2100 Bioanalyzer(美国安捷伦技术公司,CA,美国)定量,用NanoDrop分光光度计(美国IMPLEN公司,CA,美国)评估质量和完整性。样品检测合格后,各取1.5 μg的 RNA用于建库测序。测序库的构建采用Illumina公司(Illumina,San Diego,USA)配套试剂盒。利用Oligo(dT)磁珠富集mRNA,加入裂解缓冲液将mRNA裂解成短片段。利用随机六聚体合成第一链cDNA,利用缓冲液、dNTPs和DNA聚合酶I合成第二链cDNA。为了优选200~250 bp长度的cDNA片段,用AMPure XP系统纯化文库片段。纯化后,对双链cDNA进行末端修复,加入A,加入连接器。采用PCR扩增技术构建cDNA文库。利用Agilent Bioanalyzer 2100系统对文库质量进行评价。由北京Allwegene科技有限公司(北京,中国)在Illumina Hiseq 4000平台上对文库进行测序,生成配对端150 bp的reads。
1.6.2测序数据质控 测序后,用内部perl脚本和Trimmomatic(v0.33)处理原始数据。去除有测序接头(adapter)的reads、不确定碱基含量比例大于10%的reads和低质量碱基(Q≤20)含量大于50%的reads。将质控后的clean reads用STAR映射到山羊(capra-hircus)的参考基因组,“mismatch”参数通常设置为2,其他参数默认设置。
1.6.3差异表达基因分析 使用DESeq对读计数的深度进行了修改,用负二项分布法计算P值,采用Benjamini和Hochberg法控制FDR(错误发现率)。当1个基因P<0.05时为差异基因。在差异基因中,如果基因的log2 Foldchange>0,则认为该差异基因是上调,反之,若log2 Foldchange<0,认为该差异基因是下调。
1.6.4差异表达基因富集分析 用GOseq R包分析DEGS的基因本体富集分析,使用KOBAS (v2.0)软件检测差异表达基因在统计学上的富集KEGG通路。
1.6.5荧光PCR验证 为了验证转录组测序结果,以β-actin基因为内参基因,随机选取了ATP6、ND4、ND6、COX2、CYTB这5个基因进行实时荧光定量 PCR反应,采用2-ΔΔCT方法计算基因mRNA在组织中的表达量。在NCBI网站上查找相关基因序列送至上海生工生物工程技术服务有限公司设计并合成引物(表2)。

表2 RT-qPCR引物序列信息
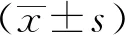
2 结果
2.1 高剂量酒糟饲喂对山羊肾脏组织氧化指标的影响试验组与对照组各氧化指标结果见图1。与对照组相比,试验组XOD水平显著低于对照组(P<0.05),CAT和GSH-Px水平差异不显著,T-SOD和T-AOC水平极显著低于对照组(P<0.01)。
2.2 75%酒糟饲喂对山羊肾脏组织炎症因子的影响试验组与对照组各炎症因子结果见图2。与对照组相比,试验组各炎症因子均表现出显著性差异(P<0.05),其中试验组IL-1β水平极显著高于对照组(P<0.01),IL-6、TNF-α水平显著高于对照组(P<0.05)。

A.GSH-Px、T-SOD表达水平;B.XOD、CAT表达水平;C.T-AOC表达水平。*.P<0.05;**.P<0.01。下同
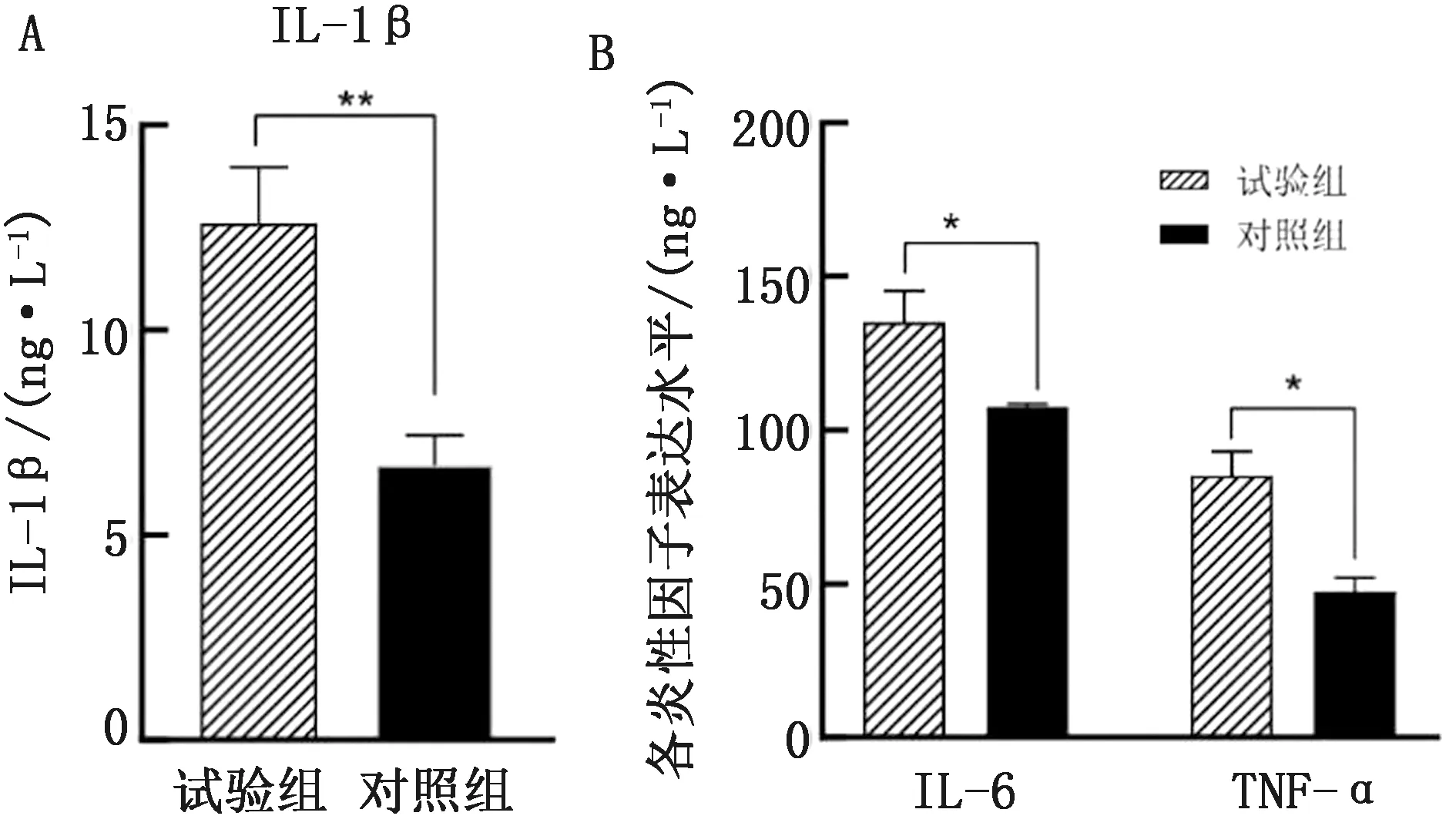
A.IL-1β表达水平;B.IL-6、TNF-α表达水平
2.3 测序数据结果分析测序结果如表3所示,在对山羊肾脏的转录组数据测序和质控后,得到了227 811 050条原始序列和215 653 142条有效序列。碱基平均错误率是0.03%,Q20、Q30分别超过97.00%,93.00%,GC含量所占比例为42.78%~48.14%。超过95.00%的有效序列被映射到山羊参考基因上,表明测序数据适合后续分析。
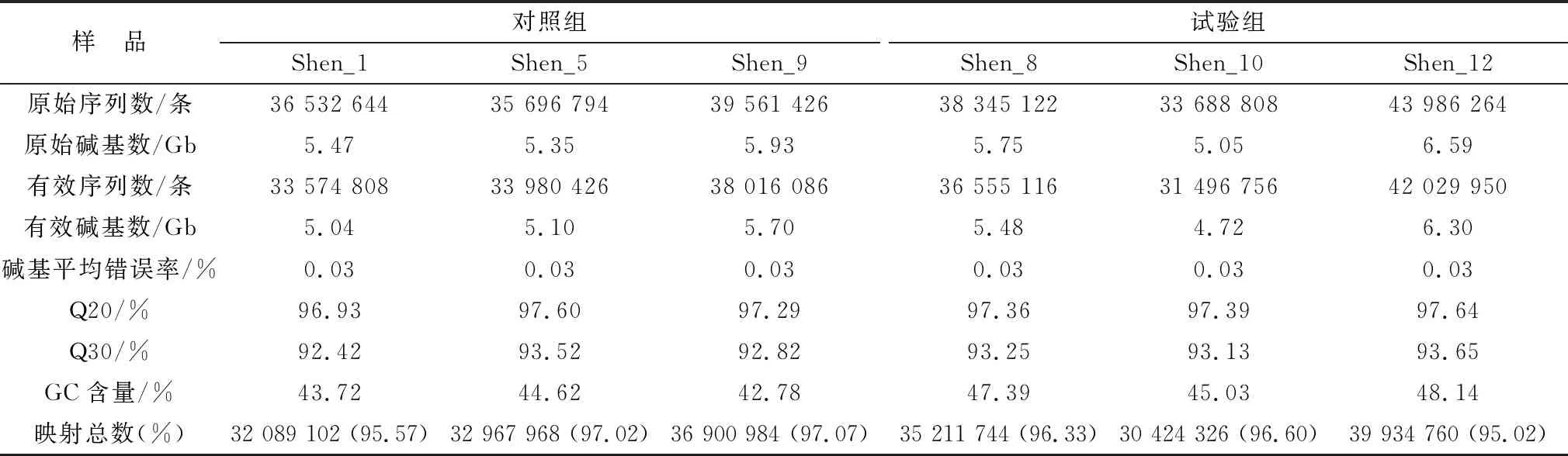
表3 转录组测序数据质量检测分析
2.4 差异表达基因(DEGs)筛选得到的差异基因结果如图3所示,本次试验中,共得到了546个差异基因,与对照组相比,试验组共获得385个上调基因和161个下调基因。图4为差异基因聚类分析结果,表明试验组(Shen-gjl)的整体基因表达谱与对照组(Shen-dz)相比差异较大。
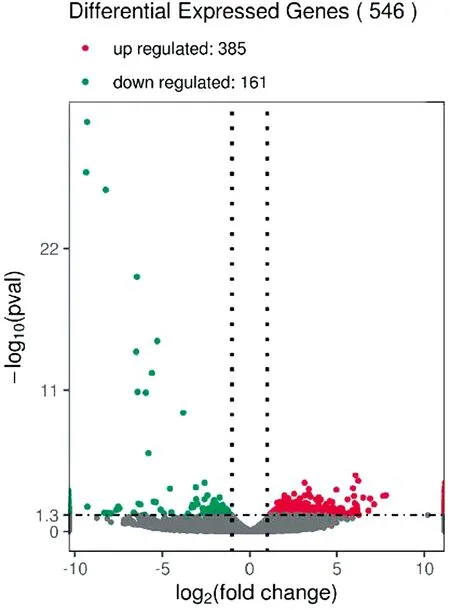
图3 差异表达基因分布趋势的火山图
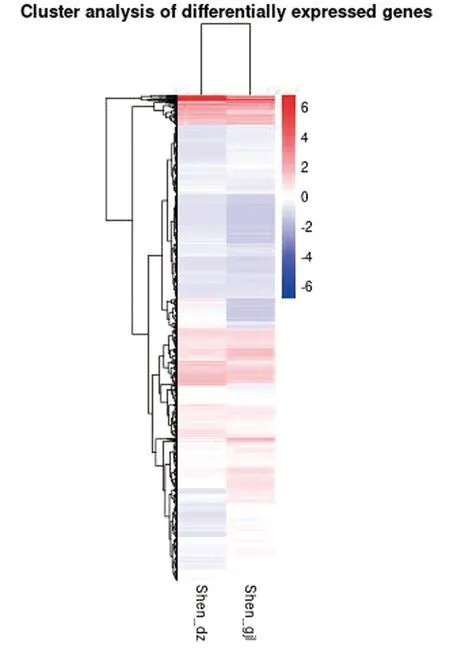
图4 差异基因的层次聚类的热图
2.5 GO 和 KEGG 通路富集GO数据库总共有3大类,分别是生物学过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF),本试验差异表达基因在3大类中的GO类别上均出现富集。前30条显著富集到的GO条目如图5所示,在生物过程中,富集的主要类别是电子传递链(electron transport chain)和呼吸电子传递链(respiratory electron transport chain);在分子功能中,主要类别是转运活性(transporter activity)和跨膜转运蛋白活性(transmembrane transporter activity);在细胞成分中,主要类别是膜的整体组成(integral component of membrane)和膜的固有成分(intrinsic component of membrane)。
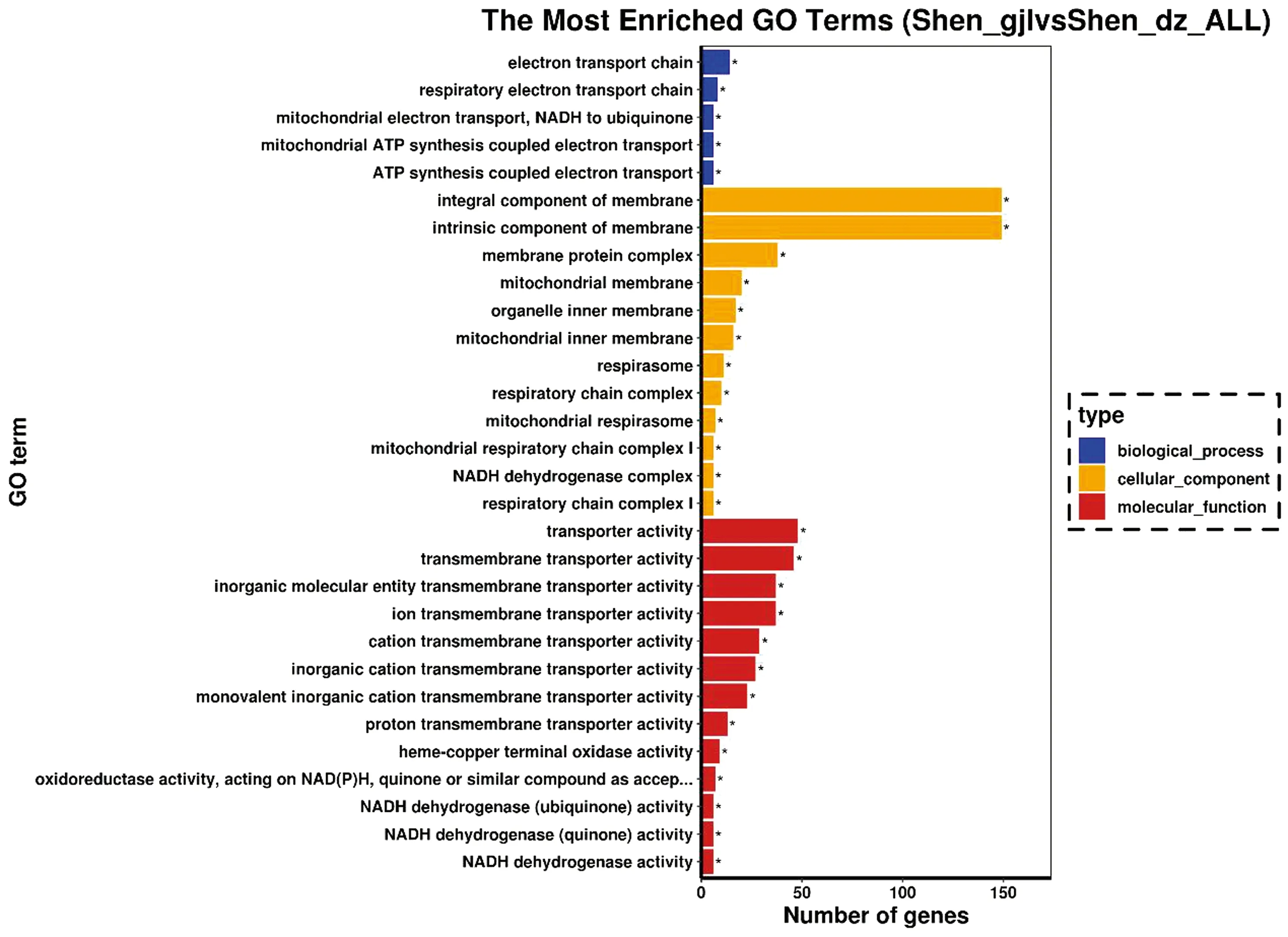
图5 差异表达基因富集分析中前30个GO条目
根据KEGG功能注释,共确定了19条显著富集的通路(P<0.05)(图6),在试验组和对照组的比较中,鉴定出的差异表达基因主要富集在生热作用(thermogenesis)、帕金森病 (Parkinson disease)、氧化磷酸化(oxidative phosphorylation)等通路中。

图6 差异表达基因的KEGG富集分析
2.6 使用 qRT-PCR 验证 转录组测序结果为了验证转录组测序结果准确性,挑选5个显著表达的差异基因进行qRT-PCR验证,结果如图7所示,与对照组相比,试验组所有基因表达均极显著上调(P<0.01),这与转录组测序结果的趋势一致,说明测序结果可靠。

A.ND6 mRNA相对表达量;B.ND4 mRNA相对表达量;C.ATP6、COX2、CYTB mRNA相对表达量
3 讨论
作为一种常用的饲料添加物,酒糟在牛、羊养殖业的发展中起着至关重要的作用,据报道,2019年我国约生产各类酒糟总计2 518.85 t[14],酒糟中粗蛋白、粗脂肪、粗纤维和磷含量分别为27.9%,10.8%,7.4%和0.8%,其粗蛋白含量是玉米的2.68倍;粗脂肪是玉米的3.00倍,是豆粕的5.68倍,是菜粕的7.70倍;粗纤维是玉米的3.20倍,是豆粕的1.20倍[15]。但过量添加可以造成牛羊发生中毒,其致病和损伤的机制还不清楚。本研究为探索高剂量酒糟饲喂对山羊肾损伤的机制,用ELISA法、生化法检测山羊肾脏氧化指标、炎性因子的变化,然后用转录组测序筛选与其相关的差异表达基因与通路,进而研究高剂量酒糟饲喂对山羊肾损伤的机制。
氧化应激是由于氧化剂生成异常增加导致内源性抗氧化剂相对不足而引起的消耗性代谢失调,最终导致重要细胞成分发生氧化损伤[16]。据文献报道,氧化应激能导致肾脏发生多种疾病,如糖尿病、慢性肾衰竭、肾癌等[17-19]。机体自身的抗氧化防御体系,能切断脂质链式反应,避免自由基产生过剩,维持机体氧化稳定,减少细胞氧化损伤。SOD、CAT、GSH-Px、铜蓝蛋白、维生素和尿酸等都是机体抗氧化防御体系的组成部分[20-21]。XOD是体内核酸代谢中的重要酶,它可以催化体内嘌呤化合物的氧化,最后形成尿酸,从而产生大量的自由基,导致细胞结构破坏和功能障碍[22-23];SOD将超氧化物阴离子转化为相对稳定的H2O2;CAT将H2O2还原为H2O;GSH-Px 通过防止过氧化氢氧化而起到防止细胞氧化损伤的重要作用[24],三者能有效清除体内过多的自由基[25-26];T-AOC是衡量机体抗氧化能力综合指标,其反映了非酶抗氧化防御系统的活性和抗氧化酶的水平[27]。KONG等[28]的研究表明草鱼(Ctenopharyngodonidellus) 肝脏T-SOD随干酒糟可溶物的添加量的增加呈下降趋势(P<0.05)。研究发现,连续给大鼠灌胃8周乙醇,大鼠睾丸中黄嘌呤氧化酶(XO)活性降低[29]。李华磊等[30]研究表明在肉鸡饲粮中添加15%玉米干酒糟及其可溶物会降低肉鸡血清中T-AOC活性,本试验结果与其一致,也与本试验转录组测序结果一致,说明饲喂75%酒糟会使山羊肾脏抗氧化系统失调,产生氧化应激。
炎症是机体对有害刺激物的防御反应,与机体营养健康之间有着密切的联系,这种反应可以减轻感染、清除损伤细胞、启动组织修复。炎症与许多疾病有关,包括感染性和自身免疫性疾病,各脏器和肿瘤疾病[31-32]。慢性炎症中巨噬细胞激活因子激活巨噬细胞长期且低量的分泌TNF-α、IL-1β等细胞因子以维持炎症的发展[33]。TNF-α是炎症早期产生的促炎因子,可以导致发热,刺激内皮细胞释放大量炎性因子和促进中性粒细胞黏附到上皮细胞,进而导致机体产生局部炎性反应[34-35]。IL-1β是一种由大脑中的神经元、小胶质细胞、星型胶质细胞和外周多种免疫细胞产生和释放的重要的促炎细胞因子,可诱导炎症,促进黏附分子的分泌和多种炎症因子产生,是体内诱导作用最强的炎症介质之一[35-36]。IL-6由T淋巴细胞在IL-1和TNF-α的诱导下分泌的免疫调节因子,其参与炎症反应及造血过程等,在机体的抗感染免疫中起重要作用[36-38]。TNF-α、IL-1β、IL-6均属于机体的促炎因子,可反映出机体的炎性程度,因此,通过检测三者含量可反映机体的基本炎症状况。李华磊等[30]研究表明在肉鸡饲粮中添加15%玉米干酒糟及其可溶物肉鸡血清中IL-6含量显著上升;CHEN等[39]的研究表明保育猪饲喂 30%玉米酒糟及其可溶物的日粮3周会增加结肠组织中TNF-α的水平;WEBER等[40]给断奶猪饲喂含有7.5%干酒糟可溶物的日粮,发现在日粮中添加7.5%干酒糟可溶物会增加回肠组织中IL-6和IL-1β mRNA的相对丰度。本研究结果与其趋势相似。表明用75%酒糟饲喂山羊会使山羊肾脏免疫系统受到刺激,从而出现炎症反应。
分析显著富集到的3条信号通路发现共富集到21个相同的差异基因,这21个基因在NCBI中有注释的主要可以分为3类:NADH脱氢酶、细胞色素c氧化酶、ATP合酶。同时分析GO富集中的差异基因,发现生物过程中差异基因主要富集在电子传递链和呼吸电子传递链。氧化磷酸化是在细胞中产生的一系列氧化还原反应,是有氧呼吸的标志,其分解糖、脂、氨基酸等的最终产物是ATP[41]。线粒体电子传递链在一系列电子传递反应下通过氧化磷酸化产生细胞ATP,其提供细胞生存所需约95%的能量[42-43],如图8所示,真核生物电子传递链中的氧化磷酸化系统由5种酶组成:NADH-泛醌氧化还原酶(复合物I)、琥珀酸-泛醌氧化还原酶(复合物Ⅱ)、泛醇-细胞色素c氧化还原酶(复合物Ⅲ,或细胞色素bc1复合物)、细胞色素c氧化酶(复合物Ⅳ)和ATP合酶(复合物Ⅴ)[44-45]。NADH脱氢酶是电子传递链的“入口酶”,催化电子从NADH转移到电子链,是电子传递链的第一步,在能量代谢中起着至关重要的作用[46-48]。细胞色素C氧化酶是线粒体呼吸链末端的限速酶[49],通过其催化核心中存在的4种氧化还原活性金属辅因子催化电子从细胞铁色素c转移到分子氧,是呼吸链中唯一能够直接与氧作用,将氧还原成水的复合物[50-51],对有氧能量的产生有关键作用[52]。ATP合酶是多个蛋白亚单位组成的蘑菇状结构寡聚复合物,由F1水溶性部分和Fo组成,是细胞生物能量机制的关键参与者。其F1部分承担ATP合酶的催化活性,Fo部分嵌在线粒体内膜中形成跨膜离子通道。F1γ亚基转动时依次接触3组αβ单元中的β亚基,使β亚基的构象进行规律性、循环变化,γ亚基每旋转360度就合成3个分子的ATP 。ATP合酶逆向转动时,ATP被水解成ADP和Pi[53-55]。研究表明酒精通过多种机制使肾脏产生自由基并导致肾脏氧化应激[56]。本研究通过转录组分析发现肾脏的氧化磷酸化系统中的NADH 脱氢酶、细胞色素c氧化酶、ATP 合酶表达量明显差异,这说明饲喂75%酒糟会使山羊肾脏发生氧化应激,这与ABOUEL等[57]、李华磊等[30]的研究结果一致。此外,转录组测序也发现差异基因富集于NF-κB信号通路、JAK-STAT信号通路、MAPK信号通路等炎症通路中。这与本研究前面的研究结果一致,表明75%酒糟饲喂山羊会使山羊肾脏免疫系统受到刺激。
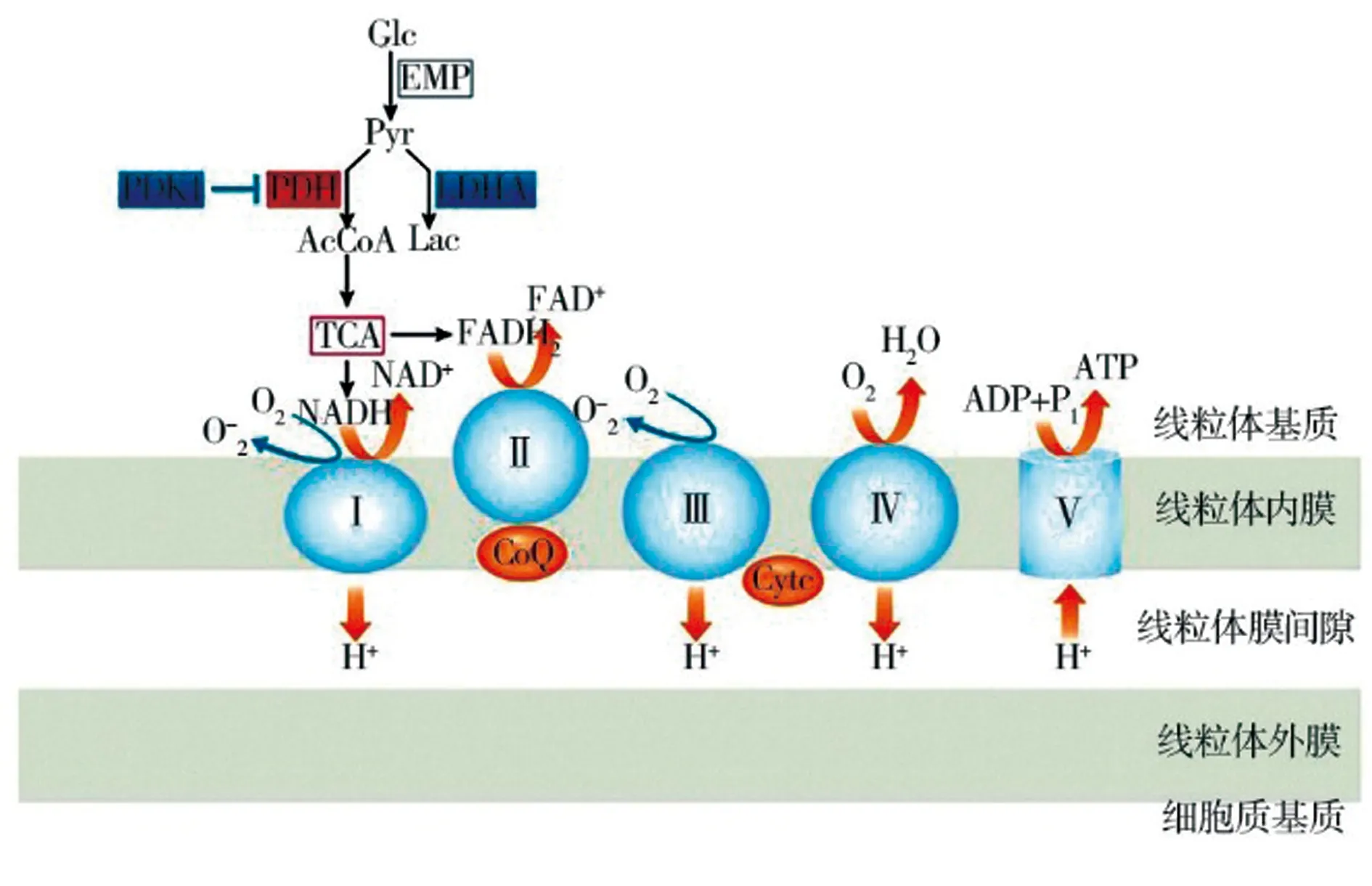
图8 氧化磷酸化反应
