纳米二氧化硅对小鼠睾丸间质细胞的毒性作用
2023-12-08方忞芊孙翊傑张倩茹许显玉陈风雷
方忞芊,孙翊傑,张倩茹,许显玉,2,陈风雷,2*
(1.扬州大学 兽医学院,江苏 扬州 225009;2.扬州大学 江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
纳米二氧化硅(silica nanoparticles,SNPs)是一种人工合成的纳米材料,已被广泛应用于农业、化妆品、食品添加剂和生物医学等领域[1]。由于SNPs的广泛应用,尤其在消费品和生物医药方面,增加了人和动物对其接触的风险[2-3]。根据其物理、化学性质及暴露时间和途径的不同,SNPs可在多种器官中造成毒性,如肝脏、肾脏、脑、肺脏、卵巢和睾丸[4-6]。SNPs可以穿过血睾屏障,分布在睾丸组织中,导致睾丸毒性[7-9]。
睾丸的主要功能是产生精子和分泌睾酮。研究发现,纳米材料的睾丸毒性是由纳米颗粒通过不同途径(包括血液循环或直接接触)积累造成的,睾丸对纳米颗粒积累十分脆弱和敏感[10],如氧化锌纳米颗粒、氧化铈纳米颗粒和SNPs[9,11-12]。SNPs可引起精曲小管损伤,导致精子活力下降[6]。然而,SNPs诱导的睾丸毒性机制还不十分清楚。虽然已有研究报道SNPs在精子发生中的毒性,但SNPs对睾丸间质细胞的毒性研究相对较少[13]。睾丸间质细胞通过促进睾酮的合成和分泌对精子发生起着重要作用。SNPs通过影响睾丸间质细胞从而引起睾丸毒性有待进一步研究。本研究通过体内和体外试验,探讨SNPs对睾丸间质细胞的毒性作用及调控机制,为进一步完善SNPs的生殖毒性研究提供理论依据。
1 材料与方法
1.1 实验动物昆明小鼠(雄性,28日龄)购自扬州大学比较医学中心,所有动物实验方案均得到扬州大学动物保护和伦理委员会批准和同意(获批编号:202103322)。 小鼠在23~25℃和12 h明/12 h暗循环条件下饲养。
1.2 主要试剂胶原酶Ⅰ购置于美国赛默飞世尔科技公司;Percoll细胞分离液购置于GE Healthcare Life Sciences公司;乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒、吖啶橙(acridine orange,AO)和Lyso-Tracker Red染色液购置于碧云天生物技术有限公司;抑肽素(pepstatin,Pep A)购置于MedChemExpress公司;CDST兔多克隆抗体购置于美国Abcam公司。
1.3 主要仪器设备流式细胞仪购置于美国贝克曼库尔特有限公司;透射电镜购置于日本日立公司;激光共聚焦显微镜购置于德国莱卡公司;Zetasizer Nano ZS纳米粒度电位仪购置于英国马尔文(Malvern)仪器公司。
1.4 SNPs制备和理化性质检测利用Stöber方法进行SNPs的合成。步骤如下:将1 700 mmol/L无水乙醇、155 mmol/L双蒸水和26 mmol/L氢氧化铵混合,加入16 mmol/L四乙氧基硅烷室温搅拌,超速离心后,用蒸馏水和95%乙醇洗涤,保存于无水乙醇中。试验用SNPs超速离心后,重悬于超纯水中。透射电镜检测SNPs形态结构并使用Image J软件分析粒径大小,Zetasizer Nano ZS检测SNPs在溶液中的粒径和电位。
1.5 SNPs处理小鼠将32只雄性ICR小鼠随机均分为4组,分别为生理盐水组(对照组)、12.5,25.0和50.0 mg/kg的SNPs组,经尾静脉注射处理小鼠。每日测体质量,15 d后处死小鼠。将睾丸从腹腔取出,浸泡在改良的戴维森液体组织固定液中(95%乙醇、甲醛、冰醋酸和超纯水按3∶2∶1∶2混合),进行苏木精-伊红(H&E)染色。
1.6 H&E染色固定后的睾丸样品分别用梯度酒精脱水,二甲苯透明,石蜡包埋,制作5 μm厚连续切片,按常规方法染色,用中性树脂封片后,显微镜观察形态结构。
1.7 睾丸间质细胞体外培养从雄性小鼠中取出睾丸,去除白膜后,放入含有1 g/L胶原酶Ⅰ的DMEM/F12中,37℃水浴孵育10 min,加入等量的含FBS的培养液终止消化;睾丸间质细胞重悬并使用Percoll梯度离心后,收集睾丸间质细胞,台盼蓝染色测定细胞活力;将纯化的睾丸间质细胞离心、重悬并培养于DMEM/F12培养基中,用3β-羟类固醇脱氢酶检测睾丸间质细胞纯度[14]。
1.8 SNPs在睾丸间质细胞中定位SNPs处理睾丸间质细胞后,PBS洗涤除去多余SNPs,4%多聚甲醛和2.5%戊二醛的PBS溶液中固定24 h。经PBS洗涤3次后,2%琼脂糖凝胶进行包埋,4%四氧化锇中固定,0.5%乙酸铀染色;经梯度乙醇脱水后,包埋入环氧树脂;切片后用3%醋酸铀酰-柠檬酸铅染色,使用透射电镜进行观察拍照。
1.9 LDH染色将3×104个细胞/200 μL培养液/孔接种到96孔板中培养24 h;然后用不同质量浓度的SNPs处理睾丸间质细胞后继续培养24 h;去除培养液并使用PBS洗涤3次,加入150 μL LDH溶液并混匀;继续培养1 h,分别取各孔上清120 μL,加入新96孔板中进行样品测定。
1.10 细胞凋亡测定通过流式细胞术检测SNPs处理后睾丸间质细胞的凋亡情况。将2 × 106个细胞/2 mL培养液/孔接种到6孔培养板中培养24 h;然后用不同质量浓度的SNPs(300,600和900 mg/L)处理24 h;PBS洗涤和胰蛋白酶消化后,收集细胞,加入含Annexin Ⅴ-FITC和PI的缓冲液重悬细胞,流式细胞术测定细胞凋亡率。
1.11 AO染色将睾丸间质细胞接种到含有盖玻片的24孔培养板中培养24 h,然后用SNPs处理24 h;PBS洗涤除去多余SNPs后,加入AO染色液,孵育20 min;去除AO染色液后,加入新鲜的细胞培养液;用激光共聚焦显微镜进行观察。
1.12 Lyso-Tracker Red染色将睾丸间质细胞接种到含有盖玻片的24孔培养板中培养24 h,然后用SNPs处理24 h;PBS洗涤除去多余SNPs后,加入浓度为50 nmol/L的Lyso-Tracker Red染色液,孵育20 min;去除Lyso-Tracker Red染色液后,加入新鲜的细胞培养液,用激光共聚焦显微镜进行观察。
1.13 免疫荧光染色将睾丸间质细胞接种到含有盖玻片的24孔培养板中培养24 h,然后用SNPs处理24 h;PBS洗涤除去多余SNPs后,4%多聚甲醛固定20 min;用含0.5% Triton X-100的PBS通透10 min;5%牛血清白蛋白封闭 1 h;用兔抗CDST一抗4℃孵育过夜;PBS洗涤后,加入荧光二抗避光孵育1 h,用DAPI孵育10 min;用激光共聚焦显微镜进行观察拍照。
1.14 Western blot检测使用全细胞蛋白提取试剂盒进行全蛋白提取;使用BCA蛋白含量检测试剂盒测定总蛋白质量浓度;等量蛋白用10% SDS-PAGE凝胶分离,电印迹法转移到PVDF膜上;转膜后,10%的脱脂奶粉封闭1 h;一抗4℃孵育过夜;PBST洗涤后,加入HRP标记的二抗,室温孵育1 h;PBST洗涤后,使用ECL发光液进行曝光,使用Quantity One软件进行灰度值分析。
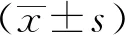
2 结果
2.1 SNPs理化性质为测定合成SNPs理化性质,透射电镜结果显示该SNPs是单分散圆球形颗粒(图1A);随机挑选透射电镜图利用Image J软件进行粒径大小分析,结果显示SNPs粒径大小为(106.90±13.43) nm(图1B);利用Zetasizer Nano ZS对SNPs在10 mmol/L NaCl溶液中的流体动力学尺寸和电位进行分析,结果显示SNPs粒径大小为 (110.80 ± 26.50) nm并带有负电荷,zeta电位绝对值为(49.7±6.6) mV[15]。
A.SNPs透射电镜结果;B.SNPs粒径大小分析结果
2.2 SNPs改变睾丸的组织结构为了检测在体SNPs对睾丸的毒性作用,尾静脉注射SNPs后,采用H&E染色观察睾丸组织结构变化。H&E染色结果显示,对照组睾丸组织结构正常,精曲小管内上皮细胞排列规则(图2Aa),睾丸间质和间质细胞排列紧密,所有生精细胞和支持细胞均正常(图2Ab);12.5 mg/kg SNPs组睾丸精曲小管内上皮细胞排列规则(图2Ba),但睾丸间质出现部分缺失及间质细胞减少现象(图2Bb);25.0和50.0 mg/kg SNPs组睾丸出现明显的精曲小管萎缩和变形(图2Ca、Da),睾丸间质细胞数量减少和生精上皮细胞排列紊乱现象(图2Cb、Db)。
2.3 SNPs定位于睾丸间质细胞溶酶体中为了检测SNPs是否能够进入睾丸间质细胞,利用透射电镜技术对SNPs在细胞中的定位进行了测定。结果显示,对照组中没有纳米颗粒(图3A、B),而SNPs组的睾丸间质细胞溶酶体中存在纳米颗粒的积累(图3C、D)。
2.4 SNPs降低睾丸间质细胞活性和增加凋亡为了确定SNPs对睾丸间质细胞的细胞毒性,对SNPs处理后的睾丸间质细胞进行细胞增殖、活性和凋亡测定。LDH结果显示,SNPs处理睾丸间质细胞后细胞毒性逐渐升高并呈现剂量依赖性特点(图4A);CCK-8结果显示,SNPs处理睾丸间质细胞后细胞活性逐渐降低并呈现剂量依赖性特点(图4B);流式细胞术检测结果显示,SNPs处理睾丸间质细胞后,与对照组凋亡率(5.62±0.60)%相比,300,600和900 mg/L SNPs处理组的凋亡率分别是(12.38±1.32)%,(16.11±1.86)%和(22.76±2.42)%,细胞凋亡显著增加(图4C、D)。
2.5 SNPs诱导溶酶体损伤为了进一步验证SNPs对睾丸间质细胞增殖和凋亡的影响机制,对溶酶体膜通透性和酸碱性进行了检测。使用溶酶体膜通透性染料AO和pH敏感的溶酶体染料Lyso-Tracker Red对溶酶体的通透性和酸度进行评估。激光共聚焦显微镜结果显示,与对照组相比,暴露于SNPs后AO染色绿色荧光和红色荧光强度均显著变强(图5Aa、Ab),Lyso-Tracker Red阳性结构面积显著增大(图5Ba、Bb),均与CQ组一致(图5Ac、Bc)。流式细胞术结果显示与激光共聚焦显微镜结果相一致(图5C~E)。为了检验SNPs对溶酶体完整性的影响,检测了天冬氨酸蛋白酶组织蛋白酶D(cathepsin D,CTSD)的亚细胞定位。荧光显微镜结果显示,对照组细胞表现为大的团块绿色荧光,而SNPs暴露的细胞为小的团块或散在绿色荧光,CQ组的细胞为弥漫性绿色荧光(图5F)。Western blot结果显示,SNPs组CTSD成熟亚型表达水平较对照组显著下降,这与CQ组一致(图5G、H)。
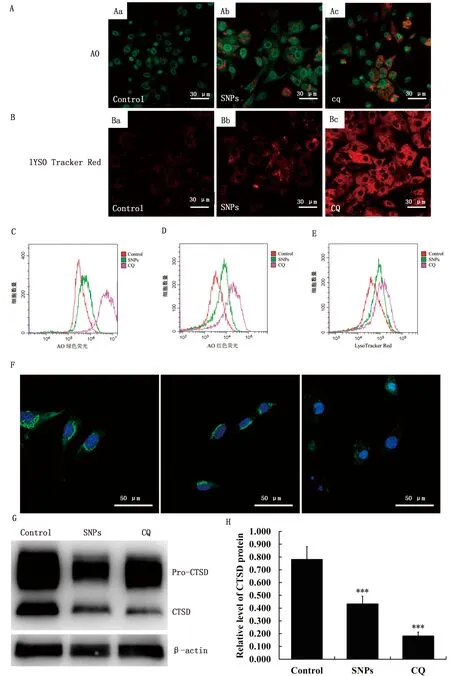
A.AO测定睾丸间质细胞中溶酶体通透性(Aa.对照组;Ab.300 mg/L SNPs组;Ac.100 mmol/L CQ组);B.Lyso-Tracker Red测定睾丸间质细胞中酸度(Ba.对照组;Bb.300 mg/L SNPs组;Bc.100 mmol/L CQ组);C.流式细胞术检测AO染色绿色荧光强度;D.流式细胞术检测AO染色红色荧光强度;E.流式细胞术检测Lyso-Tracker Red染色红色荧光强度;F.免疫荧光检测CTSD在睾丸间质细胞中的亚细胞定位;G.Western blot分析溶酶体中CTSD的水平;H.成熟CTSD水平的密度分析
2.6 Pepstatin A抑制SNPs诱导的细胞凋亡为进一步确认溶酶体损伤介导的细胞凋亡,我们使用CTSD抑制剂Pep A和SNPs共处理睾丸间质细胞,流式细胞术结果显示,与对照组(6.35±0.80)%相比,单独使用Pep A(5.64±0.76)%凋亡率无显著性差异;但是与SNPs组(20.08±2.20)%相比,联合使用Pep A和SNPs (14.30±1.80)%凋亡率显著降低(图6A、B)。

A.流式细胞术测定细胞凋亡率;B.细胞凋亡率结果分析柱状图
3 讨论
SNPs的大规模生产和广泛应用引起了公众对其环境暴露风险的关注[16]。在亚洲,每年有数百吨的SNPs被释放到水、土壤和垃圾填埋场中[17]。尽管SNPs被广泛认为具有良好的生物相容性,但在前期研究中也报道了SNPs对机体产生的毒副作用[18]。研究表明,SNPs能够透过血睾屏障,引起雄性生殖系统毒性。SNPs可在睾丸中积累,破坏生精小管,从而抑制精子发生,导致精子的质量和数量下降[6]。SNPs的睾丸毒性不仅能够影响精子发生,而且可调节机体睾酮水平[15]。睾丸间质细胞是睾丸的重要组成部分,主要参与睾酮的合成和分泌,睾丸间质细胞通过合成和分泌睾酮在精子发生过程中起着重要作用。然而,睾丸间质细胞损伤的机制尚不完全清楚。在本研究中,我们发现溶酶体损伤参与SNPs诱导的睾丸间质细胞凋亡。
根据世界卫生组织(WHO)的空气质量指南[19],小鼠通过体内尾静脉注射12.5 mg/kg(低剂量)、25.0 mg/kg(中剂量)和50.0 mg/kg(高剂量)的SNPs(110 nm,球形)。研究发现12.5 mg/kg的SNPs无明显毒性作用,而25.0和50.0 mg/kg的SNPs能够引起精曲小管结构异常和睾丸间质细胞减少。通过体外培养原代小鼠睾丸间质细胞我们发现,SNPs能够引起睾丸间质细胞毒性并呈现剂量依赖性。SNPs通过胞吞作用进入睾丸间质细胞后主要集中在单层膜状结构溶酶体中,并且通过改变溶酶体的酸碱性和膜的通透性参与SNPs诱导的细胞毒性。
溶酶体是真核细胞中单层膜酸性细胞器,是细胞内重要的降解和代谢中心,溶酶体结构的完整性对于细胞的生存和功能至关重要。溶酶体损伤通常会导致溶酶体膜通透化,溶酶体腔内的组织蛋白酶和蛋白水解酶释放到细胞质中,激活胞质内一系列级联反应,降低细胞清除能力,从而触发细胞凋亡途径。组织蛋白酶是溶酶体水解酶的一个家族,是溶酶体膜通透化的主要活性蛋白,其中CTSD是溶酶体内重要的组织蛋白酶,与溶酶体相关的细胞凋亡关系较为密切。研究发现,SNPs处理睾丸间质细胞后CTSD呈现小的团块或散在分布,表明CTSD从溶酶体中释放到细胞质,进一步研究发现细胞质中的CTSD水平显著升高,而溶酶体中的显著下降。前期研究报道显示,组蛋白酶可以调节BCL-2家族成员BID的活性,从而促进BCL-2相关蛋白寡聚化,使得寡聚化复合体转移到线粒体外膜上,导致线粒体通透化并释放细胞色素C,激活线粒体介导的Caspase依赖的细胞凋亡途径[20]。为了进一步确定组蛋白水解酶介导的溶酶体损伤参与SNPs诱导的睾丸间质细胞凋亡,我们利用CTSD的抑制剂Pep A和SNPs共处理睾丸间质细胞,发现细胞凋亡被抑制,进一步表明溶酶体损伤参与SNPs诱导的睾丸间质细胞毒性的产生。
