线粒体活性氧在氟化钠诱导PC12细胞NF-κB/NLRP3信号通路活化中的作用
2023-12-08陈德良付长其王国文
陈德良,张 磊,付长其,舒 适,王国文,彭 巍*
(1.光山县农业农村局 动物检疫监督所,河南 信阳 465450;2.河南牧业经济学院 动物医药学院 郑州市动物营养代谢病与中毒病重点实验室,河南 郑州 450000;3.青海省畜牧兽医科学院,青海 西宁 810000)
氟可随多种途径进入机体中,对神经、生殖、免疫以及消化系统等造成明显的毒性损伤[1]。研究发现,氟具有明显的神经毒性,它能破坏血脑屏障,促进氟在中枢神经系统中的蓄积,引起炎性级联反应和诱导神经元以及胶质细胞凋亡,最终导致退行性疾病的发生[2]。PC12细胞可传代且经诱导分化后具备神经细胞的特性,被广泛用于神经系统相关疾病的体外研究[3]。
目前有关氟毒性损伤的机制主要包括:氧化应激和凋亡基因表达等[4]。最新研究表明,细胞焦亡与氟暴露引起的细胞损伤密切相关。过量的氟会导致核苷酸结合寡聚化结构域样受体家族含热蛋白结构域蛋白3(NLR family pyrin domain containing 3,NLRP3)炎症小体的活化,使胱天蛋白酶1(Caspase-1)被剪切,最终引起细胞焦亡[5]。然而,NLRP3活化是否参与氟化钠(NaF)致PC12细胞损伤及其作用机制尚未完全清楚。因此,本研究以PC12细胞为研究对象,通过不同方法来探究氟致神经细胞损伤中的作用及其潜在机制,为氟暴露引起神经毒性损伤的临床治疗提供相应的参考靶点。
1 材料与方法
1.1 细胞、抗体和试剂大鼠肾上腺嗜铬细胞瘤细胞株(PC12细胞)由中科院上海生命科学研究院细胞库提供;NaF、Mito-TEMPO、吡咯烷二硫代氨基甲酸酯(PDTC)购自于美国Sigma-Aldrich公司;细胞培养基DMEM/F12购自于美国Hyclone公司;胎牛血清(FBS)、青链霉素购自美国Gibco公司;NLRP3 siRNA和阴性对照siRNA(NC siRNA)购自于上海吉玛公司;Lip3000脂质体转染试剂购自美国Invitrogen公司;MitoSOX活性氧探针购自美国ThermoFisher公司;CCK-8试剂购自日本同仁公司;BCA蛋白浓度测定试剂盒、乳酸脱氢酶(LDH)检测试剂盒、细胞核蛋白提取试剂盒购自上海碧云天公司;大鼠白介素1β(IL-1β)和IL-18 ELISA检测试剂盒购自武汉elabscience公司;含pyrin结构域NLRP3抗体、核因子κB p65(NF-κB p65)抗体、磷酸化NF-κB p65(p-NF-κB p65)抗体、核纤层蛋白(LAMIN B)抗体购自于英国Abcam公司;Caspase-1 p20购自武汉亚科因公司;磷酸化IκB激酶β(p-iKKβ)抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体、山羊抗兔荧光二抗、辣根过氧化物标记的二抗购自江苏Affinity公司。
1.2 主要仪器CO2培养箱和超低温冰箱(美国Thermo公司);EPOCH酶标仪(美国BioTek公司);蛋白电泳和转膜系统(美国BIO-RAD公司);化学发光系统(上海Tanon科技有限公司);冷冻离心机(德国Eppendorf公司);倒置荧光显微镜(日本Nikon公司)。
1.3 细胞培养、转染及处理将细胞用DMEM/F12培养液(10%的FBS、100 mg/L链霉素、1×105U/L青霉素)放于37℃、5%CO2的培养箱中培养,当细胞的融合率达到80%左右时对细胞进行传代培养。细胞按照每孔1×106个接种于6孔板上,待细胞生长至约70%融合时,参照Lip3000操作说明将NLRP3 siRNA和NC siRNA转至细胞中。转染6 h后更换培养液,继续培养48 h后进行后续试验。NLRP3 siRNA的序列为:5′-ggauagguuugcugggau-att-3′,NC siRNA的序列为:5′-uucuccgaacgugucac-gutt-3′。为研究NaF对PC12细胞NLRP3炎性小体的影响,细胞在转染相应的siRNA后,按照文献[6]报道,用质量浓度为80 mg/L的NaF继续处理细胞24 h,分为NC siRNA组(对照组)、NC siRNA+NaF组、NLRP3 siRNA组、NLRP3 siRNA+NaF组;为研究NF-κB通路在NaF致NLRP3活化中的作用,细胞提前用浓度为50 μmol/L的PDTC处理1 h,之后用质量浓度为80 mg/L的NaF继续处理细胞24 h,分为对照组、NaF组和NaF+PDTC组;为研究线粒体活性氧(mitochondrial reactive oxygen species,mtROS)对NF-κB/NLRP3通路的影响,提前给予500 μmol/L mito-TEMPO预处理2 h,之后用质量浓度为80 mg/L的NaF继续处理细胞12 h,分为对照组、mito-TEMPO组、NaF组和mito-TEMPO+NaF组。
1.4 CCK-8检测每孔接种1×104个细胞,在处理结束后每孔中加入10 μL的CCK-8溶液,避光孵育2 h后与450 nm波长条件下测定吸光度(D)值。细胞存活率(%)=(D样品孔值-D本底值)/(D对照组值-D空白孔值)×100%。
1.5 LDH检测将细胞按照1×106个/孔的密度接种于6孔板中,待细胞处理结束后收集上清,根据 LDH 检测试剂盒的说明书进行操作,测定D值,计算LDH含量。
1.6 ELISA检测将细胞按照1×106个/孔的密度接种于6孔板中,待细胞处理结束,按照ELISA试剂盒说明书检测细胞培养液上清中IL-1β和IL-18的分泌水平。
1.7 mtROS检测将细胞按照1×105个/孔的密度接种于24孔细胞培养板,待处理结束,弃掉原有培养液,在每孔里面加入 1 mL的MitoSOX工作液(5 μmol/L),37℃条件下避光孵育 15 min;用不含血清的 DMEM/F12培养基轻洗3遍,胰酶消化收集细胞,上流式细胞仪进行检测。
1.8 免疫荧光处理结束后加入4%的多聚甲醛进行室温固定,20 min后用PBS清洗,加入Triton X-100透化液透化,1%的BSA室温封闭1 h,加入一抗(1∶100)置于4℃摇晃孵育过夜,最后加入荧光二抗(1∶200),37℃避光孵育1 h。DAPI染色液避光染色5 min后置于荧光显微镜下拍照观察。
1.9 Western blot检测按照核蛋白提取说明书将处理好的细胞进行核蛋白的提取。细胞总蛋白则是将处理完成后的细胞用含有磷酸酶抑制剂的细胞裂解液,放置于冰上裂解20 min,之后于4℃,12 000 r/min条件下离心10 min,收集上清。样品通过BCA法测定蛋白浓度,将蛋白样品进行SDS-PAGE电泳、转膜、封闭等步骤后进行一抗4℃过夜孵育,一抗的稀释比例分别为NLRP3(1∶1 000)、Caspase-1 p20(1∶1 000)、p-iKKβ(1∶1 000)、p-NF-κB p65(1∶1 000)、NF-κB(1∶1 000)、GAPDH(1∶5 000)、LAMIN B(1∶5 000)。一抗孵育完成后用洗涤液进行清洗,二抗在室温条件下进行孵育1 h(1∶1 000),ECL发光液进行显影。采集到的图像使用Image J软件对灰度值进行分析。
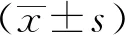
2 结果
2.1 NLRP3 siRNA降低了NaF诱导的PC12细胞NLRP3炎性小体活化如图1A、B所示,与对照组比较,NLRP3 siRNA组细胞中NLRP3蛋白水平显著降低(P<0.01);NaF组细胞中NLRP3和Cas-pase-1 p20的蛋白表达水平明显升高,较对照组差异显著(P<0.01);与NaF组比较,NLRP3 siRNA+NaF组细胞中NLRP3和Caspase-1 p20蛋白表达水平降低(P<0.01)。与NaF组比较,NLRP3 siRNA干预降低了NaF处理PC12细胞培养液上清中IL-18和IL-1β的含量(P<0.01)(图1C)。
2.2 NLRP3 siRNA减弱了NaF诱导的PC12细胞毒性损伤如图2A、B所示,与对照组比较,NaF组细胞的存活率显著降低,LDH漏出率升高,差异显著(P<0.01);与NaF组比较,NLRP3 siRNA+NaF组细胞的存活率升高,LDH漏出率则明显降低,有统计学意义(P<0.01)。

A.细胞存活率;B.LDH活性
2.3 PDTC减弱了NaF诱导的NF-κB通路活化如图3所示,与对照组比较,NaF处理后细胞中p-NF-κB p65和p-iKKβ水平升高(P<0.01);与NaF组比较,PDTC+NaF组细胞中p-NF-κB p65和p-iKKβ蛋白水平降低,具有统计学意义(P<0.01)。

A.免疫印迹;B.蛋白表达
2.4 PDTC减弱了NaF诱导的NF-κB p65入核NaF处理后细胞核中的NF-κB p65水平与对照组比较显著增加(P<0.01),而PDTC干预抑制了NaF暴露引起的NF-κB p65入核(P<0.01)(图4A~C)。
A.免疫荧光测定NF-κB p65入核;B.Western blot检测细胞核中NF-κB p65表达;C.蛋白表达
2.5 PDTC减弱了NaF诱导的NLRP3炎性小体活化如图5A、B所示,与NaF处理组比较,PDTC+NaF组细胞中NLPR3和Caspase-1 p20蛋白表达水平降低,具有统计学差异(P<0.01);PDTC+NaF组细胞培养液上清中IL-18和IL-1β的含量较NaF单独处理组也明显降低(P<0.01)(图5C)。

A、B.NLRP3和Caspase-1 p20蛋白表达;C.细胞上清中IL-1β和IL-18含量
2.6 Mito-TEMPO减弱了NaF诱导的mtROS水平升高如图6所示,与对照组比较,NaF组细胞中的mtROS水平显著升高(P<0.01);加入Mito-TEMPO减弱了NaF暴露引起的mtROS水平升高,较NaF组比较有显著性差异(P<0.01)。

图6 Mito-TEMPO对NaF处理PC12细胞mtROS水平的影响
2.7 Mito-TEMPO减弱了NaF引起的NF-κB/NLRP3信号通路活化如图7A、B所示,与NaF组比较,mito-TEMPO+NaF组中p-NF-κB p65、p-iKKβ和NLRP3蛋白水平降低(P<0.01)。此外,mito-TEMPO+NaF组细胞培养液上清中IL-18和IL-1β的含量较NaF处理组明显降低(P<0.01)(图7C)。

A、B.p-NF-κB p65、iKKβ和NLRP3蛋白表达;C.细胞上清中IL-1β和IL-18含量;Ⅰ.对照组;Ⅱ.Mito-TEMPO组;Ⅲ.NaF组;Ⅳ.Mito-TEMPO+NaF组
3 讨论
氟会通过多种途径进入机体并在体内累积。近年来的研究揭示氟会透过血脑屏障,因此有关氟神经毒性受到越来越多关注[7]。进一步深入探究氟致大脑神经元的毒性作用对于氟神经毒性的阐明有着重要的意义。细胞焦亡作为一种新的细胞死亡方式,有研究指出氟对细胞毒性损伤与其诱导细胞焦亡有关[8]。NLRP3炎症小体在细胞焦亡中起至关重要的作用,NLRP3炎症小体激活后诱导Caspase-1活化,进而促进IL-18和IL-1β前体的成熟与释放[9]。本研究的结果进一步表明,NLRP3 siRNA抑制了NaF诱导的NLRP3和Caspase-1活化,细胞上清液中IL-1β和IL-18的分泌水平显著降低。NaF导致的细胞存活率降低随着NLRP3 siRNA的干预得到明显改善。此外,PC12细胞中LDH的释放水平显著增加,进一步说明NaF处理后会对细胞膜的完整性造成破坏,而抑制NLRP3减轻了LDH的释放。这些研究结果证实了NLRP3炎症小体的活化参与了NaF诱导的PC12细胞损伤。
NF-κB是氟致细胞损伤过程中的关键因子[10-11]。生理状况下,NF-κB在胞质中处于未活化的状态。当受到外界刺激时会引起NF-κB p65和iKKβ蛋白的磷酸化,从而引起NF-κB的活化,激活下游基因的转录[12-13]。本研究结果表明,NF-κB抑制剂PDTC能够降低NaF暴露PC12细胞中p-NF-κB p65、p-iKKβ、NLRP3、Caspase-1 p20蛋白水平,NaF诱导的NF-κB p65入核也被PDTC抑制。此外,细胞培养液上清中的IL-18和IL-1β水平明显降低。这些结果提示活化的NF-κB信号参与了NLRP3炎症小体的激活。
ROS的过量生成是NaF致机体损伤的重要因素[14]。线粒体是细胞中ROS产生的主要来源,且mtROS的过量生成与NLRP3炎症小体的激活密切相关,特别是在NF-κB信号通路的活化方面发挥重要作用[15-17]。本研究的结果表明,NaF暴露能够诱导PC12细胞中mtROS的产生,而mtROS抑制剂mito-TEMPO的使用抑制了mtROS的生成。此外,清除过量的mtROS可以减弱NaF诱导的p-NF-κB p65、iKKβ、NLRP3蛋白水平的升高,IL-1β和IL-18的分泌水平也明显降低。这些研究结果表明mtROS在NF-κB/NLRP3通路活化中的作用。我们发现抑制mtROS并不能够完全清除NaF对NF-κB/NLRP3信号的影响。烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase4,NOX4)也参与ROS的调控[18]。最新研究发现,NaF暴露引起的ROS水平升高与NOX4表达水平升高有关[19]。那么NOX4/ROS在NaF致PC12细胞NF-κB/NLRP3通路活化中的作用需要未来进一步的研究。
综上所述,NaF暴露诱导PC12细胞产生大量的mtROS,mtROS促进NF-κB通路的活化继而激活NLRP3介导的细胞焦亡。本研究补充完善了氟致神经细胞损伤的机制研究,进一步为氟中毒的防治提供理论基础。
