非靶向脂质组学探究花生四烯酸对奶牛乳腺上皮细胞的影响
2023-12-08董伟韬赵晓萱刘佩雯贺海健张全伟贺钰烜赵兴绪
卢 挺,董伟韬,陈 艳,赵晓萱,刘佩雯,贺海健,张全伟,贺钰烜,赵兴绪*,张 勇 *
(1.甘肃农业大学 动物医学学院,甘肃 兰州 730070;2.甘肃省动物生殖生理及繁殖调控重点实验室,甘肃 兰州730070;3.甘肃农业大学 生命科学与技术学院,甘肃 兰州 730070)
奶牛乳腺上皮细胞(bovine mammary epithelial cells,MAC-T)是奶牛乳腺实质的主要细胞,在哺乳期间,MAC-T产生酪蛋白、乳转铁蛋白、乳糖、甘油三酯和富含甘油三酯的脂滴等各种乳成分,然后通过顶膜,将每一种乳成分分泌到乳腺腺泡腔中[1-2]。MAC-T还是高度分化的免疫细胞,在受到外界刺激时,通过Toll样受体识别病原体的相关分子模式,产生免疫应答反应,被广泛用于体外奶牛乳房炎模型的建立和体外泌乳研究[3]。奶牛乳腺炎是奶牛场最常见的疾病,由于患病奶牛的乳腺组织发生炎症反应,导致病牛产奶量减少、牛奶质量变差,每年都造成巨额的经济损失。牛奶中的脂类具有多种生物活性,对人类健康和食品的物理功能都有影响。脂质除了基本的能量储存和代谢作用外,还是启动、促进和化解炎症的信号分子[4]。HAYASHI等[5]通过液相色谱技术,发现在患有乳房炎的奶牛所产的牛奶中,多不饱和脂肪酸的含量有一定的变化,其中ω-6多不饱和脂肪酸呈现升高趋势,ω-3多不饱和脂肪酸呈下降趋势,并且在不同的炎症发展时期,所含的脂质含量及种类各不相同。
花生四烯酸(arachidonic acid,AA)是一种20碳链的ω-6多不饱和脂肪酸,化学式为C20H32O2,通常呈发夹状结构。AA在机体内与细胞膜上的磷脂相结合,如磷脂酰胆碱、磷脂酰乙醇胺等,赋予细胞膜流动性和灵活性[6]。炎症的发生过程中,在几种磷脂酶的作用下,AA从细胞膜上释放出来。游离状态的AA可以通过酶促(脂氧化酶、环氧化酶和细胞色素P450途径)和非酶促(花生四烯酸乙醇胺途径和自氧化反应)反应途径,产生前列腺素、白三烯、异前列腺素等一系列类二十烷酸,参与免疫、炎症、氧化应激反应和损伤过程[7]。而细胞膜中的AA通过脱酰基循环,使细胞中游离AA的浓度保持在很低的水平,并限制AA的氧化,使体内AA保持在一个很低的水平,防止未酯化的AA不受控制的积累,诱导细胞凋亡而损害细胞存活[8]。POMPEIA等[9]报告称,AA的细胞毒性是不可否认的,但很可能是它在体内的基本功能之一。
脂质组学技术能够分析和鉴定脂质分子及其互相作用的分子,进而揭示多样性脂质分子代谢及其代谢调控,从而深入探索其与细胞、器官甚至机体的生理、病理过程之间的关系[10-11]。因此,本研究基于非靶向脂质组学分析AA处理后MAC-T脂质代谢图谱的变化,识别AA改变的关键差异代谢物,以期为深入研究AA的生理作用和进一步阐明AA影响MAC-T的泌乳及免疫功能提供理论依据。
1 材料与方法
1.1 试剂与仪器AA(Sigma);DMEM高糖培养基(HyClone);胎牛血清(Invigentech);甲醇、乙腈、甲基叔丁基醚、甲酸铵、二氯甲烷和异丙醇(CNW Technologies)。超净工作台、CO2细胞培养箱、Q Exactive Focus高分辨质谱仪、离心机(Thermo);超高效液相仪(Agilent);研磨仪(上海净信科技有限公司)和超声仪(深圳方奥微电子有限公司)。
1.2 细胞培养及处理MAC-T购自青旗(上海)生物技术发展有限公司。细胞在含15%胎牛血清的DMEM高糖培养基中,于37℃、5%CO2培养箱中培养,待细胞融合到70%~80%时用于后续试验。使用0.1 mg/L AA刺激MAC-T细胞12 h,设为AA处理组,添加同等体积完全培养基组设为对照组。
1.3 样品制备细胞脂质代谢物的提取要求细胞量至少达到 1×107/mL 以上。将按1.2方法处理好的AA处理组和对照组细胞消化终止后离心,各收集3份。加入200 μL H2O,液氮中反复冻融1 min 3次。加入480 μL的甲基叔丁基醚-甲醇混合液(5∶1),-40℃ 静置1 h后,4℃、6 000 r/min离心15 min。取上清300 μL于EP管中,真空干燥,用100 μL二氯甲烷-甲醇混合液(1∶1)复溶,4℃、13 000 r/min离心15 min,取上清-80℃储存备用。所有样品另取20 μL上清混合为质控(QC)样品。
1.4 非靶向脂质组学分析UHPLC条件:采用Phenomen Kinetex C18色谱柱,流动相A为乙腈-水(6∶4),10 mmol/L甲酸铵;B相为异丙醇-乙腈(9∶1),0.5 mmol/L甲酸铵水溶液。梯度洗脱程序为:0~1.0 min,40%B;1.0~12.0 min,40%~100%B;12.0~13.5 min,100%B;13.5~13.7 min,100%~40%B;13.7~18.0 min,40%B。在柱温55℃、流速0.3 mL/min的条件下进样2 μL。MS条件:正、负离子模式喷雾电压分别为5和 -4.5 kV;正、负离子模式的毛细管温度分别为320和300℃;护套气体流量为35 Arb;辅助气体流量为10 Arb;全MS分辨率为 70 000;MS/MS 的分辨率为 17 500;NCE模式碰撞能量为15/30/45 eV。
1.5 数据分析用ProteoWizard将原始数据转换成.mzXML格式,用XCMS做保留时间校正、峰识别、峰提取和峰对齐等处理,于BiotreeDB(V2.1)自建二级质谱数据库进行脂质鉴定。使用 SIMCA-V 16.0.2 和SPSS 26.0软件进行统计分析,包括T检验、变异倍数分析、主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 试验质量控制将分析得到的QC样本基峰色谱图进行谱图重叠比较,可以看出样本的色谱峰响应强度和保留时间基本重叠,说明试验重复性好(图1)。因此用于本试验仪器的稳定性、试验的重复性、数据质量的可靠性良好。
图1 QC样本在正离子(A)和负离子(B)模式下总离子流色谱图
2.2 单变量统计分析单变量统计分析可以直观地展示比较组中脂质分子的整体差异表达倍数情况。图2显示了AA处理组细胞与对照组细胞之间脂质代谢物差异分析比较火山图。如图3所示,本项目在2种离子模式下共鉴定出1 145种脂质分子,涉及6大类脂质,即甘油磷脂类、甘油脂类、鞘脂类、孕烯醇酮脂类、糖脂类和固醇脂类。

图2 AA处理组、对照组在正离子(A)、负离子(B)模式下的差异脂质比较分析的火山图
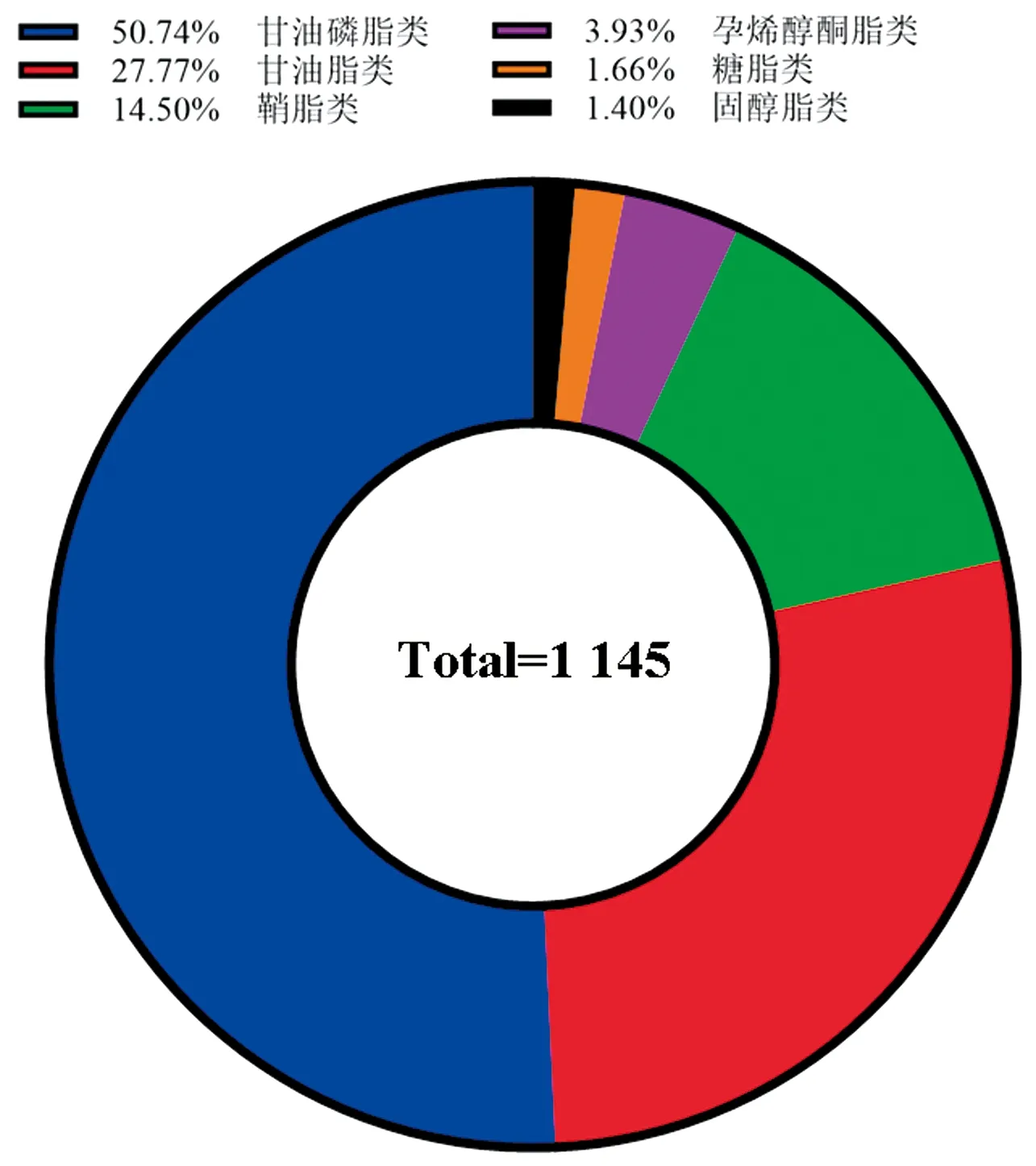
图3 脂质分类图
2.3 多元变量统计分析使用SIMCA软件对数据进行对数转换加中心化格式化处理,然后对所得的脂质分子进行PCA和OPLS-DA建模分析(图4)。PCA(图4 A、B)和OPLS-DA(图4C、D)模型显示,在正、负离子2种模式下,AA处理组与对照组的样品点均有明显分离,没有重叠,并且样本全部处于95%置信区间内,这表明AA处理后,MAC-T细胞内的脂质代谢物发生显著变化。随后对OPLS-DA模型进行200次置换检测(图4E、F),其中R2Y是相关系数,表示模型的拟合效果,是1个定量的测量(范围0~1),表示所建立的模型能在多大程度上代表真实的数据;Q2表示OPLS-DA模型的预测能力,Q2越靠近0.50表示模型预测能力较好。由图4E可见,正离子模式下R2Y和Q2分别为1.01和0.28,负离子模式下R2Y和Q2分别为0.99和0.49,这些参数表明OPLS-DA模型不存在过拟合现象,且具有良好的分离性能和可预测性,数据可靠。

A,C,E.正离子模式; B,D,F.负离子模式;A、B图中横坐标PC[1]和纵坐标PC[2]分别表示第一和第二主成分得分值;C、D图中横坐标t[1]P表示预测主成分得分值,纵坐标t[1]O表示正交主成分得分值;E、F图中横坐标表示200次置换检验的置换保留度,纵坐标表示R2Y或Q2的取值,Intercepts表示R2Y和Q2回归直线的截距
2.4 显著性差异表达的脂质分子筛选在正、负离子模式下,根据T检验的P值小于0.05和OPLS-DA模型第一主成分的变量权重值(VIP)大于1,这2个指标为卡值标准,对检测出的脂质分子进行进一步的筛选,从1 145个脂质中筛选出10个具有统计意义的显著性差异脂质分子,归属为4个脂类,7个亚类。其亚类分别为:酰基葡萄糖醛酸糖脂(acylglucuronosyldiacylglycerol,AcylGlcADG)、葡萄糖醛酸糖脂(glucuronosyldiacylglycerol,GlcADG)、单酰基甘油(monoacylglycerol,MAG)、磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇(phosphatidylethanol,PEtOH)、硫化己糖基神经酰胺脂肪酸(sulfurHexosylceramide hydroxyfatty acid,SHexCer)和甘油三酯(triacylglycerol,TG)。由图5可以看出,AA处理组与对照组相比较,AcylGlcADG(14:1/14:1/14:1)、GlcADG(18:2/22:2)、MAG(18:1)、PC(22:5/22:5)、PC(4:0/27:0)、PC(7:0/26:1)、PEtOH(16:0/16:1)、PEtOH(16:1/18:1)和TG(16:0/18:0/20:4)的相对表达量显著降低;SHexCer(d35:2)的表达量显著升高。
2.5 差异脂质分子相关性分析进行差异脂质相关性分析有利于进一步了解生物状态变化过程中代谢物之间的相互调节关系,代谢物相关性往往揭示了代谢物之间变化的协同性:与某类代谢物变化趋势相同,则为正相关;与某类代谢物变化趋势相反,则为负相关。采用pearson方法对差异脂质的定量值进行相关系数计算,2个变量之间的相关程度通过相关系数r来表示。相关系数r的值在-1~1之间,但可以是此范围内的任何值。正相关时,r值在0~1之间;负相关时,r值在-1~0之间。r的绝对值越接近1,两变量的关联程度越强,r的绝对值越接近0,两变量的关联程度越弱。相关系数在0.6~1.0之间呈强相关,0.4~0.6之间呈中等程度相关,0.2~0.4之间呈弱相关,0.0~0.2之间呈极弱相关或无相关。
处于同一代谢通路上的脂质分子具有较强的相关性。在正离子模式下(图6A),PC(7:0/26:1)和PC(4:0/27:0)、PC(22:5/22:5)、PEtOH(16:0/16:1)、TG(16:0/18:0/20:4)、MAG(18:1)相互之间呈强正相关性,且PC(7:0/26:1)和PC(22:5/22:5)、TG(16:0/18:0/20:4)、MAG(18:1)之间具有显著性相关(P<0.05);PC(4:0/27:0)和PEtOH(16:0/16:1)具有显著性相关(P<0.05);PC(22:5/22:5)和TG(16:0/18:0/20:4)、MAG(18:1)之间具有显著性相关(P<0.05);TG(16:0/18:0/20:4)和MAG(18:1)之间具有显著性相关(P<0.05)。在负离子模式下(图6B),SHexCer(d35:2)和PEtOH(16:1/18:1)、GlcADG(18:2/22:2)之间呈强负相关性;与AcylGlcADG(14:1/14:1/14:1) 之间呈中等负相关性;AcylGlcADG(14:1/14:1/14:1)和PEtOH(16:1/18:1)、GlcADG(18:2/22:2)相互之间呈强正相关性,且具有显著性相关(P<0.05)。

A.正离子模式;B.负离子模式。图中横纵坐标代表该组对比的差异脂质,不同位置的色块代表对应位置脂质间的相关系数大小,红色表示正相关,蓝色表示负相关,颜色越深代表相关性越强
3 讨论
奶牛乳房炎是饲养牛的传统传染病,对动物福利和经济问题都会造成严重的影响。由于预防和治疗措施的高成本、牛奶产量较低以及早期淘汰,奶牛乳房炎是养牛业遭受经济损失的主要原因[12]。MAC-T在泌乳和乳腺免疫方面发挥着重要的作用,被广泛用于体外奶牛乳房炎的研究[13-14]。
AA作为哺乳动物必须脂肪酸之一,具有多种生物学功能。AA特殊的结构,使其天然的与细胞膜上的磷脂相结合,赋予膜柔韧性、流动性和选择性渗透性,尤其是神经系统、骨骼肌和免疫系统功能所必需的[6,15]。AA可以通过酶促和非酶促反应参与机体氧化应激反应和损伤过程,会产生负责解决炎症和伤口愈合的介质。AA还被证实具有治疗曼氏血吸虫和日本血吸虫的潜力[16]。AA对膜流动性的控制会影响参与细胞信号传导的特定膜蛋白的功能,并在维持细胞和细胞器完整性以及血管通透性方面发挥重要作用。AA对于动物体的生长发育和繁殖性能具有一定的促进作用,还可以提高动物体的免疫力[17]。但是AA在机体内的作用并不总是有益的,有报道称,AA氧化产生的代谢物不会引发炎症,但会促进炎症过程的发展,摄入过量的AA会增加心血管疾病的发生以及动脉粥样硬化的形成,且对一些细胞具有毒理作用[18]。AA诱导的细胞坏死具有膜完整性迅速丧失、细胞体积增大、存在松散和凝聚的染色质、嗜碱粒细胞减少和DNA完整性被破坏等特点[9]。本研究采用UHPLC-QE-MS系统,对外源性AA处理的MAC-T进行非靶向脂质组学分析,共检测出1 145种脂质代谢物,发现外源性AA对MAC-T细胞中甘油磷脂类、甘油脂类和鞘脂类影响较大。
本研究中,甘油脂类差异脂质MAG(18:1)和TG(16:0/18:0/20:4) 的含量显著降低。甘油脂通常是指由甘油和脂肪酸(含饱和和不饱和脂肪酸)经酯化所生成的脂类。甘油扮演贮存与输送的角色,大部分存在于乳糜微粒及极低密度脂蛋白内。研究表明TG是外源性AA的第1个受体库,随后转移到其他磷脂库中。在细胞活化过程中,AA从磷脂中释放,然而,其中大量的AA会被迅速重新整合到TG库中储存,只有少量的AA参与下一步的代谢过程。一旦磷脂库在细胞激活过程中耗尽,TG库也会向磷脂库提供AA[19]。细胞中游离AA水平由2个竞争反应控制,一方面,磷脂酶A2介导的磷脂sn-2位置的切割产生游离脂肪酸;另一方面,CoA依赖性酰基转移酶调节的酰化反应将游离脂肪酸重新掺入磷脂。在未刺激细胞中,再酰化反应在磷脂酶A2介导的脱酰化步骤中占主导地位,因此游离AA保持在非常低的水平[20]。而当游离状态的AA增加时,AA的释放速率明显小于重新结合到TG库和磷脂库中的速率,导致细胞中TG含量降低,进而影响TG代谢为二酰甘油,使得二酰甘油向磷脂代谢转化率降低[21-22]。这或许是本试验中磷脂PC(22:5/22:5)、PC(4:0/27:0)、PC(7:0/26:1)、PEtOH(16:0/16:1)和PEtOH(16:1/18:1)含量显著降低的原因之一。本试验还发现了糖脂类差异脂质AcylGlcADG(14:1/14:1/14:1)和GlcADG(18:2/22:2)的含量显著降低;鞘脂类差异脂质SHexCer(d35:2)的含量显著升高,鞘脂及其代谢产物如神经酰胺和磷酸胆碱,还参与调节细胞的生长、分化、衰老和细胞程序性死亡等许多重要的信号转导[23]。综上所述,外源性AA可使MAC-T细胞脂类代谢发生变化,主要影响甘油脂类和鞘脂类代谢过程,这些差异表达的脂质分子可能成为奶牛乳房炎发展过程中的相关脂类干预靶点。
