猪重组RBP4蛋白可溶性原核表达纯化及生物学活性鉴定
2023-12-08赵鹤娇韩庆兵商营利
赵鹤娇,韩庆兵,商营利
(山东农业大学 动物医学院 山东省动物生物工程与疫病防治重点实验室,山东 泰安 271018)
视黄醇结合蛋白4(retinol binding protein,RBP4)属于脂质运载蛋白家族的成员,于1968年首次被发现能够特异性结合视黄醇[1],是体内转运维生素A的主要蛋白,其相对分子质量大小为21 kDa[2]。RBP4主要在肝脏中合成和表达[3],在血液中以可结合形式和游离形式存在。RBP4可以分泌至细胞外,与膜受体TLR4、TLR2[4]和STRA6[5]结合后激活巨噬细胞、单核细胞和树突状细胞等免疫细胞[6],诱导促炎细胞因子产生[7]。作为一种脂肪因子,RBP4已被证实与肿瘤、肥胖和Ⅱ型糖尿病等多种代谢性疾病发生密切相关[8-10],而猪RBP4在猪繁殖性能和抑制脂肪细胞分化[11]等代谢方面发挥重要作用[12]。不仅如此,已经发现RBP4在免疫代谢的调节中起重要作用,与丙型肝炎病毒(hepatitis C virus,HCV)[13]、甲型流感病毒(influenza A virus,IAV)[14]、人类免疫缺陷病毒(human immunodeficiency virus,HIV)[15]、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)[16]和血吸虫[17]介导的疾病进展、炎症和死亡率密切相关。多种病原感染机体后能上调RBP4的水平,研究表明敲低RBP4的表达能够显著增加HCV的复制,利用酵母双杂交系统发现RBP4能够与戊型肝炎病毒(hepatitis E virus,HEV)衣壳蛋白发生相互作用[18],而在感染了PRRSV的猪肺脏中以及患有坏死性小肠结肠炎的早产猪中RBP4都是一个典型上调的免疫应答基因[16]。虽然RBP4在病毒感染和炎症调控方面可能发挥重要作用,但RBP4如何调控病毒感染以及与对病毒致病性的影响尚不十分清楚。鉴于RBP4是一类分泌型蛋白,因此通过体外表达获得重组蛋白对研究其功能及作用机制具有重要意义。

A.pET32a-pRBP4表达载体构建示意图;B.猪rbp4基因PCR扩增(M.DL2000 DNA Marker;1.PCR扩增产物);C.pET32a-pRBP4表达载体双酶切验证(M.DL5000 DNA Marker;2.重组表达载体经BamHⅠ和XhoⅠ内切酶消化)

A.考马斯亮蓝染色检测重组pRBP4融合蛋白的表达;B.免疫印迹鉴定重组pRBP4融合蛋白的表达;M.蛋白Marker;EV.空载体组;S.上清,可溶性蛋白;P.沉淀,包涵体蛋白。下同

A.诱导温度的优化; B.IPTG诱导剂浓度的优化;C.诱导时间的优化;D.超声功率的优化(1.功率100 W;2.功率150 W;3.功率200 W)
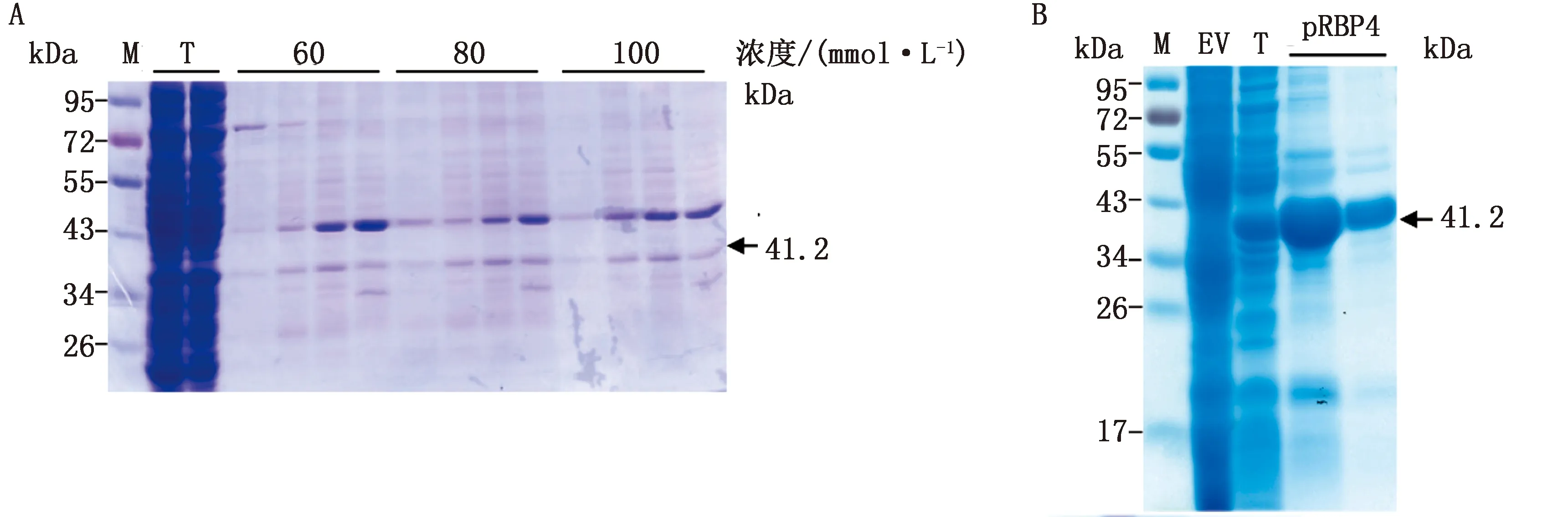
A.考马斯亮蓝检测不同浓度咪唑结合缓冲液对pRBP4可溶性蛋白的纯化效果(M.蛋白Marker;T.纯化前总蛋白);B.考马斯亮蓝染色检测以最优条件诱导及纯化pRBP4可溶性蛋白效果(M.蛋白Marker;EV.空载体组;T.纯化前总蛋白)
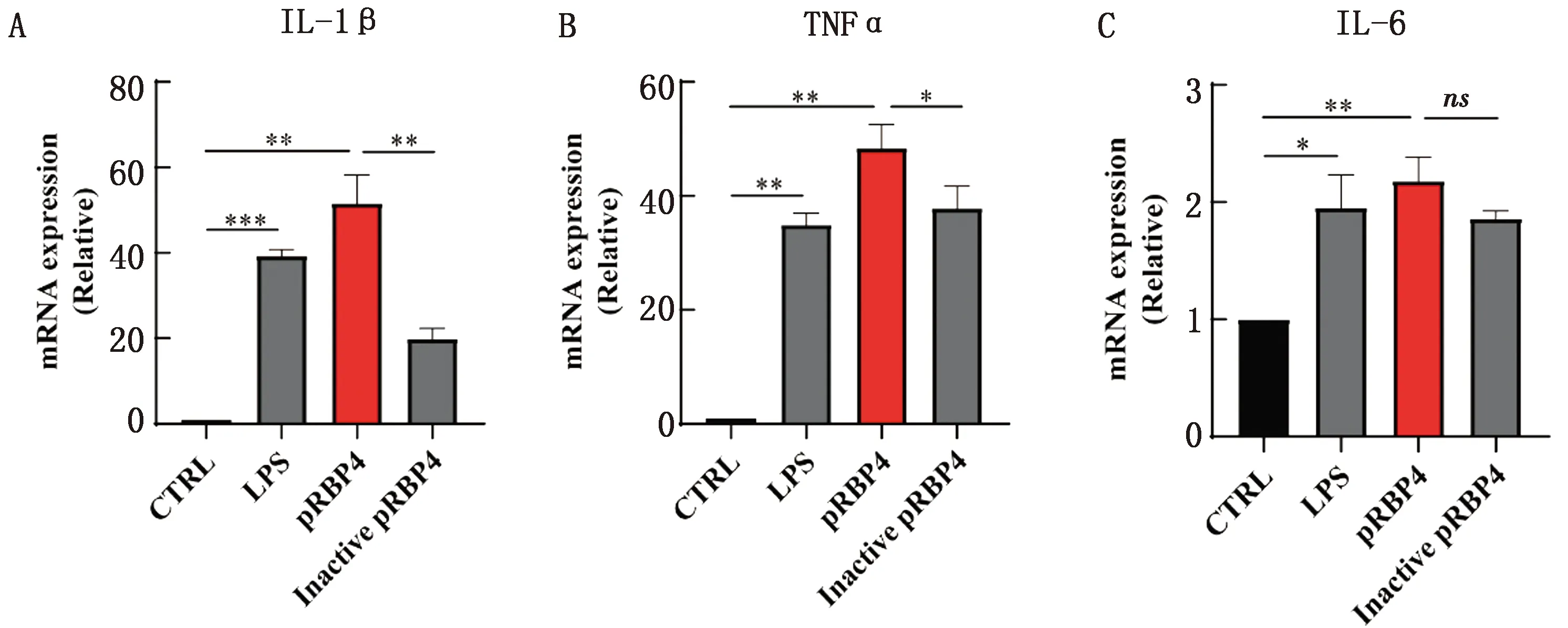
A.IL-1β;B.TNFα;C.IL-6(CTRL.阴性对照组;LPS.阳性对照组;pRBP4.在PAMs细胞中加入1 mg/L纯化的猪RBP4蛋白;Inactive pRBP4.失活蛋白对照组)。ns.无显著差异;*.P<0.05,**.P<0.01,***.P<0.001
已有多项研究通过大肠杆菌[19]、毕赤酵母或杆状病毒系统表达了人[20]、小鼠以及兔[21]重组RBP4蛋白,并证实了RBP4可以直接参与血管内皮炎症性疾病的发生发展[22-24],以及引发脂肪组织炎症[4],但目前对于猪重组RBP4(pRBP4)的体外研究较少。已有的研究显示重组pRBP4蛋白在原核表达系统中不易溶[25]且难以确保其生物活性[26]。有学者通过毕赤酵母系统和pEASY-E1原核载体制备了pRBP4蛋白,但制备过程受到溶解性低、表达量少或成本高等限制因素的影响。因此制备可溶性的、高活性的猪重组RBP4蛋白对于研究其在病毒感染、炎性反应和疾病防控中的功能及作用机制具有重要意义。本研究利用大肠杆菌表达系统,构建了pET32a-pRBP4原核表达载体,实现了pRBP4蛋白的可溶性表达,通过优化表达和纯化条件获得了具有良好生物学活性的重组蛋白,为RBP4的功能研究提供了有利工具。
1 材料与方法
1.1 主要试剂与抗体pET-32a质粒、BL21(DE3)菌株、DH5α菌株由本实验室保存;LPS、青链霉素混合液购自Thermo Fisher公司;PBS购于Biological Industries公司;RPMI 1640 培养基、胎牛血清购自Gibco公司;His-tag鼠单克隆抗体(货号:66005-1-1g)购于Proteintech公司;辣根酶标记山羊抗小鼠IgG购于北京中杉金桥生物技术有限公司;PrimeSTAR HS DNA Polymerase、限制性内切酶、T4DNA连接酶、反转录酶 M-MLV (RNase H-)、RRI、DNA Marker、Premixed Protein Marker等均购自宝生物工程(大连)有限公司;BCA蛋白浓度测定试剂盒、透析袋、PEG8000购于索莱宝生物科技有限公司;总RNA提取试剂盒购自普洛麦格(北京)生物技术有限公司;DNA凝胶回收试剂盒、质粒提取试剂盒购于天根生化科技(北京)有限公司。
1.2 载体构建根据猪rbp4基因mRNA序列 (NM_214057.1),设计扩增引物,分别在上、下游引入BamHⅠ、XhoⅠ酶切位点。序列如下,prbp4-F:CGGGATCCATGGAATGGGTTTGGGCGC;pr-bp4-R:CCGCTCGAGCTACAAAATGTTTCTTT-CCG。使用PrimeSTAR高保真酶以猪肾细胞(PK-15)的cDNA为模板扩增prbp4基因片段,长度为606 bp。反应体系按照说明书进行,反应程序为98℃ 10 s变性,56℃ 5 s退火,72℃ 45 s延伸,35个循环;4℃ 20 min。PCR产物以0.8%琼脂糖凝胶电泳检测,DNA凝胶回收试剂盒回收目的片段,与pET-32a载体连接。阳性克隆质粒经双酶切验证后,由上海生工公司进行测序。
1.3 重组蛋白表达与提取将序列比对正确的阳性质粒pRBP4-pET32a及空载体pET-32a分别转化到BL21(DE3) 感受态细胞中,挑取单克隆,在LB液体培养基中培养12 h。随后按照1∶100的比例将菌液接种至新鲜LB液体培养基中,置于37℃摇床培养至对数生长中期。加入1.0 mmol/L的IPTG诱导剂,16℃ 150 r/min振摇过夜,4℃离心收集菌体沉淀后称重,以1 g/20 mL比例加入预冷的超声缓冲液(1 mol/L Tris,5 mol/L NaCl,1‰ Triton-X100,pH=7.5)重悬。使用超声破碎仪(新芝生物)以150 W功率,运行5 s停止5 s,在冰水浴中超声30 min。4℃离心分别收集上清(可溶性蛋白)和沉淀(包涵体蛋白),并以相同比例1 g/20 mL用超声缓冲液重悬包涵体沉淀,通过考马斯亮蓝染色和免疫印迹鉴定蛋白表达情况。
1.4 聚丙烯酰胺凝胶电泳(SDS-PAGE)与考马斯亮蓝染色配制10% 聚丙烯酰胺凝胶,将蛋白溶液与6×SDS loading按照5∶1的比例混匀,金属浴100℃煮沸10 min,取15 μL蛋白样品进行SDS-PAGE。电泳结束将分离胶浸入考马斯亮蓝R-250染色液(10%冰醋酸、25%异丙醇、1‰R-250)中,摇床孵育染色5 h后更换脱色液(10%冰醋酸、30%甲醇),重复换液直至脱色液不再变蓝。
1.5 免疫印迹取蛋白样品进行10%的SDS-PAGE,将蛋白质由凝胶转移至PVDF膜,5%脱脂奶粉室温封闭,4℃过夜孵育His-tag鼠单克隆抗体,山羊抗小鼠二抗室温孵育后显影拍照。
1.6 蛋白纯化与浓缩将超声提取的可溶性蛋白液用0.45 μm滤器过滤去除大颗粒杂质,利用AKTA蛋白纯化系统和HisTrap层析柱(GE Healthcare)纯化pRBP4蛋白。分别用含有60,80,100 mmol/L咪唑的洗涤缓冲液(50 mmol/L Na2HPO4、0.3 mol/L NaCl)平衡层析柱,待紫外吸收峰稳定后,将蛋白溶液分批上机,吸附于层析柱上。待紫外吸收值趋于稳定,用洗脱缓冲液(50 mmol/L Na2HPO4、0.3 mol/L NaCl、500 mmol/L 咪唑)剥离pRBP4蛋白,分别收集蛋白样品进行SDS-PAGE,通过考马斯亮蓝染色分析最佳去除杂蛋白的咪唑浓度。根据pRBP4融合蛋白大小选择截留相对分子质量8~14 kDa的透析袋,按照说明书预处理透析袋。将纯化的蛋白溶液加入至透析袋中,根据蛋白溶液体积以1∶100的比例在烧杯中加入1×PBS无菌透析液,在透析后4,8,12 h更换透析液。随后在透析袋表面孵育PEG8000进行浓缩,用BCA试剂盒测定最终蛋白浓度,加入30%甘油分装储存于-80℃。
1.7 细胞培养猪原代肺泡巨噬细胞(porcine alveolar macrophages,PAMs)分离参考此前的方法进行[27],以含1%青链霉素、10% 胎牛血清的RPMI 1640培养基于5% CO2、37℃培养箱中培养。PAMs细胞以0.7×106细胞/mL接种于12孔板中,分别加入PBS、LPS、pRBP4蛋白以及100℃煮沸后的pRBP4蛋白,与细胞共孵育6 h后收集细胞。
1.8 细胞总RNA提取与荧光定量(qPCR)分析根据说明书的步骤,使用总RNA提取试剂盒提取细胞总RNA(Promega)。使用反转录酶M-MLV、随机引物和oligo(dT)20对提取的RNA进行反转录获得cDNA,稀释至5 mg/L,以此作为模板取10 ng进行荧光定量分析。使用2×RealSTAR Green Fast Mixture (GenStar) 通过ABI Step One (Applied Biosystems,USA) 荧光定量仪器对cDNA进行qPCR测定分析。PAMs细胞GAPDH基因用作内参对照,用于qPCR测定的特异性引物序列显示在表1中,每个样品进行3次生物学重复试验,通过2-ΔΔCt方法分析数据。

表1 qPCR引物序列
1.9 数据统计分析试验数据均进行3次独立重复,P值通过Prism GraphPad(v8.0)软件中配对样品t检验或未配对样品t检验计算,P<0.05被认为具有显著性差异。
2 结果
2.1 猪RBP4原核表达载体的构建为了构建原核表达载体,利用设计的特异性引物,以PK-15细胞的cDNA为模板,特异性扩增prbp4基因,与pET-32a载体经内切酶BamHⅠ和XhoⅠ线性化后,使用T4连接酶连接(图 1A)。PCR扩增产物经琼脂糖凝胶电泳检测,出现1条约606 bp的基因片段,大小与预期一致(图1B)。阳性质粒经双酶切后,产生目的片段和线性化载体(图1C),且测序比对正确,表明pET32a-pRBP4表达载体构建成功。
2.2 猪重组RBP4融合蛋白表达鉴定为了验证pRBP4蛋白表达情况,将原核表达载体转化至BL21(DE3)表达菌中,经IPTG诱导表达后超声破碎提取蛋白,经聚丙烯酰胺凝胶电泳后通过考马斯亮蓝染色和免疫印迹检测可溶性蛋白和包涵体蛋白表达情况。考马斯亮蓝染色可见在41.2 kDa处有明显条带,与预期大小相符,pRBP4蛋白虽然大量存在于包涵体中,但也能够形成可溶性蛋白(图 2A)。将上清经40 mmol/L咪唑浓度的洗涤缓冲液纯化后,1 g菌可以获得0.066 mg蛋白。目的蛋白用His-tag鼠单克隆抗体进行免疫印迹,可在约41.2 kDa处检测到单一条带(图 2B),以上结果表明重组pRBP4融合蛋白表达成功。
2.3 猪重组RBP4可溶性蛋白表达条件优化为了增加可溶性蛋白表达量,对诱导剂浓度、诱导时间、诱导温度以及超声破碎功率等方面对重组蛋白的表达条件进行全面优化,以期获得大量高活性的可溶性重组pRBP4蛋白。将生长至对数期的菌液设置于不同条件下诱导表达后(表2),收集菌体后进行超声裂解,提取上清和沉淀中的总蛋白进行聚丙烯酰胺凝胶电泳,考马斯亮蓝染色检测重组蛋白表达情况。为了确定最佳诱导温度,在将菌液放置在不同温度下诱导表达,结果显示在16℃下诱导表达上清中可溶性蛋白表达量最高(表2A组,图3A)。为进一步确定最适诱导剂浓度,16℃条件下在菌液中加入不同浓度的IPTG进行诱导表达,结果表明0.5 mmol/L IPTG诱导的条件下可获得最高的可溶性蛋白表达量,同时包涵体蛋白含量有所降低(表2B组,图3B)。在16℃和0.5 mmol/L IPTG条件下诱导表达不同时间,发现在诱导表达 12 h时,上清中可溶性蛋白含量最多(表2C组,图3C)。同时检测了不同超声功率对菌液裂解和蛋白提取情况的影响,发现150 W功率条件下可以获取更多的可溶性蛋白(表2D组,图3D)。以上结果表明,重组pRBP4最佳表达条件为16℃、0.5 mmol/L IPTG诱导表达12 h,重组蛋白提取最佳超声功率为150 W。

表2 重组pRBP4不同诱导表达条件的优化
2.4 可溶性猪重组RBP4融合蛋白纯化利用AK-TA蛋白纯化系统以1 mL HisTrap HP层析柱纯化可溶性pRBP4蛋白,为了确定去除杂蛋白的最佳咪唑浓度,分别用含有不同浓度咪唑的缓冲液洗涤蛋白。考马斯亮蓝染色可见纯化后在41.2 kDa处有1条明显且单一的目的条带,相比于60 mmol/L缓冲液纯化的效果,80和100 mmol/L缓冲液纯化后的蛋白纯度没有显著提升,且蛋白含量有所下降(图4A)。表明以60 mmol/L咪唑的洗涤缓冲液纯化蛋白能在保证蛋白纯度的情况下最大量地回收到pRBP4蛋白。为了避免高浓度咪唑对蛋白活性及后续细胞试验的影响,对纯化的蛋白溶液进行透析,将高浓度咪唑置换为PBS,浓缩后进行考马斯亮蓝染色,结果显示获得了单一纯净的重组pRBP4可溶性蛋白(图4B)。经过蛋白浓度测定,1 g菌最终获得0.42 mg蛋白,相比于优化条件前,所获蛋白量提升了5.4倍。
2.5 猪重组RBP4可溶性蛋白的生物活性鉴定为了验证纯化后pRBP4蛋白的生物学活性,检测了重组pRBP4蛋白是否能够诱导炎症细胞因子的产生。在PAMs细胞中加入pRBP4蛋白,以LPS做阳性对照,PBS做阴性对照,通过qPCR检测炎症细胞因子mRNA表达水平。同时,为了排除蛋白表达过程中产生的内毒素影响,以100℃煮沸后的重组pRBP4蛋白溶液作对照。结果显示纯化的重组pRBP4可溶性蛋白可以显著诱导炎症因子IL-1β、TNFα以及IL-6的表达(图5)。表明该研究获得的猪重组RBP4可溶性蛋白可以有效增加巨噬细胞中促炎细胞因子的分泌,具有良好的生物学活性。
3 讨论
体内研究表明RBP4在生殖发育、慢性炎症以及病毒感染等过程中具有重要作用[16,28],但其体外功能研究较少。有研究通过毕赤酵母分泌表达获得了重组pRBP4蛋白[29],但表达量较低;随后通过原核表达载体pEASY-E1成功表达了重组pRBP4蛋白[25],但以包涵体形式存在。由于包涵体重组蛋白在复性、重折叠和纯化过程较为复杂,因此限制了pRBP4的制备。本研究通过摸索和优化表达条件,成功实现了pRBP4蛋白的可溶性原核表达,且获得的重组蛋白具有良好的生物活性,为进一步研究RBP4在体内外的功能和制备pRBP4抗体奠定了良好基础。
蛋白表达载体及系统是影响蛋白表达形式的关键因素之一,不同的载体表达相同蛋白会产生不同的效果。原核表达载体具有快速、简便、成本低等优点,但表达的重组蛋白常以无活性的包涵体形式存在[30]。研究发现不同原核表达载体表达融合蛋白的活性不同,且蛋白在溶解性和生物学活性方面存在明显差异[31]。例如,以原核表达载体pET-28a[19]、pET-19b[32]等大肠杆菌[33-34]中表达人源RBP4,重组蛋白均以包涵体形式存在。在pRBP4表达过程中,研究使用了不同原核表达载体表达pRBP4蛋白,发现pET-30a-pRBP4重组载体中不能表达目的蛋白,在PGEX-6P-1-pRBP4重组载体表达的蛋白以包涵体形式存在。为了实现pRBP4的可溶性表达,最终选择了含有硫氧还蛋白 (TrxA) 标签的pET-32a作为载体表达目的蛋白。TrxA作为一种分子伴侣,可通过与目标蛋白共表达来帮助蛋白正确折叠,增加目的蛋白的水溶性,有利于蛋白的可溶性表达以及大量制备和蛋白纯化[35]。虽然本研究成功实现了pRBP4的部分可溶性表达,但仍有大部分重组蛋白形成包涵体,这可能是由于初始诱导条件使得早期大部分肽链合成过快,超过折叠形成正确构型的速度,仅有小部分肽链正确折叠形成可溶性蛋白分泌至上清中[36]。另外,RBP4本身的结构特性可能也会影响其蛋白表达形式,造成极易形成包涵体,目前已有学者利用生物信息分析对蛋白突变进行设计以改变其结构和活性特征,并实现了高活性、稳定可溶性蛋白的表达[37]。因此我们进一步通过降低诱导温度、增加诱导时间、优化IPTG浓度和超声功率,提升了上清中可溶性蛋白的表达量。本研究发现随着温度逐渐降低,可溶性蛋白含量升高,表明在低温条件下可以诱导产生更多的可溶性pRBP4蛋白。因为低温能有效防止菌体厌氧生长,抑制乙酸生成对蛋白表达的影响[37]。除此之外,在菌体超声破碎时的功率也会影响pRBP4可溶性蛋白的含量,这可能是由于不同的超声功率影响了声强、声压进而对细菌壁的破碎程度不同,释放蛋白含量不同[38]。减缓培养速度以及优化IPTG浓度等这些处理均可以有效降低蛋白合成速度,避免了蛋白合成过快导致其不能正确折叠[39]。
重组原核蛋白的活性对后续的功能研究至关重要。研究表明RBP4与TLR2、TLR4等受体结合,激活JNK和NF-κB信号炎症因子表达和释放[4]。因此,RBP4对细胞炎症因子的表达水平可反映其生物学活性。此前纯化的人源重组RBP4蛋白[40]在终质量浓度为25~100 mg/L可以显著诱导原代人视网膜毛细血管内皮细胞[32]以及鼠原代骨髓巨噬细胞中IL-1β、TNFα、IL-6等炎症因子表达[4,41],而本研究获得的可溶性pRBP4蛋白,在终质量浓度为1 mg/L情况下即能够诱导PAMs中表达相同或更高倍数的炎症因子,表明该方法能够获得具有较高活性的重组pRBP4蛋白。本研究获得的可溶性重组蛋白,避免了包涵体蛋白在复性过程中对蛋白天然构象和活性可能产生的不利影响[42],使其更接近天然蛋白。总之,本研究利用原核表达系统通过优化表达条件成功制备了大量可溶性的、高活性的猪重组RBP4融合蛋白,为进一步研究RBP4在猪疾病中的功能奠定了基础。
