qseC及luxS双基因缺失对多杀性巴氏杆菌毒力及其交叉免疫保护性的影响
2023-12-08王媛媛高丽旭彭远义李能章
胡 沛,彭 旭,程 丹,李 甜,王媛媛,高丽旭,袁 祥,彭远义,李能章
(西南大学 动物医学院,重庆 北碚 400715)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)是一种重要的畜禽病原,可感染人和多种动物[1-5],严重威胁人和动物健康。据不完全统计,目前发现有40余种动物可感染多杀性巴氏杆菌,包括所有家禽家畜,给养殖户带来了巨大的经济损失[6-7]。根据荚膜和LPS组成差异,多杀性巴氏杆菌可以分为5种荚膜血清型(A、B、D、E和F)和1~16种LPS血清型[8-9],不同血清型间的交叉免疫保护性弱。多杀性巴氏杆菌现有商品化疫苗种类较少,主要针对猪牛源荚膜B型和兔及家禽源荚膜A型等少数几种多杀性巴氏杆菌血清型的防控,由于多杀性巴氏杆菌菌株的宿主特异性差异及出现的部分血清型菌株跨物种感染,致使传统的多杀性巴氏杆菌灭活疫苗和弱毒疫苗并不能达到理想的免疫保护效果,因此,开发新型广谱性疫苗是多杀性巴氏杆菌感染防控的关键。
前期研究发现,群体感应基因qseC的缺失,可致使多杀性巴氏杆菌的毒力显著降低,并且赋予了菌株较强的交叉免疫保护特性[10],该研究表明群体感应基因缺失赋予了多杀性巴氏杆菌菌株交叉免疫保护特性。细菌群体感应系统(quorum sensing system)主要有4种:LuxI/LuxR信号系统[11]、AIP介导的信号系统[12]、AI-2介导的信号系统[13]和AI-3介导的信号系统[14]。qseC基因属于AI-3介导的群体感应系统[15],分析发现多杀性巴氏杆菌中还存在AI-2介导的群体感应系统,luxS基因参与AI-2合成[16],有研究发现,基于大肠杆菌aroA基因缺失株构建的aroA及luxS双基因缺失株,其运动性、黏附性、侵入性和毒力进一步得到了降低[17]。那么在多杀性巴氏杆菌中,qseC及luxS这2个来源不同群体感应系统的基因缺失,是否在菌株相关生物性状变化量及交叉免疫保护效果上有叠加效应,这是本研究想要探讨的问题,以期为多杀性巴氏杆菌广谱性疫苗研发奠定基础。
本研究在多杀性巴氏杆菌qseC基因缺失株的基础上,进行了luxS基因的缺失,成功获得qseC及luxS基因双缺失株(ΔqseCΔluxS),并对其荚膜、生物膜产生、生长繁殖情况及抗逆性等生物学特性以及致病力变化、交叉免疫保护特性等,与ΔqseC及野生株PmCQ2进行了比较分析。
1 材料与方法
1.1 菌株、质粒及实验动物牛源A型多杀性巴氏杆菌qseC基因缺失株(ΔqseC:LD50=5.28×107CFU,来源于PmCQ2)、牛源A型多杀性巴氏杆菌(PmCQ1:LD50=3.80×102CFU,PmCQ2:LD50=3.40×103CFU)、牛源F型多杀性巴氏杆菌(PmF:LD50=1.00×108CFU)、禽源A型多杀性巴氏杆菌(PmQ:LD50≈1.00 CFU)和兔源A型多杀性巴氏杆菌(PmR:LD50=1.00×104CFU)均由西南大学动物医学院预防兽医学创新实验室构建及分离暂存。牛源B型多杀性巴氏杆菌(PmB,CVCC470:LD50=5.00×103CFU)和猪源A型多杀性巴氏杆菌(PmP,CVCC1662:LD50≈1.00 CFU)购自中国兽医药品监察所兽医微生物菌种保藏中心,以上LD50均为肌肉途径感染小鼠模型测定。用于多杀性巴氏杆菌温敏型基因缺失载体pUC19oriKanR由实验室前期构建保藏。昆明小鼠(雌性,18~20 g)购自恩斯维尔实验动物中心,其饲养及试验方法由西南大学实验动物伦理审查委员会监督。
1.2 主要试剂马丁肉汤、LB等培养基购自青岛海博生物技术有限公司;卡那霉素、Stains all粉末(7423-31-6)、结晶紫(548-62-9)及吐温-20均购自上海生工生物工程股份有限公司;限制性核酸内切酶购自TaKaRa;In-Fusion®HD Cloning Kit (PT5-162-1)购自Clontech;羊抗鼠IgG-HRP购自Thermo Scientific公司;15 A VG矿物油乳化剂为重庆澳龙生物制品有限公司赠送;TMB显色液(3,3′,5,5′-四甲基联苯胺)购自Beyotime公司。
1.3 双基因缺失株的构建本研究选择对ΔqseC中的luxS基因进行缺失。缺失株构建方法参见前期研究[18],所用引物见表1。取-80℃保藏的ΔqseC划线接种在马丁固体培养基上,37℃培养24 h,提取基因组DNA备用。以基因组DNA为模板,利用luxS5′ARM-F/R和luxS3′ARM -F/R引物对,扩增luxS基因上、下游同源臂,纯化上、下游同源臂,以此为模板,采用luxS5′ ARM -F/luxS3′ ARM-R进行扩展,获得上、下游同源臂融合DNA片段,纯化片段克隆进多杀性巴氏杆菌温敏型基因缺失载体pUC19oriKanR中,重组载体通过电转化方法转入ΔqseC细胞中,PCR初步筛选获得luxS基因缺失株,其后通过PCR方法确认luxS基因的缺失情况,验证luxS缺失株的准确性,对验证正确的缺失株,在无抗培养基上37℃条件下连续传代培养,保证缺失株的抗性消除和遗传稳定性。

表1 基因缺失株构建所需引物
1.4 生长曲线测定取-80℃保存的PmCQ2、ΔqseC及ΔqseCΔluxS分别划线接种于马丁固体平板,37℃倒置培养24.0 h,各挑取3~4个菌落分别接种于5 mL 马丁液体培养基中,37℃、220 r/min震荡培养12.0 h,平板计数,其后接种等量菌体于相同体积马丁液体培养基中,37℃、220 r/min震荡培养,每隔1.5 h取样测定D600值,共取11个时间点,绘制生长曲线。试验每次设3个生物重复,重复2次。
1.5 荚膜多糖含量测定分别取PmCQ2、ΔqseC及ΔqseCΔluxS对数生长期菌液各1 mL,12 000 r/min离心15 min,弃上清,无菌PBS洗涤菌体3次,用1 mL PBS重悬菌体,其后取10 μL稀释进行平板计数,剩余菌悬液放置42℃金属浴中处理1 h后,12 000 r/min离心15 min,取100 μL上清液加入900 μL荚膜染色液(由0.2 g/L 的Stains all固体粉末、0.06%的冰醋酸和50%的甲酰胺配制而成)中,测定D640值。分别取浓度为0,0.5,1.0,2.0,3.0,4.0,5.0 μg/100 μL的透明质酸溶液100 μL,加入到900 μL荚膜染液中,测定D640值绘制标准曲线。根据标准曲线计算各菌株的荚膜多糖含量(多杀性巴氏杆菌荚膜主要成分为透明质酸)。试验每次设5个生物重复,重复2次。
1.6 生物膜形成量测定分别取PmCQ2、ΔqseC及ΔqseCΔluxS对数生长期菌液,平板计数后,用BHI肉汤液体培养基稀释(108CFU/mL),分别加入 48孔板中(400 μL/孔),阴性对照组加入BHI肉汤,37℃静置培养48 h,吸净菌液,于培养孔中加入甲醇固定(200 μL/孔),30 min后,吸出甲醇液,PBS洗涤3次,室温干燥1 h,其后,每孔加入1%结晶紫200 μL ,静置处理30 min后,弃染色液, PBS洗涤3次,室温干燥,每孔加入33%冰乙酸200 μL,37℃恒温处理30 min,测定D630值。试验每次设5个生物重复,重复2次。
1.7 血清敏感性试验分别取PmCQ2、ΔqseC及ΔqseCΔluxS对数生长期菌液,平板计数,稀释至1×105CFU/mL,各取10 μL菌液,分别加入900 μL灭活牛血清(56℃处理30 min)和未灭活牛血清中,37℃处理1 h后进行平板计数。血清处理细菌存活率=(未灭活牛血清中细菌数/灭活牛血清中细菌数)×100%。试验每次设3个生物重复,重复2次。
1.8 半数致死量(LD50)测定取ΔqseCΔluxS对数生长期菌液,平板计数,分别以2.2×106,2.2×107,2.2×108,2.2×109CFU剂量腹腔途径感染小鼠(8只/组),对感染小鼠进行1周监测,对濒死小鼠实施安乐死并记入死亡数。采用Reed-Muench计算ΔqseCΔluxS的LD50。
1.9 双缺失株灭活疫苗的制备取ΔqseCΔluxS进行划线培养,挑取3~4个菌落接种于5 mL马丁液体培养基,37℃、220 r/min振荡培养12 h,按1∶100接种入200 mL马丁培养基中,37℃、220 r/min振荡培养8 h后取出,取菌液进行活菌计数的同时进行浓缩,加入终浓度为0.15%的甲醛溶液,37℃静置处理24 h,静置期间每隔6 h摇1次,使菌体充分灭活,其后取灭活菌100 μL,涂于马丁固体平板,37℃培养24 h,检验灭活效果。灭活合格菌液及PBS液分别与15A VG矿物油佐剂按4∶1的体积比混合,充分振荡乳化直至静置不分层为止,制备出ΔqseCΔluxS灭活疫苗(5×109CFU/mL)和PBS乳化剂。取100 μL灭活疫苗涂布于马丁固体平板上,37℃培养24 h,进行活菌检测,另取6只小鼠,分别在背部皮下接种100 μL灭活疫苗,评价疫苗的安全性。合格疫苗4℃保存备用。
1.10 双缺失株疫苗免疫保护性测定选用18~20 g雌性昆明小鼠分组(6只/组),按照表2~3分别接种灭活疫苗和弱毒疫苗(对数生长期培养菌的PBS重悬液),免疫剂量与文献YANG等[10]中的ΔqseC疫苗一致。灭活疫苗免疫途径采用背部皮下多点注射,加强免疫1次,在首免后14 d进行,弱毒疫苗免疫采用腿部肌肉注射,仅免疫1次。2种疫苗菌在首免后21 d分别采用3.6×107CFU PmCQ1 (LD50=3.8×102CFU),1.8×107CFU PmCQ2 (LD50=3.4×103CFU),1.1×107CFU PmB (LD50=5.0×103CFU),1.2×108CFU PmF (LD50=1.0×108CFU),1.2×105CFU PmR (LD50=1.0×104CFU),10 CFU PmP (LD50≈1.0 CFU),10 CFU PmQ (LD50≈1.0 CFU)进行肌肉攻毒。攻毒后每天观察小鼠,持续1周,对濒死小鼠实施安乐死并记入死亡数。疫苗保护率按以下公式计算:保护率=(对照组死亡率-免疫组死亡率)/对照组死亡率×100%。

表2 灭活苗免疫分组和攻毒

表3 弱毒苗免疫分组和攻毒
1.11 抗体消长规律分析雌性昆明小鼠分为2组(6只/组),组1肌肉途径免疫ΔqseCΔluxS弱毒苗(3.3×108CFU/只),组2对照注射等体积无菌PBS液,免疫后每隔7 d,尾静脉采血分离血清保存,连续采集12周,采用酶联免疫吸附试验(ELISA)检测小鼠血清抗体水平。
1.12 数据统计分析采用软件Graphpad Prism 9.0对相关试验数据进行分析处理。ns.P>0.05 为无显著性差异,*.P<0.05,**.P<0.01,***.P<0.001及****.P<0.000 1为显著性差异。
2 结果
2.1qseC及luxS双基因缺失株的构建qseC及luxS基因为多杀性巴氏杆菌群体感应系统相关基因。前期发现qseC基因缺失使菌株毒力显著降低,并赋予菌株很强的交叉保护性,而野生株却无相关表现[10]。为此思考同为群体感应的luxS基因缺失是否能够加强qseC基因缺失株的相关特性。因此,本研究在ΔqseC基础上,通过同源重组进行了luxS基因的缺失。在基因缺失设计方面,考虑到luxS基因上、下游其他基因的距离,设计了仅缺失luxS基因的前部分(图1A),缺失该部分片段后,使该基因不能翻译出原有蛋白,其相关功能失活。在进行luxS基因缺失前,对qseC基因缺失株进行了再次验证(图1B),确保了菌株的准确性。所构建的双基因缺失株也分别进行qseC基因和luxS基因的PCR验证,其缺失部分大小均正确(图1C),通过测序,也验证了所缺失部分准确无误,确定了构建菌株为qseC和luxS双基因缺失株。因基因缺失是采用的同源重组方法,在片段发生交换后,含有交换基因片段的载体要快速清除,不然会发生回复交换。本研究中所采用的缺失载体为温敏型载体,37℃传代培养消除了质粒,其后再进行体外连续传代和体内感染后分离细菌检测,确保了缺失株的遗传稳定(图1D,E)。
2.2 缺失株的生物学特征分析对野生型PmCQ2、ΔqseC及ΔqseCΔluxS的部分生物学特性进行了比较分析。3种菌分别涂布培养在马丁固体平板上,37℃培养24.0 h后,ΔqseCΔluxS的菌落形态略微小于ΔqseC,明显小于PmCQ2(图2A),接种于马丁肉汤培养基中,前7.5 h ΔqseCΔluxS与ΔqseC生长一致,慢于PmCQ2,其后,ΔqseCΔluxS生长稍微快于PmCQ2及ΔqseC(图2B)。ΔqseCΔluxS菌落虽小,但后期生长速度并未低于野生株PmCQ2及ΔqseC,其原因可能与荚膜含量的多少相关,测定其荚膜发现,ΔqseCΔluxS荚膜量显著低于ΔqseC,ΔqseC又显著低于PmCQ2(图2D),液体培养后4℃静置1周,ΔqseCΔluxS和ΔqseC更易于沉降(图2C),ΔqseCΔluxS和ΔqseC虽荚膜量降低了,但菌体也没有像有的细菌静置后很快沉降到管底,表明其存在的荚膜多糖的水合特性仍能使其细胞维持悬浮状。有研究表明,多杀性巴氏杆菌中荚膜多糖的生成与生物膜的生产成反比[19],测定ΔqseCΔluxS生物膜产生情况,发现显著高于PmCQ2及ΔqseC(图2E),其荚膜多糖的产生与生物膜也成反比。血清敏感性测定发现,与野生型相比PmCQ2、ΔqseCΔluxS对血清处理更为敏感性,细菌细胞存活数显著降低,与ΔqseC的血清敏感性无显著性差异(图2F)。进一步分析qseC和luxS双基因缺失对菌株毒力的影响,以Reed-Muench法计算ΔqseCΔluxS的LD50为5.50×107CFU(图2G),其毒力显著低于野生株PmCQ2(腹腔途径感染LD50=1.00 CFU)[20],毒力比qseC基因缺失株(LD50=5.28×107CFU)[10]有所降低。
2.3 交叉免疫保护性测定及比较分析前期研究发现,ΔqseC具有较强的交叉免疫保护作用[10],那么在此基础上继续进行luxS基因缺失后,菌株是否在其交叉免疫保护方面有所不同,为此,在此对ΔqseCΔluxS的交叉免疫保护性进行相关测定,考虑到与ΔqseC制备疫苗进行比较分析,ΔqseCΔluxS的疫苗制备及免疫剂量与途径也与前期研究的ΔqseC一致。以ΔqseCΔluxS制备的灭活疫苗和弱毒苗分别免疫小鼠,首免后21 d,取1组采集尾静脉血分离血清,采用不同攻毒株细胞蛋白为抗原进行包被,ELISA测定疫苗产生的针对各攻毒株的抗体水平,发现其灭活疫苗针对各攻毒株均有较高的抗体水平,免疫个体间差异小(图3A),而弱毒疫苗针对各攻毒株的抗体水平显著低于灭活疫苗,免疫个体间的抗体水平差异大(图3A,图4A),这也表明弱毒苗导致各个体小鼠感染程度的不同,疫苗免疫效果差异度大。攻毒保护性测定发现,ΔqseCΔluxS灭活疫苗对2株牛源A型多杀性巴氏杆菌(PmCQ1和PmCQ2)的保护率分别为67%和83%(图3B,C),对牛源B型多杀性巴氏杆菌(PmB)的保护率为83%(图3D),对兔源A型多杀性巴氏杆菌(PmR)的保护率仅为33%(图3F),对牛源F型、猪源A型及禽源A型多杀性巴氏杆菌(PmF、PmP和PmQ)没有保护作用(图3E,G~H)。而ΔqseCΔluxS的弱毒苗对PmCQ1、PmCQ2、PmB及PmR感染的保护率均为100%(图4B~D,F),对PmF的保护率为90%(图4E),对PmP和PmQ没有保护性(图4G,H)。即便ΔqseCΔluxS的弱毒苗疫苗的抗体水平低于灭活疫苗,但其交叉免疫保护效果仍显著优于灭活疫苗,而前期研究发现,以野毒株PmCQ2制备的灭活苗交叉免疫保护性很弱,qseC基因缺失株的交叉免疫保护效果较好[10]。

A.ΔqseCΔluxS灭活苗免疫后21 d 血清抗体水平;B~H.各菌株感染小鼠存活曲线 (PmCQ1、PmCQ2、PmB、PmF、PmR、PmP、PmQ)

A.ΔqseCΔluxS弱毒苗免疫后21 d 血清抗体水平;B~H.各菌株感染小鼠的存活曲线(PmCQ1、PmCQ2、PmB、PmF、PmR、PmP、PmQ)
本研究中ΔqseCΔluxS的交叉免疫保护性效果与以前研究中做的ΔqseC的交叉免疫保护性比较发现(表4),luxS基因的缺失并未整体增强原qseC缺失株的交叉免疫保护效果,但却增强了菌株对于牛源F型多杀性巴氏杆菌感染的交叉保护性。如仅从灭活疫苗的角度来看,luxS基因缺失是显著减弱了原qseC缺失株的交叉免疫保护效果。由此可以看出,在多杀性巴氏杆菌交叉免疫保护性方面,基因缺失的多少与保护性间无明显相关性,但可能与缺失基因本身所调控的交叉免疫保护性抗原产生量有关。

表4 ΔqseC和ΔqseCΔluxS相关疫苗的保护性 %
2.4 抗体消长规律为进一步了解ΔqseCΔluxS弱毒疫苗免疫后抗体产生的动态变化,免疫后每周采血分离血清测定其针对PmCQ2和PmB的抗体水平。首免14 d,就能检测到较高的针对PmCQ2抗体水平,并持续超9周(图5A)。抗PmB抗体在21 d时也达到较高的水平,56 d时达到最高,抗体高水平维持超过8周(图5B)。由于仅监测了11周,但从其动态趋势来看,其高抗体水平应可维持更长时间。
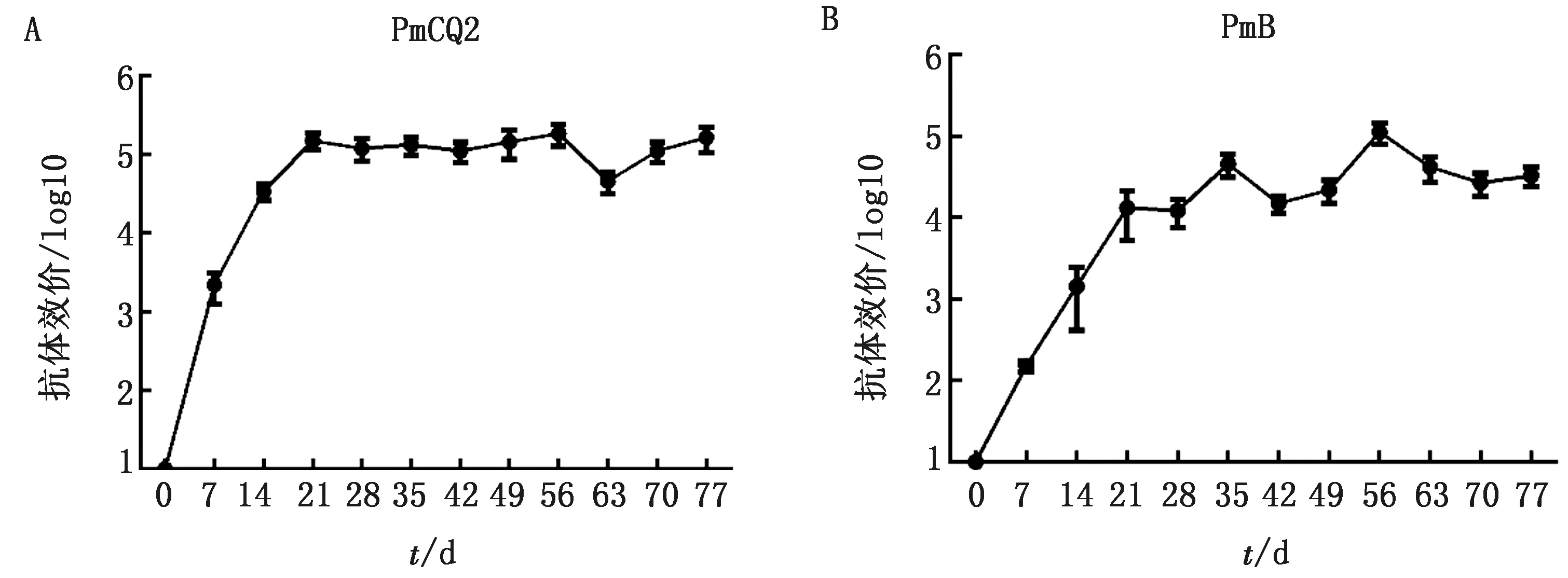
A.弱毒苗免疫后抗PmCQ2的抗体水平变化;B.弱毒苗免疫后抗PmB的抗体水平变化
3 讨论
多杀性巴氏杆菌是一种人畜共患性细菌病原,可感染人及多种动物,目前发现一些水生动物如海狮[21]也可感染多杀性巴氏杆菌,但其危害最大的仍是家畜家禽,给养殖业带了巨大的经济损失。多杀性巴氏杆菌对人的感染主要因宠物猫、犬抓咬,可导致局部和全身系统性感染[1],随着宠物饲养量增大,相关感染案例呈现上升趋势,现还未发现多杀性巴氏杆菌在人群中传播的案例,但多杀性巴氏杆菌感染还是存在潜在的公共安全风险。目前,多杀性巴氏杆菌疫苗种类偏少,仅有少数几种,又由于多杀性巴氏杆菌血清型多,还有部分血清型菌株间的基因水平转移交换更增加了菌株多样性,而各荚膜血清型间的交叉保护性弱,并存在部分动物源血清型的跨种间感染情况,导致了传统疫苗防控的效果并不好,防控仍依靠抗生素,但伴随而来的问题是其相关耐药性增加,这无形中又增大了该病原感染的防控难度。因此,疫苗防控仍应是多杀性巴氏杆菌疫病防控的最有利手段,基于当前多杀性巴氏杆菌疫苗现状,研发通用型疫苗是当前多杀性巴氏杆菌防控最紧迫的任务和关键。
前期研究发现,群体感应qseC基因缺失赋予了多杀性巴氏杆菌具有很强的交叉免疫保护作用[10],具有作为多杀性巴氏杆菌通用型疫苗候选菌株的潜力,但该缺失株的灭活疫苗还存在一定不足,其针对其他血清型多杀性巴氏杆菌感染的保护性未达到理想效果,同时作为灭活疫苗来看,其毒力稍微偏大了些,因此思考,如果继续缺失相关群体感应基因,是否能够使其毒力下降得更多,作为疫苗得保护性效果更好。因此,本研究中在qseC基因缺失株的基础上继续进行群体感应luxS基因的缺失,但从本研究的结果来看,qseC与luxS双基因的缺失,对菌株的交叉免疫保护性并没有叠加效应,反而导致缺失株对部分多杀性巴氏杆菌血清型菌株感染的保护性显著降低,从这个角度来看,缺失的基因数量多少可能与菌株的交叉免疫保护性效果没有线性正相关,但与缺失哪些基因有关,本研究也发现有些基因的缺失并未赋予菌株交叉免疫保护特性。
从适应性的角度来看,大多数临床分离病原株均具有一定的宿主偏好性,这是适应进化的结果,这也就导致了病原疫苗株的选择难度增大,同一病原疫苗菌株差异,其保护性效果差异很大。从理论的角度来看,基因突变可能会在一定程度上改变菌株原有的宿主偏好性,打破菌株宿主偏好性壁垒,其代表种群共性的相关基因表达更高,这样就导致菌株具有通用性疫苗的可能。多杀性巴氏杆菌野毒株PmCQ2交叉免疫保护性很弱,而其部分基因的缺失如qseC及hyaD基因的缺失,都赋予了菌株较强的交叉免疫保护作用[10,22],这也证明了以上观点。多杀性巴氏杆菌中,这种基因缺失而导致菌株的交叉免疫保护特性,其内在原因可能主要还是其相关交叉保护性抗原表达的上调,对实验室多株具有交叉免疫保护作用的多杀性巴氏杆菌基因缺失株灭活苗进行了细胞免疫差异进行了比较分析,其结果是这些缺失株与野生株疫苗的细胞免疫无显著性差异。同时,对这些菌株可能的交叉保护性抗原进行比较分析,并进行了大量克隆表达及保护性测定,但结果并未令人满意,多数蛋白抗原的保护性都不高(相关数据未发表),由此得出,这种基因缺失导致的交叉保护特性应是多抗原共同体现的结果。本研究也发现,即便是同一基因缺失,对不同多杀性巴氏杆菌菌株交叉保护特性的影响差异显著,这也与本研究要进行疫苗株选择的道理是一样,菌株本身就表现出不同差异。
本研究中,qseC及luxS双基因缺失株从整体上来看,其菌株毒力、荚膜产生及抗逆性显著下调,表明群体感应系统相关基因与其环境生存能力密切相关,不同群体感应系统都起到一定的作用,效果具有叠加效应。但从交叉免疫保护性方面来看,没有叠加效应。这可能与其荚膜产生量有一定关系,qseC单基因缺失和qseC及luxS双基因缺失均可导致菌株荚膜生成量的显著下调,但双基因缺失明显下调更多,荚膜是多杀性巴氏杆菌一个非常重要的毒力因子,作为疫苗菌株,荚膜缺失导致无相关针对荚膜的相关抗体产生,但同时,如果疫苗株中荚膜含量过多,可能也会影响到其他交叉保护性抗原的暴露,从而影响到交叉免疫保护性抗体的产生量,因此,从这个方面来看,作为多杀性巴氏杆菌,含适度荚膜可能更有利于菌株产生交叉免疫保护作用。PETRUZZI等[19]研究发现A型多杀性巴氏杆菌中生物膜的形成与其荚膜的产生呈负相关,本研究结果也与之一致,生物膜生成能力与荚膜含量通常与细菌致病性密切相关,ΔqseCΔluxS的荚膜生成量降低,生物膜表达量升高,但其致病性显著降低,表明在A型多杀性巴氏杆菌中荚膜对于毒力的贡献度更大一些,即便有生物膜表达量升高对致病力增强为补充,荚膜减低仍会导致菌株毒力的显著下调。生物膜表达量的增加,可能更易于A型多杀性巴氏杆菌在呼吸道黏膜上定殖及组织中的慢性感染,A型多杀性巴氏杆菌中荚膜与生物膜表达量的比率可能与其导致的疾病类型密切相关。关于这种荚膜产生降低,而生物膜生成量升高的情况,在多杀性巴氏杆菌的其他血清型菌株中,是否也同样存在还不得而知。
综上来看,多杀性巴氏杆菌群体感应系统调控菌株毒力,不同群体感应系统间相互协调补充,其相关基因的缺失可能会赋予菌株较强的交叉免疫保护性,可作为多杀性巴氏杆菌通用型疫苗研发的参考。
