2株GⅡb亚群猪流行性腹泻病毒分离、鉴定及变异分析
2023-12-08郭子仪孙亚威许夕雅丁晨梦邓梦梦韩紫薇吕晨哲齐江坤于林洋王新卫
郭子仪,孙亚威,许夕雅,丁晨梦,邓梦梦,韩紫薇,吕晨哲,齐江坤,于林洋,王新卫,陈 陆
(河南农业大学 动物医学院,河南 郑州 450046)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种高传染性猪肠道疾病,感染仔猪以发生呕吐、急性水样腹泻和严重脱水为特征[1],7日龄以下仔猪病死率可达100%[2]。PEDV于1971年首次出现在英国[3],随后在欧洲和亚洲的许多生猪养殖国家也报道了该疾病[4]。1973年,中国首次出现猪传染性胃肠炎(transmissible gastroenteritis,TGE)样急性腹泻暴发,但直到1984年才通过荧光抗体试验和血清中和试验确认该病的病原体为PEDV[5]。2010年底,由变异毒株引起的PED在我国南方再次暴发流行,给我国养猪业造成了巨大经济损失。2013年4月美国首次出现由PEDV变异毒株引起的PED病例,1年之内造成数百万仔猪死亡[6]。目前,PED依然是对世界养猪业影响最大的猪病之一。因此,分离当前PEDV流行变异株以及掌握其进化趋势,对于后续的新型疫苗研发意义重大。
PEDV是α-冠状病毒属(α-CoV)的成员,基因组全长约28 kb,由7个开放阅读框(ORF)组成。从5′→3′端依次编码复制酶多聚蛋白1ab(pplab)、纤突蛋白(S)、ORF3蛋白、小膜蛋白(E)、膜糖蛋白(M)和核衣壳蛋白(N)[7]。S蛋白是一种糖基化蛋白,含有能够诱导中和抗体的表位,具有高度的遗传多样性[8]。基于S基因的遗传多样性,PEDV分为GⅠ和GⅡ 2大基因型,每个基因群可进一步分为2个亚型,分别为GⅠa/b和GⅡa/b[9]。GⅠa/b亚型主要包括早期流行的CV777、DR13等低致病力毒株,GⅡa和GⅡb均属于高致病力变异毒株,而GⅡb亚型流行更广泛[10]。最近流调结果显示[11],我国PEDV流行毒株大多是GⅡ基因型,其中GⅡb亚群占比90%以上。目前我国流行的GⅡa和GⅡb亚型毒株对哺乳仔猪具有高致病性,并具有血清的交叉中和活性或交叉免疫保护[12-14]。经典PEDV毒株CV777的PEDV疫苗在我国被广泛使用,但免疫失败现象常见[15]。
因此,基于目前流行的PEDV变异毒株开发新疫苗迫在眉睫,为实现这一目标,本研究在先前分子流调基础上[16],成功分离出2株当前流行且高毒力的GⅡb变异毒株CH-HNKF-03和CH-HNPDS-01,并对其进行全基因组测序分析及致病性试验,以期为PEDV新型高效疫苗的研发提供候选毒株。
1 材料与方法
1.1 PEDV阳性样品与细胞株2020和2021年采集的经RT-PCR及测序鉴定为PEDV GⅡb阳性的腹泻仔猪肠道组织,用含有青霉素(100 mg/L)、链霉素(100 IU/mL)和磷酸胰蛋白酶(7.5 mg/L) 的改良DMEM培养基匀浆后,反复冻融3次,4℃离心取上清液,用0.22 μm滤器除菌,-80℃备用。非洲绿猴肾细胞系(Vero CCL-81)购自ATCC。
1.2 主要试剂M-MLV反转录酶、Recombinant RNase Inhibitor、2×Taq PCR Mix均购自宝日医生物技术(北京)有限公司(TaKaRa中国);病毒基因组DNA/RNA提取试剂盒购自天根生化科技(北京)有限公司;Oligo dT(18)、Random primer购自生工生物工程(上海)股份有限公司;胰酶购自Sigma(美国)公司;兔抗PEDV S蛋白血清由本实验室制备;Alexa Fluor®488-conjugated goat anti-rabbit IgG购自Abcam(英国)公司。
1.3 实验动物9头1日龄未吃母乳健康仔猪,购自河南省某猪场,采集直肠拭子,通过RT-PCR确认PEDV、TGEV、猪急性腹泻综合征病毒、猪δ冠状病毒和猪轮状病毒呈阴性。在适应期间,所有仔猪均活跃,粪便稠度正常,无临床症状。
1.4 引物设计与合成根据GenBank公布的PEDV变异株KR809885(CH/HNAY/2015),设计18对全基因组测序引物。引物由生工生物工程(上海)股份有限公司合成,引物详细信息见表1。
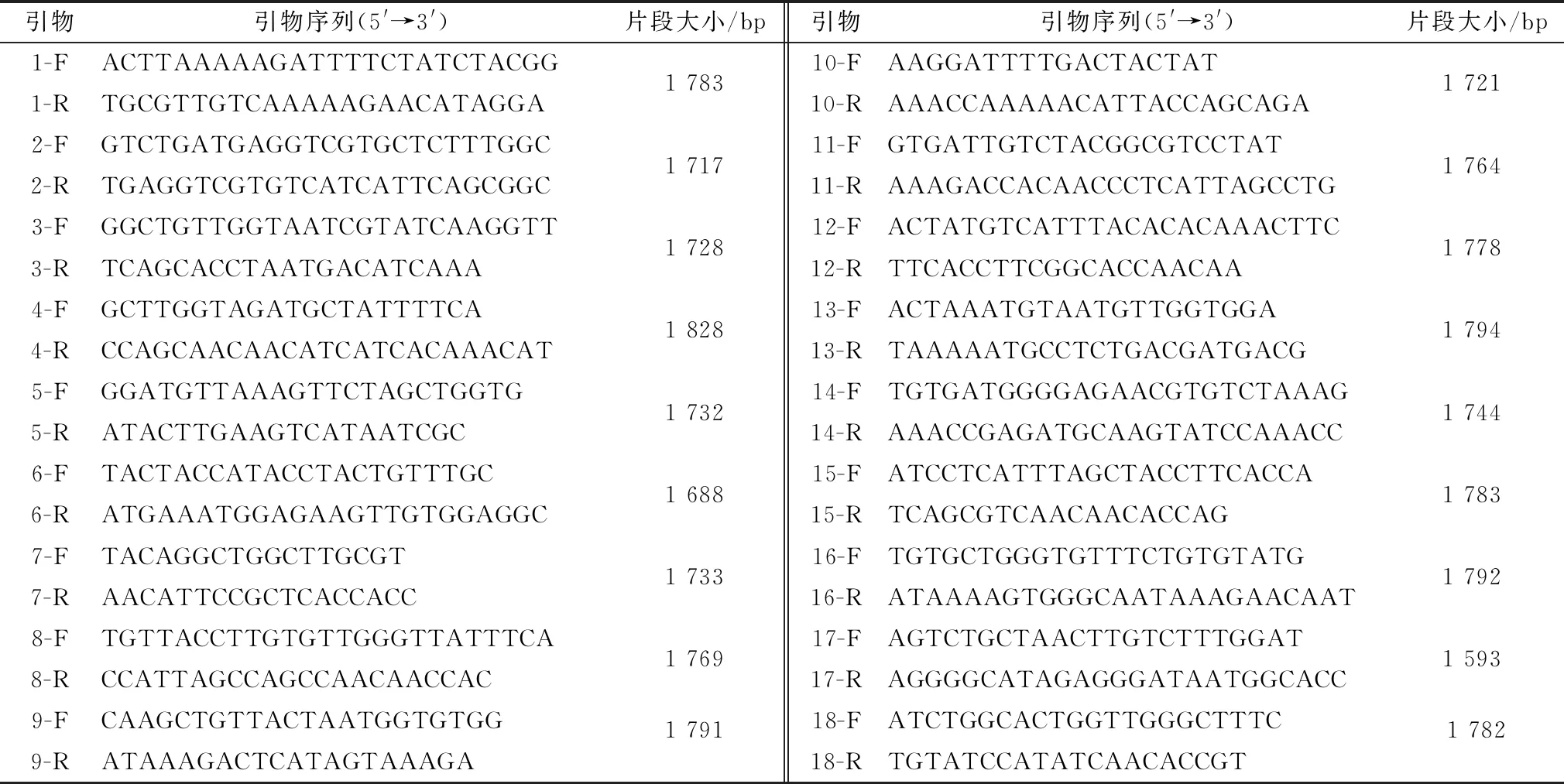
表1 PEDV全基因组测序引物信息
1.5 病毒分离处理的组织上清液接种生长良好的单层Vero细胞,吸附1 h,PBS(0.01 mol/L,pH=7.2)清洗3次,加入含胰酶(1 mg/L)的维持液,置37℃ CO2培养箱中培养,48 h后收取培养液盲传至出现细胞病变,收获病毒液并命名,置-80℃保存。
1.6 间接免疫荧光分析(IFA)PEDV感染Vero细胞(MOI=0.1)18 h后,4%多聚甲醛4℃固定30 min,0.25% Triton X-100室温下通透10 min,3% BSA洗涤3次后,用3% BSA封闭1 h,分别用兔抗S蛋白抗血清和Alexa Fluor®488-conjugated goat anti-rabbit IgG作为第一抗体和第二抗体,用DAPI对细胞核进行染色5 min,PBS洗涤细胞后,用荧光显微镜观察。
1.7 PEDV全基因组克隆和测序取病毒液用病毒基因组DNA/RNA提取试剂盒提取样品RNA进行反转录,反转录体系:5×M-MLV Buffer 4 μL、dNTP(2.5 mmol/L)4 μL、Oligo dT(18)(20 μmol/L)0.5 μL、Random primer(20 μmol/L)0.5 μL、M-MLV反转录酶(200 U/μL)0.5 μL、Recombinant RNase Inhibitor(40 U/μL)0.5 μL、RNA 200 ng,DEPC(焦碳酸二乙酯)水补足20 μL。反转录程序:42℃处理1 h,70℃处理15 min。反转录后获得的cDNA进行PCR检测,采用50 μL反应体系:25 μL 2×Phanta Max Buffer、dNTP Mix 0.5 μL、上、下游引物(25 μmol/L)各1 μL、Phanta Max Super-Fidelity DNA Polymerasec 1 μL,cDNA 4 μL,ddH2O补足。反应条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,30个循环;最后72℃延伸5 min,4℃ 10 min。反应结束后,取PCR扩增产物进行1%琼脂糖凝胶电泳检测。阳性产物进行胶回收并克隆于pMD18-T载体,挑取阳性质粒送生工生物工程(上海)股份有限公司测序。
1.8 全基因组同源性比对及系统发育分析运用DNAStar和MEGA-X软件对本研究毒株全基因组及S、ORF3、E、M、N基因与GenBank数据库已公布的国内外44个代表性参考毒株进行同源性比对及系统发育分析,采用邻接法(neighbor-joining method)构建系统发育树,通过1 000次重复计算引导值。
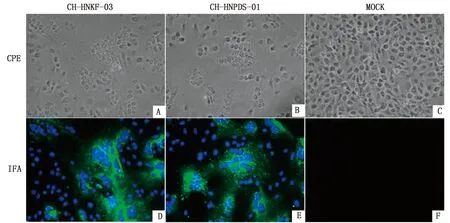
A.CH-HNKF-03感染Vero细胞后CPE结果;B.CH-HNPDS-01感染Vero细胞后CPE结果;C.阴性细胞对照;D.CH-HNKF-03感染Vero细胞后IFA结果;E.CH-HNPDS-01感染Vero细胞后IFA结果;F.IFA阴性对照

A.全基因组系统发育树;b~f.S、ORF3、E、M、N基因系统发育树;●.本试验分离毒株
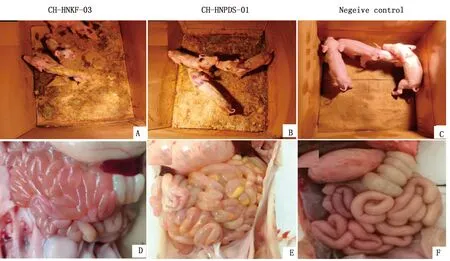
A.CH-HNKF-03攻毒组;B.CH-HNPDS-01攻毒组;C.阴性对照组;D.CH-HNKF-03攻毒组肠道剖检;E.CH-HNPDS-01攻毒组肠道剖检;F.阴性对照组肠道剖检

A.各组仔猪粪便评分曲线;B.各组仔猪存活率
1.9 致病性试验9头1日龄未吃初乳健康仔猪,随机均分为3组:CH-HNKF-03攻毒组、CH-HNPDS-01攻毒组和阴性对照组。CH-HNK-F-03攻毒组和CH-HNPDS-01攻毒组仔猪每头分别灌服PEDV CH-HNKF-03、CH-HNPDS-01株病毒液100 TCID50,阴性对照组灌服同体积DMEM。攻毒后4 d内,每天目测仔猪腹泻情况,按照以下评分标准进行打分:0分,正常;1分,膏状大便;2分,半液体腹泻;3分,液体腹泻。记录每组仔猪平均得分,评估腹泻严重程度。
1.10 结果分析将各基因片段重叠部分利用CExpress软件拼接,得到用CH-HNKF-03、CH-HNPDS-01的全基因组序列,利用DNAStar软件包中的MegAlign进行同源性比较,用MEGA-X进行系统发育分析。
2 结果
2.1 病毒分离及IFA鉴定CH-HNKF-03和CH-HNPDS-01毒株分别在第3和5代出现典型细胞病变(CPE)。用PEDV S蛋白多克隆抗体进行IFA检测,结果显示,在感染的Vero细胞中有绿色荧光信号,空白细胞对照中没有(图1)。
2.2 PEDV全基因组扩增、测序及拼接对CH-HNKF-03和CH-HNPDS-01基因片段进行扩增和测序,通过CExpress软件拼接,得到2条完整PEDV序列,长度分别为27 970,28 032 bp(表2)。其序列已上传至GenBank数据库,登录号为分别为OL446966、OL446967。
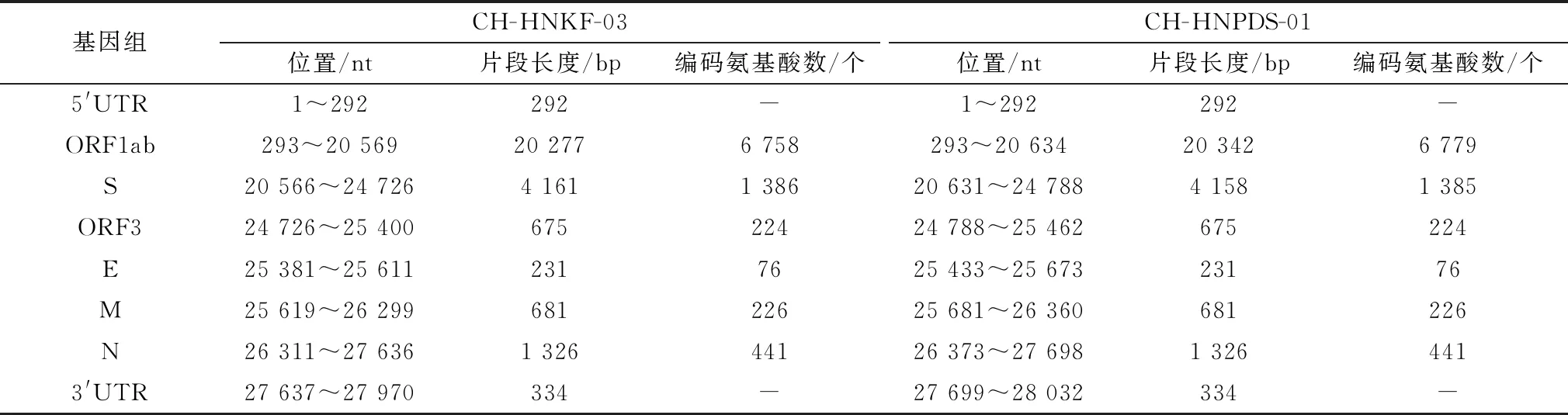
表2 PEDV CH-HNKF-03、CH-HNPDS-01株基因组结构
2.3 全基因组同源性比对及系统发育分析全基因组同源性比对显示CH-HNKF-03和CH-HNPDS-01株与国内流行株CH/HNAY/2015同源性最高,分别为98.3%和98.7%,系统发育分析显示这2个毒株均属于国内流行的GⅡb群(图2a);S基因核苷酸序列分析显示CH-HNKF-03分离毒株S基因全长与中国近年流行毒株CH/HNAY/2015、PEDV-WS等一致,大小均为4 161 bp,CH-HNPDS-01分离株S基因全长4 158 bp,与AJ1102、GD-A等一致。CH-HNKF-03和CH-HNPDS-01株与PEDV-WS株同源性最高分别为98.6%和98.4%,系统发育分析显示这2个毒株均属于国内流行的GⅡb群,与全基因组系统发育分析一致(图2b);2株分离株ORF3基因全长均为675 bp,其中CH-HNKF-03株与SD2014株同源性最高为95.6%,CH-HNPDS-01株与CHGD-01株同源性最高为98.7%,系统发育分析显示CH-HNKF-03毒株形成单独分支(图2c);CH-HNPDS-01和CH-HNKF-03株E基因与参考毒株核苷酸同源性分别为93.9%~99.0%和94.2%~95.1%,系统发育分析显示CH-HNPDS-01与早期经典毒株CV777、DR13等处于同一个分支,CH-HNKF-03与SD2014处于同一个分支(图2d);M基因同源性比对显示CH-HNPDS-01和CH-HNKF-03毒株与参考毒株核苷酸同源性分别为95.5%~98.8%和96.4%~99.4%,系统发育分析显示,CH-HNPDS-01与GD-A、AJ1102等毒株处于同一分支,CH-HNKF-03与CH/BJ9/2015处于同一分支(图2e);N基因同源性比对显示,CH-HNPDS-01和CH-HNKF-03毒株与参考毒株核苷酸同源性分别为95.6%~97.7%和94.9%~99%,系统发育分析显示CH-HNPDS-01形成一个单独分支,CH-HNKF-03与CH/HNAY/2015、PE-DV-WS等处于同一分支(图2f)。
2.4 致病性试验试验组仔猪攻毒后出现呕吐、粪便呈液体伴腥臭味、采食量锐减、精神萎靡、站立不稳、被毛粗乱、消瘦等症状。2组试验组仔猪在攻毒4 d后均全部死亡,阴性对照组仔猪正常。对仔猪进行剖检,发现试验组仔猪小肠肠壁变薄充血、胀气,内有黄色水样粪便和未消化凝乳块。致病性试验表明CH-HNKF-03 和 CH-HNPDS-01 毒株均具有高致病性。
3 讨论
由于PEDV基因组的点突变、插入突变和缺失突变频繁发生,这导致了我国PEDV流行株的遗传具有多样性[17-18]。同时PEDV不同流行株之间的毒力及免疫力也有所不同,使得目前使用的商业化PEDV疫苗无法对各种流行变异株提供完全保护[8,19]。自2010年我国首次报道GⅡb亚型毒株引起的PED暴发以来,该亚型在所有PEDV分离株占比逐年增加,近几年达到了90%以上[10-11,20]。同时,PEDV GⅡb毒株研发的疫苗相比传统市售疫苗能够提供更好的同源保护[21-22]。因此,目前PEDV GⅡb亚型流行毒株研发新型疫苗对防控猪流行性腹泻意义重大。毒株分离是疫苗研发的重要环节,但是PEDV体外分离培养非常困难,这一定程度上掣肘了新型疫苗的研发速度。PEDV体外分离培养困难的原因主要有2点:(1) 实验室培养的细胞环境无法完全模拟猪肠道环境。(2)猪肠道组织内含毒素及毒株培养需要一定的胰酶作用,这都会导致细胞状态很差甚至死亡,从而影响PEDV的分离培养。本研究从疑似暴发PED的河南规模化养殖场收集病料,将鉴定PEDV为唯一病原体的病料进行PEDV分离,根据HOFMANN等[23]以及KUSANAGI等[24]的方法,应用Vero细胞上成功地分离到PEDV CH-HNKF-03和CH-HNPDS-01毒株,其分别在第3代和第5代出现典型细胞病变,这与PAN等[25]在同一细胞中第7代观察到CPE,和HOFMANN等[23]第1代就观察到了CPE有一定差异,可能是因为Vero细胞对不同PEDV分离株的敏感性不同。
为了解分离株的基因特征,对CH-HNKF-03和CH-HNPDS-01株进行全基因组测序,并从全基因组水平和部分基因水平分析PEDV毒株之间的系统发育关系。结果显示,本研究中分离株全基因组及S基因系统发育分析显示均属于GⅡb亚型,差异最大的基因是S和ORF3基因,E、M、N基因同源性较高,相对比较保守,与LIU等[26]、DIEP等[27]研究结果一致。PEDV N基因高度保守,可在感染细胞中大量表达N蛋白,并且在感染初期即可产生高水平抗N蛋白抗体,N蛋白的这种特性使其成为诊断PEDV的理想靶抗原[28]。本研究CH-HNPDS-01毒株N基因形成一个单独分支,其影响还有待进一步研究。致病性试验结果显示1日龄仔猪感染CH-HNKF-03和CH-HNPDS-01毒株后,18 h即可发病,在24~56 h仔猪均出现典型的液体腹泻、呕吐、消瘦、脱水等症状,并在96 h内全部死亡,说明CH-HNKF-03和CH-HNPDS-01株对仔猪具有高致病性。
综上,本研究分离出2株可在Vero细胞上有效增殖并能稳定传代的PEDV GⅡb亚群变异毒株(CH-HNKF-03和CH-HNPDS-01),其与我国近年流行毒株遗传关系最近,同时对哺乳仔猪具有高致病性,这为PEDV的遗传演化提供了参考以及后续PEDV新型高效疫苗的研发提供了候选毒株。
