藏药七十味珍珠丸治疗阿尔茨海默病研究进展
2023-10-07赵健黎张梦如郑博文闫清伟刘铜华孙芳云
赵健黎 张梦如 郑博文 闫清伟 刘铜华 孙芳云*
1.西藏民族大学藏药检测技术教育部工程研究中心,陕西 咸阳 712082;2.西藏民族大学体育学院,陕西 咸阳 712082;3.西藏藏医药大学,西藏 拉萨 850007
阿尔茨海默病(alzheimer disease,AD)是老年痴呆的主要亚型,约占全部痴呆类型的60%[1],是老年人群中一种常见的神经退行性疾病,主要表现为认知功能障碍和记忆力下降,其发病率随年龄增长而增加。我国作为人口大国,老龄化日益加重,而AD作为一种最为常见的老年疾病,其不可治愈的现状已经成为社会关注的热点。截止2015年,我国AD患者已达1200万,且人数呈不断增高态势,预计2050年将达到3000万[2]。因此,寻找安全有效的AD治疗方法具有非常重要的意义。
藏医药理论经历代藏医药学家的不断实践与研究,已形成相对完善的医疗理论体系。作为高原地区的特色民族医学,藏医药理论经过几千年的发展与传承,在疾病治疗中发挥着独特作用,尤其在某些疑难杂症中更是起到了显著效果。七十味珍珠丸(Ratanasampil,RNSP)作为藏民族传统医学的瑰宝,最早源于《四部医典》中的二十五味珍珠丸,后经藏医药学家不断的改进与完善研制而成,主要用于癫痫、脑出血、脑梗死、中风等疾病的治疗[3-4]。近年来研究发现,RNSP在治疗AD等神经退行性疾病中具有较好疗效。但目前对于RNSP临床研究尚未完善,且RNSP改善AD具体药理作用机制尚未明晰,制约了RNSP的临床使用与推广。基于此,本文将梳理RNSP在治疗AD方面的作用,找到RNSP改善AD病理的可能机制,为RNSP防治AD研究提供理论依据与参考。
1 AD病因研究
1.1 现代研究观点 β淀粉样蛋白(β-amyloid,Aβ)沉积以及Tau蛋白过度磷酸化(p-Tau)是造成AD发病的重要因素。Aβ是由淀粉样前体蛋白(amyloid precursor protein,APP)经β-分泌酶(β-site APP cleaving enzyme,BACE-1)和γ-分泌酶水解后产生[5],其可与细胞表面受体及细胞中重要细胞器共定位,诱发胞内导致氧化应激、内质网应激以及线粒体功能障碍等现象,进而导致神经细胞的凋亡[6-7]。Tau蛋白是一种微管神经元蛋白,正常情况下可参与微管的装配与稳定。当机体发生病变时,p-Tau会形成神经纤维缠结,降低其与微管的亲和力,进而影响细胞功能(突触传递、轴突运输、信号转导)[8]。此外,研究[6,9]发现AD患者脑内还存在能量代谢障碍以及自噬异常等现象。上述病理表现均严重损害AD患者认知与记忆能力,加重患者病情。而如何对上述病理表现进行针对性治疗可能是治疗AD的关键。
1.2 传统藏医研究观点 阿尔茨海默病的藏文名为“昏露”,是一种以记忆力衰退(即杰泄症,又称健忘症)为主要表现的的神经性疾病[10]。藏医学认为,疾病的发生是由外源及内因导致的,其中外源是指疾病发生条件和原因,包括情绪变化、生活习惯、季节环境、年龄性别、饮食因素、生物因素、外部损伤等;内因则包含隆、赤巴和培根三种要素,这既是人体进行生理活动的能量与物质基础,也是疾病发生机制以及治疗原理的重要理论依据[11]。藏医认为,机体随着年龄的增长会使隆功能失调,从而影响赤巴与培根,导致人体精力不足,而当机体长时间处于心力衰弱以及焦虑抑郁等隆失调状态时会导致健忘症的产生与加重[12]。隆紊乱包括“紧久隆、恰不欺隆、索增隆、吐塞隆以及麦娘姆隆等”。其中“紧久隆”主要表现为记忆力减退、口吃喑哑、体力减弱、口眼歪斜等,与AD核心症状记忆力衰退相似;而“恰不欺隆”主要表现为晕厥,妄言谵语,常欲行走,产生恐惧等,部分表现与AD患者认知功能障碍较为相似[13]。此外,“恰不欺隆”主要运行于心脏,心脏作为隆运转的中心,主管人的意识活动,具有增强记忆的能力[14]。《月王药诊》中记载:心脏病分为疯癫症和癔病两类,其病因包括隆、赤巴、培根三者,而隆型癔病症状主要包括心悸、健忘以及胸部刺痛[15]。因此传统藏医认为,AD的发病原因与心脏功能的损伤具有重要联系。且现代医学研究[16-17]表明,心脏的损伤与AD的发生发展联系密切,这与传统藏医观点相一致。因此从藏医角度来看,治疗AD方法主要以调节“紧久隆”与“恰不欺隆”为主。
2 RNSP主要成分与作用
根据相关文献以及《中国药典》(2020版)记载,RNSP主要组成包括植物类、动物类、矿物宝石类、金属类以及混合物等相关药材,其中植物类主要包含檀香、降香、西红花、柯子、肉桂、甘草;动物类包括牛黄、麝香;矿物宝石类包括珍珠、九眼石、玛瑙、珊瑚;金属类主要包括Au、Cu、Fe、Pb、Hg、Zn、Mn、Ba、Al、Ca、K、Mg、Na等金属元素[18-21];混合物主要是佐太,其主要原料为汞,是一种经过多种复杂炮制工艺煅碳存性而成的混合物类药材,能够起到提升治疗效果的作用[22]。在化学成分方面,当前研究[23-24]表明,RNSP中成分主要包括没食子酸、柯里拉京、沉香四醇、鞣花酸、西红花苷Ⅰ、西红花苷Ⅱ、亚油酸、丁香酚、亚麻酸和肉豆蔻酸等。
RNSP成方至今已有500余年的应用历史,具有安神、镇静、通经活络、调和气血以及醒脑开窍的功效,因此在藏医中经常用于治疗“黑白脉病”和“龙血”不调等疾病[25]。而在近年来临床研究[26-30]中表明,RNSP对于心脏病、高血压、脑震荡、脑卒中、瘫痪、癫痫、半身不遂、小儿惊厥、偏头痛、老年痴呆等疾病具有较好疗效。
3 RNSP在AD领域的临床研究
RNSP作为传统藏药大组方药品的典型代表,常被用于治疗各种心脑血管疾病以及神经功能障碍等疾病[20]。在临床研究方面,刘志琴等[31]发现51例AD患者在12周RNSP治疗后,其简易精神评定量表总分以及定向力、计算能力、记忆力、回忆和语言5个子项显著提高,阿尔茨海默病评价量表-认知量表评分显著降低,日常生活活动能力量表总分以及工具使用、生活自理能力2个子项均显著改善。廖宝霞等[32]研究发现,12周RNSP治疗可显著改善AD患者认知与记忆能力,其机制与RNSP提高AD患者血液中超氧化物歧化酶(superoxide dismutase,SOD)活性,从而减轻体内氧自由基对于神经细胞的损伤有关。朱爱琴等[33]研究发现,RNSP改善AD患者认知功能,可能与RNSP下调患者体内炎性细胞因子白介素1β、白介素6及肿瘤坏死因子-α水平,降低Aβ42/Aβ40比值,减少Aβ沉积有关。上述临床研究初步表明,RNSP治疗可改善AD患者认知与记忆功能,且机制可能与RNSP抑制氧化应激水平和炎症因子有关。目前对于RNSP改善AD的临床研究相对较少,且研究方法相对单一,在后续研究中,可根据已知的AD发病机制,针对性的增加检查手段。例如,通过影像学方法检查AD患者海马体积变化、脑部血流量变化以及能量代谢水平等,通过检测脑脊液以及血液等判断Aβ、p-Tau以及其他AD病理特征的变化等。此外,由于RNSP成分中含有一部分金属离子,因此在临床试验中,还需对其安全性进行系统的评价。
4 RNSP改善AD药理机制研究
4.1 RNSP减少AD脑内Aβ沉积 由于Aβ沉积所致的老年性斑块 (senile plaques,SPs)被认为是AD早期发病的典型标志,因此许多药物将清除Aβ作为治疗AD的靶点。有研究[34]对16月龄Tg2576转基因AD小鼠血清及行为学能力进行检测,结果发现,小鼠血清中BACE-1与Aβ蛋白表达明显升高,学习记忆能力明显下降,而通过8周RNSP干预可有效降低血清中BACE-1与Aβ蛋白表达,改善其学习记忆能力。α-羧基末端片段(α-Cterminal fragment,α-CTF)和β-CTF分别是APP两条不同途径的水解产物,其中α-CTF属于非Aβ途径产物,β-CTF属于Aβ途径产物[35-36]。研究[37]发现,与AD模型组相比,8周RNSP给药组小鼠脑组织中α-CTF蛋白表达以及α-CTF/β-CTF比值显著升高,Aβ含量显著降低,且学习和记忆能力得到显著改善;AD模型小鼠接受12周RNSP治疗后,其海马区域BACE-1表达显著下降,致使Aβ生成减少,从而降低Aβ对于脑部的损害,改善其学习记忆与空间探索能力。综上所述,RNSP改善AD机制可能为RNSP抑制Aβ产生的关键酶BACE-1表达,促进APP非淀粉样酶切的代谢过程,进而抑制Aβ沉积,减少Aβ对于脑内神经细胞的损伤。但也有研究[38]发现,Aβ可能并不是AD病理的始发原因,并提出神经细胞的死亡早于Aβ沉积的形成。因此,关于RNSP减少AD脑内Aβ沉积进而改善AD的药理学机制还待进一步研究。
4.2 RNSP改善AD脑内氧化应激 广泛的氧化应激是AD脑内的特征之一,脑内氧化应激水平的异常升高可导致DNA损伤并促进Aβ的生成[39],因此如何降低氧化应激水平可能是改善AD的关键。RNSP成分较多,其中藏红花已被证明具有良好的抗氧化应激效果[40-41]。此外,以往研究中,RNSP在相关脑损伤模型大鼠中表现出显著的的抑制氧化应激作用[42-43],因此推测RNSP可能通过抑制氧化应激改善AD。动物研究[44]发现,颈背部皮下注射D-半乳糖及侧脑室注射Aβ25-35的AD模型大鼠经过8周的RNSP治疗后,血清中SOD含量显著升高,丙二醛(Malondialdehyde,MDA)含量显著下降,且学习记忆能力得到显著改善。小鼠腹腔注射东莨菪碱可导致氧化应激水平增高进而影响其学习记忆能力,RNSP灌胃给药2周可显著促进小鼠脑内抗氧化酶谷胱甘肽过氧化物酶的表达,并抑制MDA的表达,从而降低氧化应激水平,改善其学习记忆能力[45]。上述研究初步表明RNSP可抑制AD脑内氧化应激水平进而改善AD。研究[46]表明,氧化应激可激活p38丝裂原活化蛋白激酶-细胞外信号调节激酶1/2通路诱导细胞凋亡。而在细胞实验中发现,RNSP可抑制p38丝裂原活化蛋白激酶-细胞外信号调节激酶1/2通路,从而降低氧化应激介导的细胞凋亡[47]。综上研究所述,RNSP可有效降低AD脑内氧化应激水平,并抑制氧化应激所介导的神经细胞凋亡,从而减少神经细胞的损伤,改善AD。
4.3 RNSP改善AD脑内能量代谢 有研究[48-50]显示,AD脑内表现出葡萄糖利用率降低、线粒体融合分裂失衡以及三磷酸腺苷(Adenosine triphosphate,ATP)生成效率降低等现象,表明能量代谢障碍是AD发病的又一重要诱因。有研究[51]发现,APP/PS1小鼠接受12周RNSP治疗后学习记忆能力得到显著改善,其原因可能与RNSP抑制小鼠海马区域线粒体融合分裂失衡,减轻线粒体结构损伤,进而改善小鼠能量代谢水平有关,表明RNSP可通过减轻AD脑内的线粒体结构损伤,增强其能量代谢水平。在AD脑内,葡萄糖代谢水平下降可引起酮体代谢水平代偿性增强,进而导致脑白质损伤,而脑白质损伤被认为与学习记忆能力的下降密切相关[51-53]。有研究[54]发现,AD模型小鼠脑内海马区域酮体代谢能力增强,进而导致海马白质和海马髓鞘完整性受损,影响其学习记忆能力,而经过3个月的RNSP干预可显著抑制小鼠海马区域的酮体转运与代谢,进而减轻小鼠海马白质损伤,改善其学习记忆能力。综上,RNSP可显著改善AD脑内能量代谢障碍,进而减少AD脑部损伤,改善其学习记忆能力,但目前关于RNSP在AD能量代谢方面研究较少,且缺少相关临床实验,还需要后续的深入研究。
5 小结与展望
AD作为一种常见于老年人群的神经退行性疾病,近年来大量学者对其发病机制以及干预手段进行了广泛的研究,但目前对于其具体发病机制仍未明晰。近年来随着我国对于传统医药的重视,藏医和藏药在治疗AD等神经退行性疾病方面逐渐受到研究人员关注。笔者梳理文献发现,RNSP在临床上对于治疗AD患者具有显著疗效。此外,相关动物及细胞研究表明,RNSP改善AD机制主要表现在减少Aβ沉积、抑制氧化应激水平以及改善能量代谢等方面,如图1所示。但目前对于RNSP在AD领域研究还存在较多不足:首先在临床研究方面,大多研究较为单一,且缺少相应安全性评价,不能很好反映与推广RNSP在临床领域的应用价值;而在动物以及细胞研究方面,目前关于RNSP改善AD的具体作用机制研究较少且探究不够深入,如RNSP改善AD的上述三种机制是否存在协同效应?RNSP减少Aβ的具体机制是什么?RNSP在改善AD脑内氧化应激及能量代谢中线粒体又发挥了什么作用,介导机制如何?还有待在今后研究中进一步探讨,以期为后续RNSP治疗AD提供新的参考与借鉴。
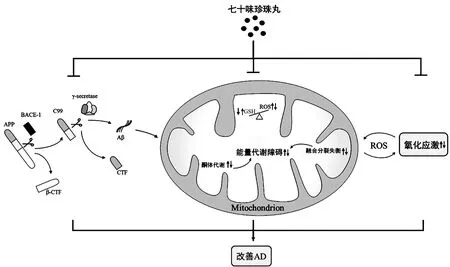
图1 RNSP改善AD机制示意图
