酶解技术对白桦树桑黄有效成分提取工艺研究
2023-09-27薛迪张璐张斌
薛 迪 张 璐 张 斌
1青岛市黄岛区中心医院药剂科 山东 青岛 266555;2 南方医科大学中医药学院 广东 广州 510515;3 青岛大学附属医院药学部 山东 青岛 266000
“桑黄”又名桑耳,早期在桑树上发现貌似耳朵而得名。从秦汉时期至今桑黄的使用己有2 000多年历史,在《本草纲目》、《神农本草经》、《本草经集注》等中医著作中均以桑黄、桑臣、桑耳、桑菌等名称收载[1],后经考证早在隋唐时期甄权的《药性论》中就有出现过“桑黄”一词[2],后考证为“桑黄”即“桑耳”,最终确定了桑黄的名称及药性。《中国药用真菌》将桑黄命名为Phellinus igniarius(Berk.&M.A.Curtis)Teng,中文名称是“火木层孔菌”[3]。
目前桑黄菌主要寄生于杨、柳、桦、栎、桑、榉树等阔叶上,依其寄生树种不同,形状、颜色、所含药用成分不同,主要分以下几个种类:桑树桑黄、松树桑黄、黑桦树桑黄、白桦树桑黄、暴马丁香桑黄、漆树桑黄等[4]。其主要成份有桑黄多糖,三萜,黄酮和锌、铁、钙、镁等多种微量元素,多糖是桑黄发挥药理作用的最主要成分之一,其子实体及菌丝体多糖均具有显著的抗肿瘤、抗氧化作用[5]。如桑黄菌丝体多糖可抑制肿瘤[6-7]及抗环磷酰胺致突变作用[7],桑黄多糖具有的抗肿瘤、抗突变、抗氧化、免疫调节等活性,使其应用价值越来越广泛。黄酮也是十分重要的一类活性成分,具有抗肿瘤、抗氧化、抗炎、抗病毒、降血脂等作用[8-9],因此其在医药行业的研究前景很广阔[10]。
本研究采用白桦树桑黄(Phellinus igniarius Growing on Birch Tree)进行酶解工艺研究,通过各类酶的特殊活性分解白桦树桑黄中纤维素、半纤维素、蛋白质、多糖类成分,使细胞破裂,减小细胞壁、细胞间物质传递屏障,从而达到提取细胞内有效成分的目的[11-12]。目前关于白桦树桑黄提取工艺研究报道较少,本研究通过正交设计实验优选出桑黄酶解工艺同时提高总多糖、总黄酮含量,为扩大生产加工桑黄药材提供参考依据。
1 实验仪器与试剂
白桦树(宿主)桑黄,购于云南仁和药材商行。实验所用水为蒸馏水,芦丁标准品(宝鸡市辰光生物科技有限公司,批号为153-18-4),无水葡萄糖(中国食品药品检定研究院,批号为140619-201421),实验中使用的试剂均为分析纯。
多功能粉碎机(永康市小宝电器有限公司),KH-100DE型数控超声波清洗器(昆山禾创超声仪器有限公司)、SHZ-D(Ⅲ)循环水式真空泵(巩义市华仪器有限责任公司)、恒温恒湿箱(上海一恒科学仪器有限公司)、烘箱(上海沪越实验有限公司)、岛津UV-2600(岛津公司)、8454紫外分光光度计(Agilent公司)、电子天平T-500型(上海佑科)。
2 方法与结果
2.1 桑黄总多糖的含量测定
2.1.1 葡萄糖对照溶液的制备 取无水葡萄糖适量,精密称定,加水制成每1 mL含有0.211 8 mg的溶液,作为对照品溶液。
2.1.2 最大吸收波长的选择 葡萄糖对照品经苯酚-浓硫酸法显色后,用紫外-可见分光光度仪于400~600 nm处进行扫描,确定葡萄糖测定波长为485 nm。
2.1.3 标准曲线的绘制[13]精密量取2.1.1项下标准溶液0、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,置10 mL容量瓶中,加水至1 mL后再加入6%苯酚溶液1.0 mL,混匀后加浓硫酸7.0 mL,迅速摇匀,置于沸水中加热15 min,取出迅速用冰水冷却,加浓硫酸定容,摇匀,于485 nm波长处测定吸收度,以“0”作为空白,以浓度(mg/mL)对吸光度作直线回归,得回归方程:y=67.154x-0.010 1,r=0.999 2。结果表明葡萄糖含量在0.084 7~0.211 8 mg范围内与吸光度呈良好的线性关系。见图1。

图1 葡萄糖标准曲线
2.2 桑黄总黄酮的含量测定[14]
2.2.1 芦丁对照溶液的制备 取芦丁适量,精密称定,加75%乙醇制成每1 mL含有0.146 4 mg的溶液,作为对照品溶液。
2.2.2 最大吸收波长的选择 将芦丁对照品溶液经亚硝酸钠、硝酸铝、氢氧化钠显色后,用紫外-可见分光光度仪于400~600 nm处进行扫描,确定芦丁测定波长为507 nm。
2.2.3 标准曲线的绘制 精密吸取2.2.1项下芦丁对照品0、1、2、3、4、5、6 mL于10 mL容量瓶中,加入5%亚硝酸钠溶液0.3 mL,摇匀,放置6 min,再加入10%硝酸铝溶液0.3 mL,摇匀,放置6 min,最后加4.0 mL 1 mol/L 氢氧化钠溶液,用75%乙醇稀释至刻度,摇匀,放置15 min,于507 nm波长处测定吸收度,以“0”作为空白,以浓度(mg/mL)对吸光度作直线回归,得回归方程:y=12.251x-0.044 6,r=0.999 3。结果表明芦丁含量在0.146 4~0.585 6 mg范围内与吸光度呈良好的线性关系。见图2。
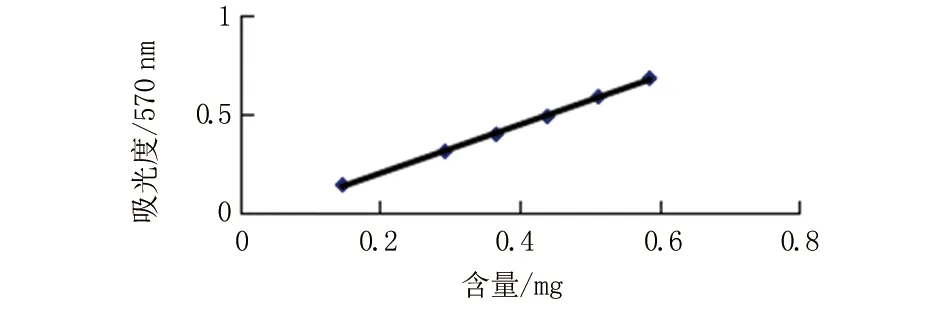
图2 芦丁标准曲线
2.3 方法学考察
2.3.1 重复性试验 分别取在湿度为55%,温度为27℃,加淀粉酶量为2.5%,发酵3 d条件下的桦树桑黄酶解液6份,按总多糖和总黄酮项下方法测定,计算各份样品的多糖、总黄酮含量,RSD%(n=6)分别为1.027 8%、1.347 1%。这表明该方法重复性符合含量分析要求。
2.3.2 精密度试验 分别取葡萄糖标准品、总芦丁标准品,按总多糖和总黄酮项下方法制备,连续进样检测6次。计算各份样品的多糖、总黄酮含量,RSD%(n=6)分别为0.526 6%,0.525 6%。这表明该方法精密度符合含量分析要求。
2.3.3 中间精密度试验 分别取2.3.1项下白桦树桑黄酶解液12份,由两名操作员分别在不同时间,不同仪器(岛津分光光度仪UV-2600、安捷伦分光光度仪UV8454)上按总多糖和总黄酮项下方法测定,计算各份样品的多糖、总黄酮含量,RSD%(n=6)分别为1.875 5%,1.911 9%,表明该方法精密度符合含量分析要求。
2.3.4 稳定性试验 分别取葡萄糖标准品、总芦丁标准品,按总多糖和总黄酮项下方法制备,于显色后0、30、60、90、120、150 min测定,计算各份样品的多糖、总黄酮含量,RSD%分别为1.969 5%,1.721 6%,表明样品在显色后150 min内基本稳定。
2.3.5 加样回收率 取供试品4号0.3 mL,共6份,分别加入2 mL芦丁对照品溶液(0.146 4 mg/mL),按标准曲线制备方法处理后,于507 nm处测吸光度。见表1。
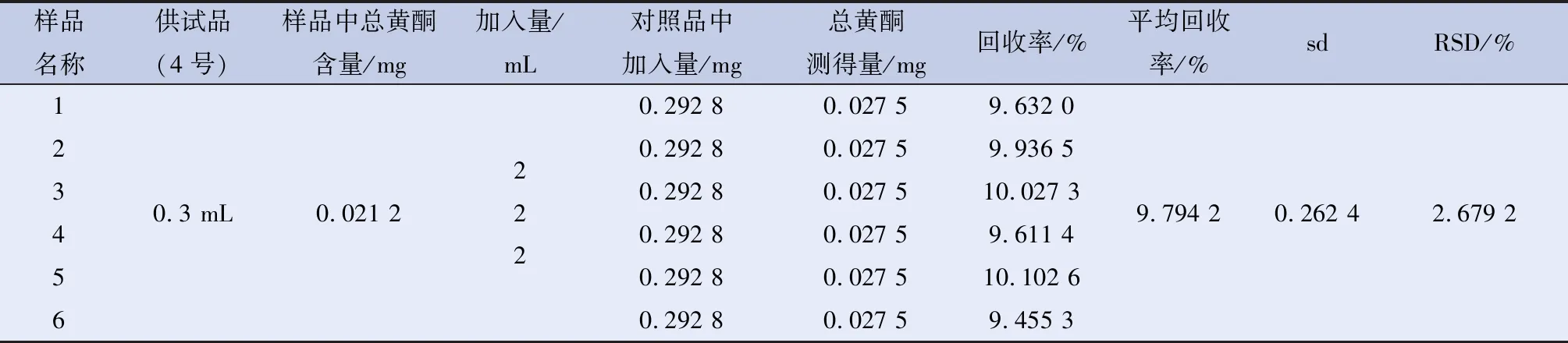
表1 6份供试品4号的加样回收率
取供试品3号0.3mL,共6份,分别加入0.4 mL葡萄糖对照品溶液(0.105 9 mg/mL),按标准曲线制备方法处理后,于485 nm处测吸光度。见表2。

表2 6份供试品3号的加样回收率
取2.3.1项下酶解液0.3 mL共6份,分别加入0.211 8 mg/mL葡萄糖标准液0.4 mL,按总多糖项下方法显色,计算回收率为1.09%;另取上述酶解液3 mL共6份,分别加入0.146 4 mg/mL芦丁标准液2 mL,按总黄酮项下方法显色,计算回收率为2.70%,表明该测定方法准确度符合含量分析的要求。
2.4 在相同酶解条件下,不同酶对桦树桑黄化学成分含量影响
2.4.1 桑黄酶解溶液制备方法 称取白桦树桑黄各4份,每份2.000 g,其中1份加入10倍量蒸馏水,其中3份分别加入0.1%纤维素酶、糖化酶、淀粉酶,固液比为1∶10,将4份样品同时放置在温度30℃、相对湿度55%的恒温恒湿箱中提取2 d,按此条件提取2次,合并溶液,用蒸馏水定容至50 mL,作为供试品溶液组。未加入酶的样品作为总多糖、总黄酮空白溶液组。
2.4.2 桑黄酶解液总多糖、总黄酮测定方法 分别吸取上述4种溶液,每组各2份,按“2.1.3及2.2.3”项下方法进行总多糖,总黄酮测定,得到结果如下。见表3。
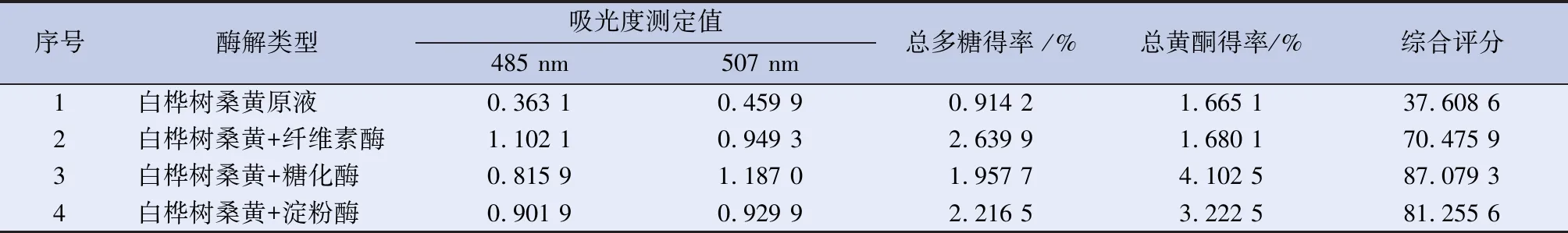
表3 白桦树桑黄不同酶解前后化学成分含量的变化
由表3的综合评分结果可知,桦树桑黄运用纤维素酶、糖化酶、淀粉酶在同等条件下酶解,其糖化酶获得总多糖和总黄酮含量最高。
2.5 在相同酶活力下,不同酶对白桦树桑黄化学成分含量影响
2.5.1 桑黄酶解溶液制备方法 称取白桦树桑黄各4份,每份2.000 g,按照2.4.1项下方法其中1份加入10倍量蒸馏水,其中3份分别加入0.1%纤维素酶(酶活力为5万U/g)、0.1%糖化酶(酶活力为5万U/g)、5%淀粉酶(酶活力为5万U/g),固液比为1∶10,放置在温度为30℃、湿度为55%的恒温恒湿箱发酵2 d,按此条件提取2次,合并溶液,用蒸馏水定容至50 mL,作为供试品溶液组。未加入酶的样品作为总多糖、总黄酮空白溶液对照组。
2.5.2 桑黄总多糖、总黄酮测定方法 分别吸取上述4种溶液,每组各2份,按“2.1.3及2.2.3”项下方法进行总多糖,总黄酮测定,得到结果如下。见表4。

表4 相同酶活力下,三种酶对白桦树桑黄多糖和总黄酮含量的影响
本研究对相同酶解条件、酶解活力下不同类型酶进行了考察,通过表4的综合评分结果可知,纤维素酶酶解总多糖得率为3.466 8%,糖化酶酶解总黄酮得率为6.050 1%,综合评分可知,糖化酶对白桦树桑黄酶解效果最好。
2.6 白桦树桑黄酶解方法正交实验研究[15-17]为了全面考查糖化酶酶解因素对桑黄化学成分的影响,设计L9(34)水平的正交实验。以酶解时间(A)、酶解温度(B)、酶解相对湿度(C)、酶活力(D)为因素设计正交试验,选取总多糖、总黄酮提取率的综合评分为评价指标,研究酶解工艺对白桦树桑黄有效成分提取的最佳工艺,正交试验因素与水平见表5,综合评分结果见表6,方差分析见表7。
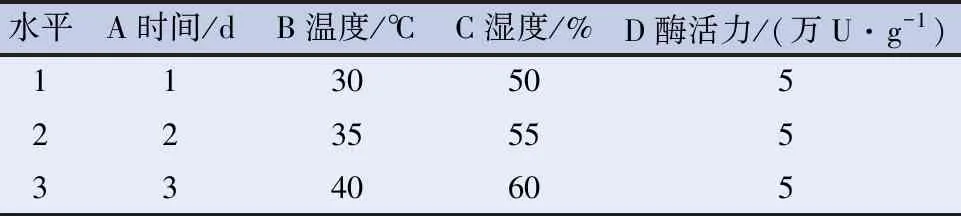
表5 正交实验L9(34)因素
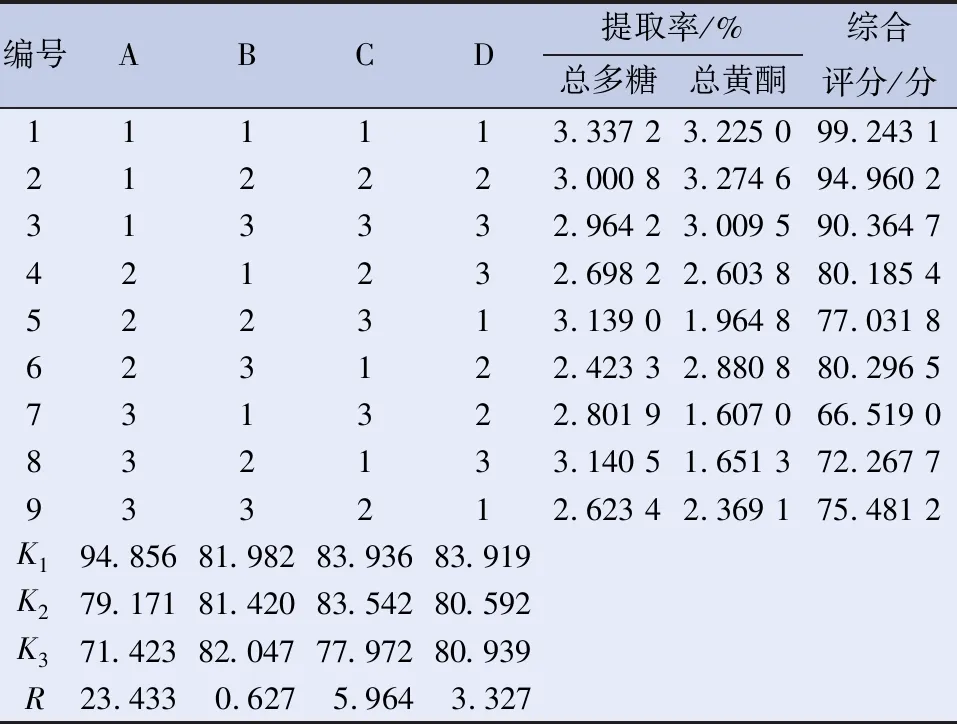
表6 白桦树桑黄酶解工艺正交实验结果(n=9)
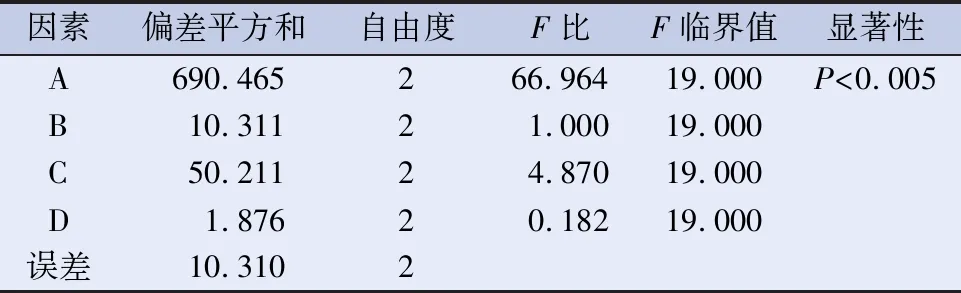
表7 酶解工艺方差分析表
2.7 最佳酶解工艺条件确定 由表7方差分析可以看出各因素对桦树桑黄酶解工艺的影响大小为A(酶解时间)>C(相对湿度%)>D(酶活力)>B(温度),由均值比较可以得出:在酶活力一致时,酶解时间A1>A2>A3,酶解温度B3>B1>B2,相对湿度C1>C2>C3。各因素水平的最优组合为A1B3C1D1,即药材加入糖化酶(5万U/g)在30℃,相对湿度60%条件下的恒温恒湿箱中酶解1d。由表7可见,酶解时间对白桦树桑黄总多糖、总黄酮提取效果有显著影响(P<0.005)。
3 讨论
史玉宝等[18]运用木瓜蛋白酶酶解法提取桑黄多糖,多糖提取率为1.52%。程伟等[19]通过超声波协同纤维素酶酶解法提取桑黄子实体多糖,多糖得率达5.30%,程俊文等[120]采用超声波协同复合酶法提取桑黄多糖,多糖得率3.31%。回晶等[21]采用超声辅助方法提取桑黄中总黄酮,总黄酮提取率为1.145%。胡碧辉等[22]研究不同产地野生桑黄中总黄酮含量,总黄酮提取率平均值为5%。郭海欢等[23]等利用响应面法优化纤维素酶酶解刺玫果黄酮苷元的工艺研究,槲皮素提取量为1.11 mg/g。运用纤维素酶、糖化酶、淀粉酶对桦树桑黄进行酶解,比较酶解前后总多糖、总黄酮含量变化,各类酶酶解后总多糖和总黄酮得率均高于未酶解的药材,桑黄在糖化酶作用下总黄酮提取率最高,为4.102 5%,在淀粉酶作用下总多糖得率最高,为3.466 8%。通过综合评分结果可知,糖化酶酶解效果最优。
黄酮类化合物较难或不溶于水,大多实验均以60%以上乙醇超声提取,增加总黄酮提取率[24]。近年来,很多学者都在研究黄酮类成分水提取工艺,徐君飞等[25]利用水温浸提取地瓜藤中总黄酮含量为25.62 mg/g。吴雨璠等[26]优化了地胆草总黄酮水提工艺,提取率为18.6%。本研究利用糖化酶酶解技术,确定白桦树桑黄同时提取总多糖及总黄酮的条件,为桦树桑黄工业生产及产品开发提供了实验依据。
本研究采用的酶解法比固液态深浅层培养技术发酵桑黄在操作上更简便,对环境等要求较低,更适合于扩大规模生产。
