高龄急性胸主动脉综合征患者的腔内修复治疗
2023-09-27刘宝辉吴恩刚刘典晓王玉玖董圣军
王 锋 刘宝辉 吴恩刚 刘典晓 李 伟 王玉玖 董圣军
滨州医学院附属医院心脏大血管外科 山东 滨州 256603
急性胸主动脉综合征(acute aortic syndrome,AAS)是一类累及胸主动脉且多以突发剧烈胸痛为主要表现的疾病,是一种严重威胁人类生命的疾病。AAS包括主动脉夹层(aortic dissection,AD)、主动脉壁内血肿(intramural hematoma,IMH)、穿透性主动脉溃疡(penetrating aortic ulcer,PAU)。据统计,AAS的年发病率约为每10万人群中3.5~6人[1]。随着对主动脉疾病诊疗水平的提高,特别是胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)的应用,使AAS患者得到有效治疗。
年龄超过80岁的高龄AAS患者往往合并有多种基础疾病,TEVAR手术风险明显增高,对于这类患者是否采取积极的腔内修复治疗仍存在争论。因此,本研究回顾性分析我院治疗80岁以上高龄AAS患者的临床经验,为AAS患者的主动脉腔内修复治疗提供临床依据。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月—2021年12月于我院行TEVAR手术的AAS患者的临床资料。纳入标准:主动脉CT血管造影(computed tomography angiography,CTA)或血管造影诊断为AAS(Stanford B型);年龄≥80岁。共有20例病例资料纳入本研究,见表1。

表1 20例患者的一般资料
1.2 手术方法 病变(主动脉内膜破口、夹层及血肿)距离左侧锁骨下动脉>15 mm者,直接行TEVAR手术;病变距离左侧锁骨下动脉<15 mm,或主动脉弓小弯侧成角过大者,采用左侧锁骨下动脉“体外预开窗”技术行TEVAR手术。通过左侧锁骨下动脉“体外预开窗”,来扩大锚定区以及避免支架血管与主动脉弓成角过大。
1.2.1 直接TEVAR手术 气管插管全麻,左侧肱动脉穿刺,置入6F 动脉鞘管,送入6 F 猪尾导管至升主动脉,行主动脉造影,明确病变类型及位置,了解主动脉弓的形态。平行腹股沟切口,游离股动脉,留置6 F 动脉鞘管,推注1 mg/Kg肝素行肝素化,术中监测激活全血凝固时间(Activated Clotting Time of whole blood,ACT)值。通过动脉鞘管送入导丝与标记造影导管,沿标记造影管送入Landerquist导丝。根据术前主动脉CTA及术中造影测定的锚定区近端主动脉内径,选择放大5%~10%的主动脉覆膜支架,沿Landerquist导丝送入体内,到达标记位置后快速释放主动脉覆膜支架。
1.2.2 左侧锁骨下动脉“体外预开窗”TEVAR手术 根据术前主动脉CTA及术中造影结果,明确主动脉弓各分支血管间的距离、左侧锁骨下动脉开口的直径及主动脉弓充分展开的投射角度。首先于体外释放支架血管,根据术前测量结果,在相应位置剪除人工支架血管的覆膜,再将支架回收至鞘管内,然后将支架近端定位于左颈总动脉远端,释放人工支架血管。释放完成后,行主动脉造影,如果左侧锁骨下动脉预开窗对位不准确,本研究则进一步采用“烟囱”技术,重建左侧锁骨下动脉血运。
1.3 随访 对所有患者进行门诊及电话随访,了解手术效果及有无主动脉相关并发症。并于术后6个月复查主动脉CTA,了解主动脉病变的变化情况。

2 结果
2.1 TEVAR患者的手术情况 20例TEVAR患者均获得手术成功,无死亡,见表2。
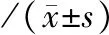
表2 TEVAR患者的手术情况
20例患者围手术期并发症情况如下:①内漏者1例,该患者为主动脉夹层,行TEVAR+左侧锁骨下动脉体外预开窗,术中造影提示存在少量内漏,术后6个月复查主动脉CT证实内漏消失;②中枢神经系统损伤者2例,其中脑卒中者1例,该患者术后出现一侧肢体功能障碍,行颅脑CT证实为脑梗死,随访期间仍遗留肢体功能障碍,另有脊髓缺血者1例,术中应用2枚覆膜支架行胸降主动脉全覆盖,术后出现双下肢肌力减弱,经“腰大池”穿刺引流,术后1 w双下肢肌力恢复至Ⅲ级,术后6个月随访症状消失;③穿刺部位血管出血者1例,该患者左侧肱动脉穿刺部位出血,二次切开进行缝合止血。
2.2 TEVAR患者的随访结果 20例TEVAR患者出院后均获得随访,平均随访时间为(14±2.6 )个月。随访期间, 1例患者于术后10个月猝死,原因不详;1例于术后1个月因再次发生胸痛就诊,行主动脉CTA提示胸主动脉非隔绝区域新发夹层,再次行TEVAR手术。
本组20例患者于术后6个月复查主动脉CTA。20例患者均无Ⅰ型内漏。1例行左侧锁骨下动脉“体外预开窗”TEVAR患者,术后6个月内发生左侧锁骨下动脉近端闭塞。与术前比较,8例AD患者,胸主动脉人工血管覆盖区假腔完全闭合,真腔直径明显增加,P<0.01;胸主动脉人工血管非覆盖区假腔闭合率为20%,真腔直径及假腔直径均无明显变化。见表3。与术前比较,12例IMH及/或PAU患者胸主动脉人工血管覆盖区溃疡病灶完全血栓化,血肿厚度减少,P<0.05。人工血管非覆盖区,血肿厚度无明显变化。见表4。
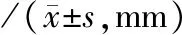
表3 AD患者术后6个月主动脉变化情况
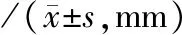
表4 12例IMH及/或PAU患者术后6个月主动脉变化情况
3 讨论
急性主动脉综合征是一类凶险的疾病,严重影响着人类的健康。老年人由于高血压、主动脉壁钙化等原因,AAS的发病率更高。随着人们对这类疾病认识的加深,其治疗方法也趋于成熟,TEVAR手术已经成为这类疾病的主要治疗方法。TEVAR手术的应用需具备两个基本条件[2]:一是健康的主动脉锚定区需至少15 mm;二是要有足够的输送入路血管,一般入路血管直径要大于8 mm。大约有40%的AAS患者的病变邻近左侧锁骨下动脉,导致锚定区不足[3]。这部分患者行主动脉腔内修复时,需要封闭左侧锁骨下动脉以获得足够的锚定区。然而,封闭左侧锁骨下动脉会增加左上肢缺血、脑卒中及内漏等并发症的风险[4-5]。Rehman等[6]在其对46篇累及左侧锁骨下动脉的主动脉夹层相关文献的Meta分析中指出,重建左侧锁骨下动脉与直接覆盖左侧锁骨下动脉的左上肢缺血发生率分别为0%和4.0%(P=0.021),脑卒中发生率分别为1.4%和9.0%(P=0.009),内漏发生率分别为4.0%和29.3%(P=0.001)。因此,目前推荐在行TEVAR手术时,如果需要封闭左侧锁骨下动脉,则应对其进行重建。重建的方法主要包括杂交技术、“开窗”技术、平行支架技术、分支支架技术等。每种技术都有其自身的优点及缺点,这也是目前研究及争论的热点。
年龄在80岁以上的患者,多合并有主动脉壁的粥样硬化斑块,特别是主动脉弓部及其分支血管的粥样硬化斑块,使一些重建左侧锁骨下动脉的技术受到限制。例如,杂交手术术中需阻断颈部血管,钳夹血管时斑块脱落导致脑栓塞的风险加大[7-8]。“烟囱”技术发生内漏的机率较高[9-10],以及有远期发生闭塞的风险[11-12]。分支支架技术操作相对复杂,左侧锁骨下动脉以及主动脉弓部的操作多,增加了斑块脱落的风险。且分支支架需个体化制作,费用较高等[13]。
针对以上技术存在的不足之处,本研究对80岁以上高龄AAS患者,如存在锚定区不足,首选左侧锁骨下动脉“体外预开窗技术”技术,以保留左锁骨下动脉的血流。脑卒中是主动脉腔内修复术的一个严重并发症,其发生率约为2%~8%[14],高龄患者发生脑卒中的风险更高。为了减少因斑块脱落引起的脑卒中,本研究采用左侧锁骨下动脉“体外预开窗”技术,减少了主动脉弓部的操作,降低主动脉腔内修复术中斑块脱落的风险。
综上所述,对于年龄超过80岁的高龄AAS患者,TEVAR手术是一种安全有效的治疗方案。如主动脉锚定区不足时,首先可考虑采用左侧锁骨下动脉“体外预开窗”技术来扩大锚定区。这样,不但可以保留左侧锁骨下动脉的血流,同时也可降低高龄患者围手术期脑卒中的发生。
