基于TLR4/NF-κB通路研究蒺藜总皂苷对周围神经病理性疼痛的镇痛作用*
2023-09-26郭无瑕高呼日叉李晓旭高阿拉坦苏和于志佳赵志英
郭无瑕,高呼日叉,陈 红,李晓旭,高阿拉坦苏和,于志佳,赵志英,张 明
(1.包头医学院,内蒙古 包头 014040;2.包头市第四医院;3.包头医学院麻醉学院;4.包头医学院人体解剖学教研室)
神经病理性疼痛(neuropathic pain, NP)是由躯体感觉系统损伤或疾病导致的疼痛[1],基于损伤或疾病解剖的位置分为周围神经病理性疼痛(peripherally-induced neuropathic pain, pNP)和中枢神经病理性疼痛[2]。研究认为pNP的发生与缺血、代谢、感染、炎症、创伤、药物毒性等因素有关[3]。pNP机制复杂,研究阐述的机制包括离子通道改变、外周敏化、中枢敏化、下行抑制系统功能降低、神经胶质细胞活化等[4]。pNP是临床最为难治的慢性疼痛,以自发性疼痛、触诱发痛和痛觉过敏为主要特征,其中触诱发痛是pNP最突出的特点,表现为轻微的非伤害性刺激即可引起患者难以忍受的剧烈疼痛[5]。由于病因、机制、临床症状多样化,因此临床治疗效果欠佳。近年来对于pNP治疗靶点的研究层出不穷,多通过信号通路着手,干预措施多样化,尤其是针对神经胶质细胞的研究更多。在神经系统中,NF-κB仅以p50或p65两种亚型存在[6]。NF-κB主要通过经典途径和非经典途径通路调控炎症反应,其中,细胞因子受体及Toll样受体参与的经典途径与NP病理密切相关[7-8]。研究发现,抑制胶质细胞NF-κB信号通路可提高NP动物模型痛敏阈值,并促进白介素6(IL-6)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达[9]。
蒺藜(tribulus terrestris linnaeus),别名次蒺藜、硬蒺藜、白蒺藜,为内蒙古道地药材,蒙药名为“伊曼—章古”。传统中医认为蒺藜具有“平肝解郁、活血祛风、明目止痒”的功效。蒺藜中含有多种重要的生物活性物质如皂苷类、黄酮类、生物碱类、多糖类等,具有众多的药理作用。其中蒺藜总皂苷(gross saponin from tribulus terrestris,GSTT)是蒺藜的主要有效成分,具有显著的改善记忆力、抗炎、抗衰老、抗抑郁、降血糖、降血脂及提高人体中性激素含量等的作用[10-11]。近期研究发现GSTT通过抑制TLR4/NF-κB通路发挥抗炎作用,能显著降低肿瘤坏死因子α(TNF-α)和炎症介质一氧化氮(NO)的含量;降低Toll样受体4(TLR4)、泛素连接酶6(TRAF6)蛋白水平,抑制IκB磷酸化[12]。白蒺藜皂苷可增强轴突再生并减少周围神经横断后的神经元死亡,对周围神经具有保护作用[13-14]。
目前对GSTT的研究主要集中在中枢神经的保护作用,周围神经保护涉及甚少。根据最新药理作用研究,发现GSTT可通过TLR4/NF-κB通路发挥抗炎作用。而有研究发现,NP的发病机制中胶质细胞激活的通路有NF-κB信号通路。基于此,本研究拟以TLR4/NF-κB通路研究GSTT对周围神经损伤的保护作用,并通过实验验证不同剂量GSTT是否对慢性坐骨神经损伤(chronic constriction injury, CCI)大鼠所引起的pNP具有镇痛作用,从而为GSTT的周围神经保护作用提供理论依据,也为pNP的治疗寻求新的手段,拓宽中蒙药的药用价值。
1 材料和方法
1.1仪器与试剂 刺蒺藜提取物购自西安悦源生物科技有限公司(批号20200715,纯度90 %),普瑞巴林胶囊(齐鲁制药,批号GE2B1037),即用型免疫组化试剂盒购自福州迈新生物技术有限公司(批号KIT-9901),抗大鼠NF-κB抗体购自北京博奥森生物技术公司(AH10088272),Von Frey探针(上海玉研科学仪器有限公司,型号514000-20C);RB-200智能热板仪(成都泰盟科技有限公司)。
1.2实验动物 40只清洁级雄性Sprague-Dawley(SD)大鼠,体重220~250 g,购自北京斯贝福生物技术有限公司(批号:110324210105972843)。大鼠在室温下进行明暗循环(光照12 h/d,时间8∶00-20∶00)。实验前,大鼠适应性饲养3~5 d。本实验经包头医学院医学伦理委员会批准,按照国家卫生研究院《实验动物护理与使用指南》进行。
1.3方法
1.3.1模型制备 按Bennett 和Xie[15]的方法制作经典CCI模型:待大鼠进入深度麻醉后,俯卧位置于操作台,选右后肢股骨近心端处剃毛,范围约直径1.5 cm,碘伏消毒3遍,在平行于股骨处下方作一横形切口,长度1 cm,钝性分离肌肉组织找到坐骨神经,自近心端至远心端用4.0可吸收线在坐骨神经上结扎四个间隔1 mm的结,第一个结扎时松紧度以看到大鼠右足抽动为宜,后三个结松紧度以能够在坐骨神经上滑动为宜,完毕后用玻璃分针将结扎好的坐骨神经恢复到原位,伤口处涂撒青霉素钠后缝合肌肉和皮肤,待大鼠苏醒后放回笼中饲养。造模成功的标志:大鼠出现右后肢足部的轻度外翻状,并且出现跛行。
1.3.2分组与药物干预 40只大鼠随机分为假手术组(SHAM组)、CCI组、GSTT 100 mg/kg+CCI组、GSTT 200 mg/kg+CCI组、普瑞巴林+CCI组(阳性对照)5个组,每组8只。模型建立成功后,第4 天开始给予干预,GSTT 100 mg/kg+CCI组,GSTT 200 mg/kg+CCI组及普瑞巴林(10 mg/kg)+CCI组大鼠每天按设定的剂量灌胃治疗,CCI组和SHAM组给予等体积生理盐水灌胃,持续7 d。
1.3.3Von Frey实验 使用Von Frey探针测定各组大鼠的机械性痛觉过敏程度。将各组大鼠置于底部为网格的笼中适应15 min,待其安静后,以Von Frey探针(从最小克数开始)用能使纤维丝弯曲为“S”形的力度垂直刺激结扎侧足底,持续5 s。刺激过程中或撤除刺激后大鼠出现缩爪或添足现象视为阳性疼痛反应,记录此时所使用纤维丝的克数即为机械缩足反射阈值(paw withdrawal mechanical threshold, PWMT)[17],重复测试5次,中间间隔5 min,出现3次阳性为判定标准,取平均值。
1.3.4热痛敏实验 在安静环境下,用智能热板仪进行热痛敏实验。将大鼠放置到已设定好温度(52 ℃)的热平板上,记录大鼠出现抬右后足或添足时间,记为热敏潜伏期,一人操作,一人记录,放置时间不超过60 s,重复测量3次,取平均值,每次间隔时间10 min。
1.3.5取材方法 灌注取材:麻醉大鼠后,取仰卧位,以剑突为开口,沿两侧季肋区剪开胸腔,暴露心脏,谨慎剥离心包膜,左手拇指和食指小心固定心脏,右手用20 mL注射器针头(尖部磨平,后接输液器)插入心尖部,可见输液管中回血,同时右心耳剪一小口后开始灌注。先快速灌注生理盐水,待大鼠肝脏无血色后再灌注4 %多聚甲醛溶液,此时可看到大鼠全身抽动,待大鼠身体变硬后停止灌流。取材背根神经节:先找到手术侧结扎坐骨神经,沿坐骨神经逆行追踪L4、L5和L6三个脊神经分支至椎间孔外口,再沿L4、L5、L6各自神经走行方向适当用力即可将术侧三个背根神经节形态完整地从椎间孔拉出,修整后立即放入4 %多聚甲醛中外固定[16]。脊髓取材:剪刀剪开大鼠背侧皮肤,剔除脊柱旁边的肌肉并暴露椎骨,利用咬骨钳谨慎剪开椎骨,取出脊髓腰膨大的节段立即放入4 %多聚甲醛中外固定。
1.3.6HE染色 灌注取材后的脊髓腰膨大及背根神经节组织经石蜡包埋切片,随后依次放入二甲苯Ⅰ15 min、二甲苯Ⅱ15 min,无水乙醇Ⅰ10 min、无水乙醇Ⅱ10 min、90 %乙醇5 min、80 %乙醇5 min、70 %乙醇3 min(脱蜡)、蒸馏水2 min、苏木素染色10 min,流水冲洗3次,盐酸乙醇分化3 s,伊红染色5 min,乙醇梯度(低浓度到高浓度)脱伊红,二甲苯透明2次后中性树脂封片,在光学显微镜下放大200倍观察脊髓背角及背根神经节神经细胞的形态。
1.3.7免疫组化 灌注取材后的脊髓腰膨大及背根神经节组织,4 %多聚甲醛外固定24 h后,蔗糖梯度沉淀后制作冰冻切片,切片厚度为10 μm;用0.01 M的PBS冲洗3次,3 %的双氧水室温孵育10 min以去除内源性过氧化物酶,0.01 M的PBS冲洗3次,用1 N盐酸抗原修复10 min,PBS冲洗后滴加5 %牛血清白蛋白(5 % BSA)封闭液,37 ℃孵育1 h,甩干,滴加配好的一抗(NF-κB抗体为兔来源,稀释比例为1∶100),将切片放入底部装有水的暗盒里,4 ℃冰箱过夜;次日,将暗盒拿出,室温放置15 min,使组织平衡至室温,用0.01 M的PBS冲洗3次,每次5 min;滤纸吸干液体后,滴加聚合辣根过氧化物酶(HRP)标记抗兔IgG,37 ℃孵育1 h;PBS冲洗后显色剂显色,使用DAB显色,5 min后,放入PBS中,待其终止显色反应,再用0.01 M的PBS进行冲洗3次,去除组织周围的显色液;将组织分别经70 %、80 %、90 %和100 %的乙醇进行脱水,二甲苯透明后用中性树脂封片。显微镜下拍照,用Image图像分析系统观察分析反应密度。
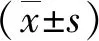
2 结果
2.1大鼠PWMT的测定结果 术前各组大鼠手术侧(右侧)后肢PWMT差异无统计学意义(P>0.05),手术后第3 天开始,CCI组大鼠与SHAM组大鼠相比,PWMT明显降低(P<0.05),提示造模成功;术后第7、10 天,与CCI组相比,GSTT 100 mg/kg+CCI组、GSTT 200 mg/kg+CCI组、普瑞巴林+CCI组大鼠PWMT升高,差异均有统计学意义(P<0.05)。见表1。

表1 GSTT对CCI所诱导的周围神经病理性疼痛大鼠PWMT的影响
2.2大鼠热敏潜伏期的测定结果 CCI大鼠热敏潜伏期测定结果显示,术前各组大鼠手术侧(右侧)后肢热敏潜伏期差异无统计学意义(P >0.05),手术后第3 天开始,各CCI组大鼠与SHAM组相比,手术侧热敏潜伏期明显降低(P<0.05),术后7、10 d,与CCI组相比,GSTT 100 mg/kg+CCI组、200 mg/kg+CCI组、普瑞巴林+CCI组大鼠热敏潜伏期升高(P<0.05)。见表2。
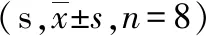
表2 GSTT对CCI所诱导的周围神经病理性疼痛大鼠热敏潜伏期的影响
2.3各组大鼠脊髓背角及背根神经节病理变化
2.3.1背根神经节 SHAM组大鼠背根神经节大神经元结构正常,核圆且饱满,核仁清晰。CCI组大鼠可见部分神经元胞体面积缩小,胞质浓缩,与周围其他神经元细胞相分离;同时一些大神经元细胞直径稍减小,胞质密度明显下降,内含大量空泡;部分细胞核染色较浅,细胞核、核仁形态模糊、不规则。与CCI组相比,GSTT 100 mg/kg+CCI组略有改善,GSTT 200 mg/kg+CCI组及普瑞巴林+CCI组改善明显。见图1。

图1 各组大鼠背根神经节HE染色(×200)
2.3.2脊髓背角 SHAM组大鼠脊髓背角神经元及胶质细胞结构完整,核染色深,清晰,可见核仁。CCI组大鼠脊髓背角神经细胞染色浅,细胞萎缩,部分碎裂,细胞核丢失。与CCI组相比,GSTT 100 mg/kg+CCI组、GSTT 200 mg/kg+CCI组、普瑞巴林+CCI组病理改变明显改善。见图2。

图2 各组大鼠脊髓背角HE染色(×200)
2.4免疫组织化学结果
2.4.1背根神经节 CCI组大鼠的背根神经节中NF-κB表达明显高于SHAM组,而GSTT 100 mg/kg+CCI组、GSTT 200 mg/kg+CCI组、普瑞巴林+CCI组表达明显低于未做处理的CCI组。见图3。

图3 NF-κB在背根神经节中的表达
2.4.2脊髓背角 CCI组大鼠的脊髓背角中NF-κB表达明显高于SHAM组,而GSTT 100 mg/kg+CCI组、GSTT 200 mg/kg+CCI组、普瑞巴林+CCI组表达明显低于未做处理的CCI组。见图4。

图4 NF-κB在脊髓背角的表达
3 讨论
在本研究中,GSTT可以显著缓解CCI诱导的周围神经病理性疼痛大鼠的机械和热痛觉过敏。在随后的实验中观察到GSTT抑制了CCI诱导的大鼠背根神经节及脊髓背角中NF-κB的过度产生,推断GSTT可能通过抑制TLR4/NF-KB信号通路发挥作用。
周围神经病理性疼痛是一种慢性疼痛,以自发性疼痛(如夜间疼痛、静息痛)、痛觉过敏(如轻触引起的剧烈疼痛)、异常疼痛(如烧灼、电击、针刺痛)和感觉异常为特征[18]。在本研究中,GSTT能明显缓解CCI处理大鼠的机械和热致痛觉。值得注意的是,在pNP大鼠中,低剂量的GSTT和高剂量的GSTT同样有效。这一发现提示GSTT具有良好的镇痛潜力,然而,药物的剂量选择仍需要进一步的研究。
在pNP的发生发展过程中,胶质细胞可激活一系列促炎细胞因子。因此,探索天然中草药通过抑制神经胶质细胞的激活和神经炎症的产生来治疗pNP是一种可行的策略。TLR4/NF-κB信号通路在先天免疫和炎症中发挥着重要的作用[19]。TLR4表达于小胶质细胞和星形胶质细胞表面,通过不同接头蛋白信号通路诱导促炎细胞因子[20]。细胞内TLR4的TIR区域与MyD88的羧基端结合,MyD88的氨基端与IL-1受体相关激酶(Irak)的氨基端结合,激活Irak。活化的Irak重新激活肿瘤坏死因子受体关联因子6(TRAF-6),TRAF-6激活NF-κB激酶抑制剂(p-IκB)复合物,导致NF-κB激活和转位进入细胞核诱导特异性基因表达并激活IL-1、IL-6、TNF-α等细胞因子[21-22]。研究证实了NF-κB在CCI处理的大鼠脊髓后角及背根神经节中表达显著上调,并被GSTT抑制。值得注意的是,GSTT处理降低了脊髓后角和背根神经节中NF-κB p65的磷酸化水平,表明抑制脊髓中TLR4/NF-κB信号通路与GSTT对CCI诱导的pNP的镇痛作用有关。未来的研究需要更深入到基因水平,探索多种干预手段,来证实GSTT的镇痛作用与这些疼痛相关分子之间的关系。目前的研究可能揭示GSTT对周围神经损伤具有修复作用,有希望成为新的治疗靶点。
综上所述,本研究结果表明,GSTT治疗可减弱CCI诱导的pNP症状。其机制可能是通过阻断TLR4/NF-κB信号通路,抑制小胶质细胞和星形胶质细胞的活化,以及抑制CCI诱导pNP大鼠脊髓及背根神经节中促炎细胞因子的表达而进行镇痛。
