远隔缺血预处理促进压力负荷性心肌肥厚术后逆重构的作用及机制研究
2023-09-26裴汉军
贾 娜,裴汉军
(内蒙古科技大学包头医学院第一附属医院心内科,内蒙古 包头 014010)
压力负荷性心肌肥厚(pressure-overload myocardial hypertrophy, POMH)是在心脏后负荷长时间增加时的一种重要的代偿性反应,此现象较常见于主动脉瓣狭窄(aortic stenosis, AS)的患者,临床可表现为心绞痛、呼吸困难和晕厥[1]。中度以上AS患者一般都需进行手术治疗,然而对于术后不良预后以及恢复缓慢等特点,单纯解除梗阻症状而忽略了心肌细胞的逆重构可能会错失防治重度AS术后并发症发生和降低死亡率的最佳时机[2]。因此,目前亟需寻找到新的促进心肌肥厚术后逆重构的防治策略。
远隔缺血预处理(remote ischemic preconditioning, RIPC)是一种在传统瓣膜性心脏手术和冠脉介入术中转化应用最为广泛的新型内源性心肌保护措施[3],其通过远隔器官(相对心脏而言,如肢端)的间断缺血/复灌数次循环,可调动心脏内源性抗损伤机制提高其对长时间缺血的耐受能力。研究表明反复多次RIPC可减轻大鼠急性心梗后不良左心室重构[4-5]。而与RIPC具有共同保护机制的慢性运动预适应[6-7],可减轻大鼠主动脉缩窄模型的POMH[8-10],由此推断,RIPC对促进POMH术后逆重构具有一定的潜在作用。本文主要通过细胞层面探讨RIPC在促进POMH术后逆重构中的作用及其机制,为后续研究提供相应证据支持及研究思路。
1 材料与方法
1.1细胞培养及分组 采用H9C2大鼠心肌细胞进行培养。实验分成三组,分别为正常对照组(Sham)、POMH组、RIPC组。三组细胞培养方法分别为:正常对照组无其他干预常规DMEM培养5 d;POMH组通过Ang II处理24 h后,常规DMEM液培养4 d;RIPC组通过Ang II处理24 h后对细胞用RIPC分离液稀释处理1 h(1次/24 h,共4次)。
1.2检测指标 通过检测细胞内脑钠肽(brain natriuretic peptide,BNP)、β-肌球蛋白重链(β-myosin heavy chain,β-MHC)两种心肌肥厚标志物的表达,判断H9C2心肌肥厚细胞模型建立成功与否以及RIPC对其是否具有逆转作用;检测细胞凋亡标志物程序性细胞死亡因子4(programmed cell death factor 4,PDCD4)、半胱氨酸蛋白酶-3(caspase-3)和线粒体自噬标志物LC3II/I和Beclin1。
1.3实时定量PCR检测法 采用Trizol法提取各组H9C2细胞总RNA。根据逆转录试剂盒说明书将其逆转录为cDNA。以cDNA为模板,用实时定量PCR检测BNP、β-MHC表达水平。引物序列见表1。PCR反应条件为:94 ℃变性30 s,随后94 ℃退火30 s和60 ℃延伸30 s共40~50次循环。所有目的基因mRNA定量结果均通过熔解曲线分析验证PCR产物的特异性,确保产物无引物二聚体,每样本重复3次。用2-ΔΔCt表示目的基因mRNA表达水平。基因序列见表1。

表1 基因引物序列
1.4Western blot蛋白免疫印迹法 通过试剂盒提取各组细胞总蛋白,按照BCA试剂盒说明书进行蛋白定量后,每个样孔加入30 μg蛋白样品进行Western blot检测,以β肌动蛋白作为内参,采用Image J图像分析软件对蛋白条带积分吸光度(integrated absorbance,IA)值进行分析。待测蛋白相对表达水平用(目标蛋白/β肌动蛋白)表示。
1.5统计学分析 采用SPSS 25.0软件进行统计分析,采用GraphPad Prism 9.0软件作图,用单因素方差分析(one-way ANOVA)分析数据,组间比较方差齐用LSD检验,方差不齐采用Dunnett T3检验。以P<0.05为差异具有统计学意义。
2 结果
2.1RIPC对POMH逆重构的改善作用 通过PCR检测各组细胞内心肌肥厚标志物β-MHC和BNP的表达水平,发现与正常组相比,POMH组内β-MHC和BNP的表达含量升高(P<0.05),在给予RIPC处理后能够明显降低β-MHC和BNP的表达水平,从而改善POMH中心肌细胞功能障碍。见图1。
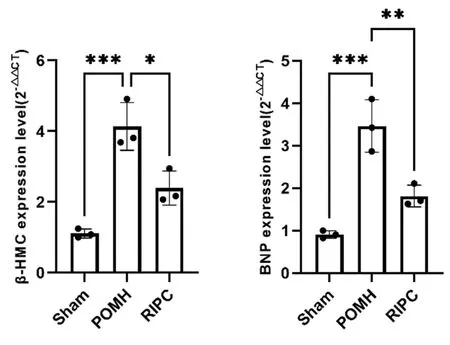
图1 RIPC对POMH术后逆重构的改善作用
2.2RIPC促进POMH逆重构作用机制探索 为了进一步探索RIPC促进POMH逆重构的作用机制,通过Western blot蛋白免疫印迹法检测各组细胞内相关细胞凋亡蛋白以及线粒体自噬相关蛋白的表达水平。与正常组相比,POMH组中PDCD4和Cleaved-caspase-3相关细胞凋亡蛋白表达水平明显升高(P<0.05),给予RIPC处理后能够明显抑制该细胞凋亡趋势;在自噬水平上,RIPC亦能够通过上调细胞内LC3II/I以及Beclin1蛋白表达水平从而达到促进POMH中逆重构的作用。见图2、3。

图2 RIPC改善POMH中细胞凋亡
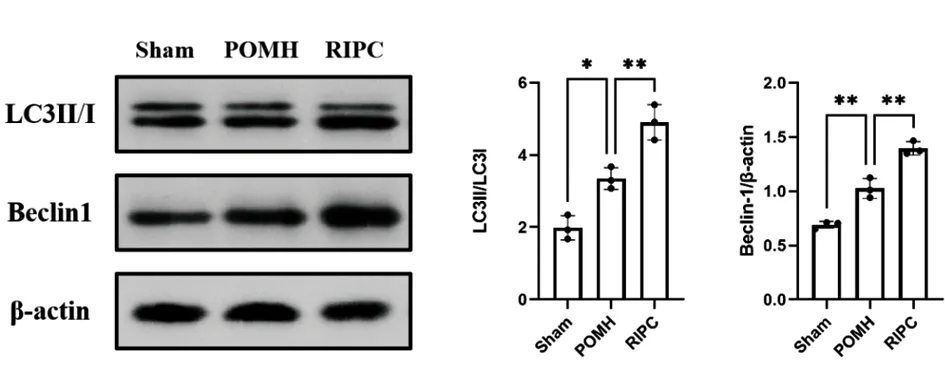
图3 RIPC通过线粒体自噬促进POMH术后逆重构
3 讨论
压力负荷性心肌肥厚是一种重要的代偿性反应,其作用是减少室壁承受的压力及维持正常心输出量,在细胞水平表现为心肌细胞体积增大、新肌小节蛋白形成。然而,心肌细胞肥大,细胞内线粒体数目却增加不明显,同时单位心肌重量的毛细血管相对减少,发生“心肌肥大不平衡生长”现象,最终导致心肌细胞功能障碍[11]。研究表明,心肌肥厚可造成心肌细胞线粒体稳态失衡。线粒体作为细胞能量代谢的枢纽,提供细胞维持生命活动所需要的必要物质,有“细胞动力工厂”之称[12]。线粒体自噬是一种特异性细胞器自噬,适度自噬可选择性清除受损的线粒体,避免细胞死亡;过度自噬则会损伤正常的线粒体[13]。线粒体自噬与心肌细胞功能障碍的相关性是RIPC促进POMH术后逆重构作用机制的研究重点。
本研究对RIPC促进POMH术后逆重构的作用及机制进行探索,通过H9C2心肌细胞建立模型。脑钠肽主要是从胚胎和成体的心肌细胞中产生,在病理条件下,经过促肥大因子的影响,心室肌细胞从收缩(成人)到合成体(胚胎),作为心肌收缩的一种重要补偿机制,BNP基因会再次表达[14]。目前研究已发现心肌细胞肥大的标志物有β-肌球蛋白重链、肌球蛋白轻链1/3(MLC1/3)、肌钙蛋白C、脑钠肽等[15-16],故本次研究通过检测细胞内β-MHC和BNP两种心肌肥厚标志物的表达,判断H9C2心肌肥厚细胞模型建立成功与否以及RIPC对其是否具有逆转作用。结果显示,给予RIPC处理后能够明显逆转心肌肥厚相关蛋白β-MHC和BNP的表达水平,表明RIPC对于促进心肌细胞POMH逆重构具有较好作用。PDCD4和Caspase-3广泛存在于各种凋亡细胞中,并且在心肌细胞也有表达,是细胞凋亡关键因子之一[17]。LC3-I通过复合物的作用与磷脂酰乙醇胺共价结合,生成LC3-II;随后LC3-II与吞噬团和自噬体膜紧密结合,是典型线粒体自噬完成的经典标志物,因此LC3-II蛋白被广泛用作自噬指标[17-18]。同样,作为非典型自噬标志物的Beclin1蛋白能够跟III类磷脂酰肌醇3-激酶(PtdIns3K)结合从而参与线粒体非典型自噬过程[19]。结果显示,给予RIPC处理后能够通过下调PDCD4和Caspase-3的表达水平,明显抑制POMH组中细胞凋亡率的增加,并且通过线粒体自噬途径上调LC3II/I和Beclin1的蛋白表达水平,达到促进POMH术后逆重构的作用,显示其作用机制与线粒体自噬相关。
综上所述,RIPC能够促进POMH术后逆重构,其机制与线粒体自噬相关,本次研究为RIPC促进POMH术后逆重构作用提供新的研究思路,具体机制有待进一步研究。
