TLR3 rs3775290与慢性乙型肝炎病毒感染风险的相关性研究
2023-09-26董文杰阎小霞贾彦彬解英波
董文杰,阎小霞,贾彦彬,解英波,高 芳
(1.内蒙古科技大学包头医学院,内蒙古 包头 014040;2.包头市疾病预防控制中心)
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球性的公共卫生问题,估计全球HBV携带者高达3.7亿人[1]。我国是乙型肝炎的高发流行区。2016年全国HBV感染血清流行病学调查研究,整体人群乙肝病毒表面抗原(HBsAg)携带率为10 %[2],约占全球HBV携带者三分之一[3]。HBV感染后临床表现呈多样性,可表现为慢性乙型肝炎(chronic Hepatitis B,CHB)、急性肝炎、重症肝炎或无症状携带者[4]。机体内乙型肝炎病毒的持续感染可以引起慢性肝脏疾病,主要临床转归有肝硬化和肝癌[5]。目前仍缺乏高效药物用于乙型肝炎治疗[4],如何对乙型肝炎进行有效防治,是目前面临的一个公共卫生问题。探索影响乙型肝炎病毒感染的因素并有效地控制HBV感染是亟待解决的问题。
近年来,Toll样受体家族(toll-like receptors, TLRs)是一类跨膜信号传递受体,属于模式识别受体,在抗病原微生物与抗感染免疫防御机制中发挥重要的作用[6]。TLRs在肝脏组织细胞中均有表达,并使其在非特异性免疫应答过程中产生和释放多种细胞因子与炎症因子,参与肝细胞免疫病理损伤[7]。到目前为止,人体已发现11种TLRs[7],其中TLR3 (toll-like receptor 3,TLR3)能够特异性识别病毒dsRNA,表达于Kupffer细胞、肝细胞和胆管上皮细胞,发挥抗病毒感染的作用[8]。研究表明TLR3的异常表达与HBV相关性肝癌有一定关系[9]。本研究选取内蒙古鄂尔多斯市汉族人群,探讨TLR3基因多态性与慢性乙型肝炎病毒感染易感性的相关性,为HBV相关的慢性乙型肝炎的早期诊断和治疗提供理论基础。
1 对象与方法
1.1对象 选取2014年5月至2016年7月鄂尔多斯第二人民医院收治的172例慢性乙型肝炎患者为CHB组。CHB诊断标准:根据乙肝表面抗原(HBsAg)、表面抗体(抗HBs)、乙肝e抗原(HBeAg)、e抗体(抗HBe)、乙肝核心抗体(抗HBC)5项血清标记物检查结果进行诊断,以HBsAg阳性且乙肝病毒感染时间超过半年为CHB。同时收集门诊体检健康者200例为正常对照组(乙肝血清五项标志物结果全部为阴性,均无乙肝的病史和明显的肝部疾病)。CHB病例组和对照组均为内蒙古鄂尔多斯地区汉族人,相互之间无血缘关系。
1.2基因分型 (1)基因组DNA提取:无菌抽取血样3 mL,应用全血基因组DNA提取试剂盒提取外周血中的DNA,-20 ℃保存备用。(2)采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)方法进行基因分型。①SNP rs3775290位点引物序列:上游引物为5′-ATGTTGGCTATGTTGTTGTTGC-3′,下游5′-CAAAGTATTTCCCTTGCCTCCAC-3′。②PCR反应体系:扩增总体系为25 μL, 内含基因组DNA (60 ng/μL、2 μL),2×Taq Master Mix 12.5 μL,上下游引物各1 μL(10 μmol/L), ddH2O 8.5 μL。③PCR扩增:rs3775290位点反应条件:94 ℃预变性5 min后,进行35个循环,每个循环中94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,最后72 ℃延伸5 min。扩增后得到的PCR产物长度为557 bp,1.5 %琼脂糖凝胶电泳,凝胶成像分析PCR产物的特异性。④RFLP的反应体系:总体系20 μL,包含限制性内切酶BstBI(0.5 μL)、PCR产物(2 μL)、10×Buffer(2 μL),ddH2O(15.5 μL)。在37 ℃水浴60 min。rs3775290位点酶切后得到一条557 bp的基因片段为AA纯合子;得到373 bp、184 bp的基因片段为GG纯合子,得到557 bp、373 bp、184 bp 3种大小不同的基因片段为AG杂合子。
1.3统计学分析 采用SPSS 19.0统计软件进行数据分析。用拟合优度χ2检验检测基因型分布是否符合Hardy-Weinberg平衡;先检测等位基因和基因型在CHB病例组和对照组的频率分布差异,用非条件性Logistic回归计算比值(OR)及其95 %可信区间(CI)评价等位基因、基因型与慢性乙型肝炎发生的关系。以P<0.05为差异有统计学意义。
2 结果
2.1一般资料 在372例样本中,CHB组172例,对照组200例,两组年龄、性别比较差异均无统计学意义(P>0.05)。见表1。
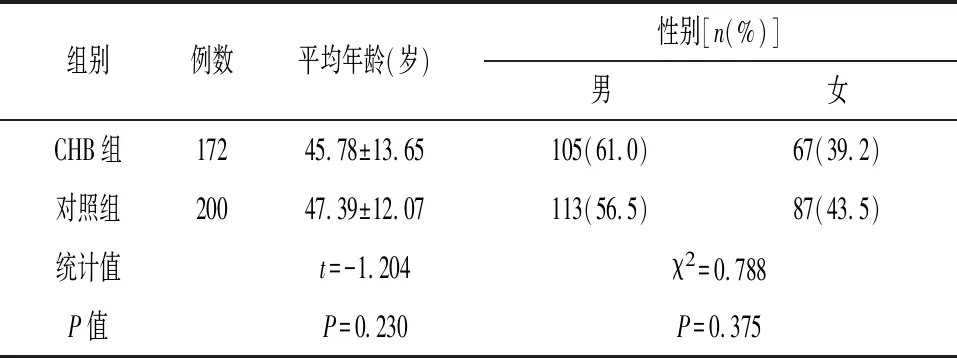
表1 CHB病例组和正常对照组的一般特征
应用Hardy-Weinberg遗传平衡吻合度检验方法,CHB病例组χ2=2.11,P=0.34 ;正常对照组χ2=0.304,P=0.859,均P>0.05,说明TLR3 rs3775290 位点在对照组和CHB组的基因型分布均符合Hardy-Weinberg平衡, 提示本研究样本具有群体代表性。
2.2TLR3 基因SNP rs3775290位点等位基因、基因型与慢性乙型肝炎病毒感染的关联分析 SNP rs3775290位点在对照组中GG、AG 、AG基因型频率分别为50.5 %、39.5 %、10.0 %。在CHB病例组GG、AG、AA基因型频率分别为56.4 %、34.9 %、8.7 %。在对照组中等位基因G、A频率分别为70.2 %、29.8 %。在CHB病例组等位基因G、A频率分别为73.8 %、26.2 %。统计结果显示:TLR3基因SNP rs3775290位点其基因型频率、等位基因频率在CHB组和对照组的分布差异均无统计学意义(P>0.05)。见表2。
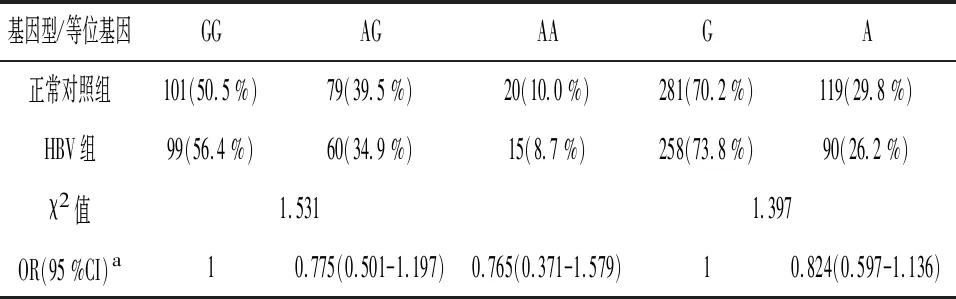
表2 rs3775290位点基因型、等位基因与慢性乙型肝炎病毒感染的关联分析
2.3不同遗传模式下rs3775290与慢性乙型肝炎病毒感染风险的关系 分析TLR3基因SNP rs3775290在共显性、显性、隐性、超显性等四种遗传模型下与慢性乙型肝炎病毒感染的关系。统计结果显示,在四种遗传模型下,SNP rs3775290与HBV感染均无关联(P>0.05)。见表3。
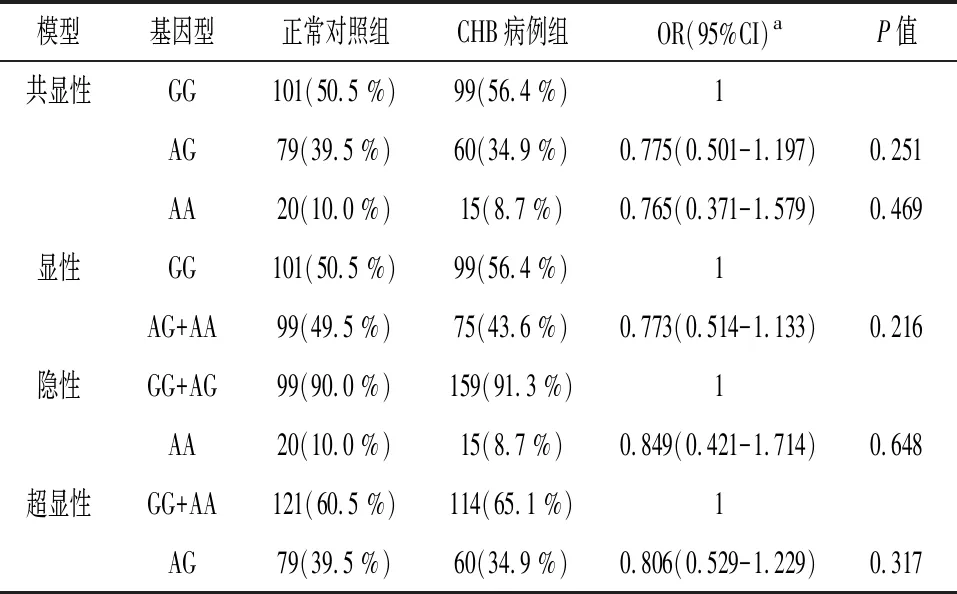
表3 不同遗传模式下 rs3775290与慢性乙型肝炎病毒感染风险的关系
3 讨论
乙型肝炎病毒感染后临床表现呈多样性,可表现为慢性乙型肝炎、急性肝炎、重症肝炎、无症状携带者[4]。1963年,Blumberg在研究人类血清蛋白的多态性时发现HBV的表面抗原[2]。肝细胞虽然是HBV的靶细胞,但近年来大量的研究表明,HBV并不直接引起肝细胞损伤,而是通过血液或肝细胞膜上的病毒抗原成分诱导机体产生特异性的免疫应答导致肝细胞损伤。研究表明,当乙型肝炎病毒感染者免疫力处于较低水平时,病毒与宿主之间和平共处形成免疫耐受,临床表现为无症状HBV携带者或慢性持续性肝炎[4]。慢性肝炎造成的肝细胞慢性病变诱发肝硬化。目前仍缺乏特效的药物用于乙型肝炎治疗,一般认为,同时应用广谱抗病毒药物和调节机体免疫功能的药物治疗效果较好。干扰素、拉米夫啶、IFN-α及清热解毒、活血化瘀的中草药等,对部分病例有一定疗效。因此,针对慢性乙型肝炎病毒的人群遗传基因型以及抗感染免疫防御机制研究尤为重要。
Toll样受体家族(TLRs)在抗病原微生物与抗感染免疫防御机制中发挥重要的作用[6]。到目前为止,人体已发现11种TLRs[7]。其中TLR3 (toll-like receptor3,TLR3)能够特异性识别病毒dsRNA,表达于Kupffer细胞、肝细胞和胆管上皮细胞,在微生物感染中也发挥一定的免疫防御作用。TLR3是病毒dsRNA的受体。当病原体感染宿主时,机体会产生一些病毒相关模式识别分子,这些分子可以与机体的模式识别受体(TLR3 就是模式识别受体之一)发生特异性结合,从而激活细胞信号传导通路,发挥抗病毒感染作用[10]。王红梅等[11]对TLR3在原发性胆汁性肝硬化患者外周血单核细胞中的表达水平进行研究,发现患者的TLR3的表达水平高于健康对照人群。国外文献也做了相关的研究报道,如AL-Qahtani等[12]研究了沙特阿拉伯人群中TLR3基因rs5743311等9个位点的SNP与HBV发病风险的相关性[9]。
本研究在内蒙古鄂尔多斯市汉族人群中检测了TLR3基因rs3775290位点多态性与慢性乙型肝炎病毒的感染关系。研究样本为内蒙古鄂尔多斯市汉族人群。SNP rs3775290位点在CHB病例组GG、AG、AA基因型频率分别为56.4 %、34.9 %、8.7 %;等位基因G、A频率分别为73.8 %、26.2 %。对照组中GG、AG 、AG基因型频率分别为50.5 %、39.5 %、10.0 %;等位基因G频率为70.2 %、A频率为29.8 %。研究表明在内蒙古鄂尔多斯地区汉族人群中慢性HBV感染者rs3775290位点GG基因型频率最高,AA基因型频率最低,等位基因G频率远高于A基因频率。统计结果显示,TLR3 基因SNP rs3775290位点,两组基因型频率分布差异P=1.531、等位基因频率的分布差异P=1.397,两组均P>0.05,说明rs3775290位点的等位基因频率、基因型频率在CHB病例组和对照组差异无统计学意义。rs3775290位点在共显性、显性、隐性、超显性四种遗传模型下均与慢性HBV感染风险无关(P>0.05),提示rs3775290在内蒙古鄂尔多斯地区汉族人群慢性HBV感染中不起主要作用。
本研究结果与黄霞梅等[9]研究结果不太一致,他们认为TLR3 基因rs3775290位点AA基因型可能是乙肝病毒相关性肝脏疾病的保护因素[9]。结果不太一致可能原因:①研究样本中人群所处的地理位置不同,生活环境不同。本研究样本来自中国北方鄂尔多斯地区汉族人群,而他们样本均来自中国南方的广西地区人群。②地理环境不同,HBV的基因型不同而有差异。HBV基因组全序列的差异大约等于8 %,可将HBV分为A ~ J 10个基因型,各基因型又可分为多个不同的亚型。不同地区流行的基因型不同,A型主要见于美洲和西欧,D型见于中东、北非和南欧,E型见于非洲,我国及亚洲其他地区流行的主要是B型和C型。我国北方以C型为主,南方以B型为主,偶尔有A型和D型的报道[2]。③两项研究CHB病例组的选择标准有差异。本研究选择乙肝血清学免疫指标均为HBsAg阳性患者,而黄霞梅团队的研究CHB病例组选择HBV-DNA检测阳性,血清丙氨酸转氨酶持续或反复升高的患者。④本研究样本偏少,还需扩大样本量深入研究,并且课题组正在继续研究TLR3基因的另外两个位点rs1879026、 rs5743309与慢性HBV感染的风险关系。
