死亡受体6在食管癌中表达及其与CCN1的关系研究*
2023-09-26常志恒柴建原刘晓芳
王 培,常志恒,柴建原,刘晓芳,马 欢,党 彤
(1.内蒙古科技大学包头医学院研究生院,内蒙古 包头 014040;2.内蒙古科技大学包头医学院第二附属医院)
食管癌早期临床症状缺乏特异性表现,大部分食管癌患者在疾病晚期才得到确诊,以致只能选择化疗、放疗的方法对肿瘤进行控制,但放化疗在杀伤肿瘤细胞的同时,也会损伤机体的正常组织。随着分子生物学技术不断发展,逐渐发现肿瘤细胞与正常细胞存在某些特异性基因、蛋白表达的改变,这些改变可能成为肿瘤靶向治疗的新靶点[1]。肿瘤靶向治疗可以选择性地杀伤肿瘤细胞,且较常规放化疗造成的毒副作用更小[2]。已有研究发现死亡受体家族很可能是肿瘤治疗的潜在靶点之一[3],而死亡受体6(death receptor 6, DR6)作为肿瘤坏死因子超家族(tumor necrosis factor family, TNF )中死亡受体亚家族的一员,在食管中的表达及生物学功能仍不明确。细胞基质蛋白CCN1可以增敏肿瘤坏死因子相关凋亡诱导配体( tumor necrosis factor related apoptosis inducing ligand,TRAIL)诱导食管腺癌的凋亡作用[4]。本研究拟通过分析DR6、CCN1在食管癌中的表达差异及二者的关系,以期明确CCN1是否可以调控死亡受体6的表达,从而为食管恶性肿瘤的治疗寻找到新的生物学靶点。
1 材料与方法
1.1材料
1.1.1细胞株 人食管癌细胞株KYSE150、OE-19购自盈湾生物技术公司,人食管上皮细胞HET-1A由首都医科大学中心实验室提供。
1.1.2免疫组化蜡块 收集2017~2020年内蒙古科技大学包头医学院第二附属医院确诊的食管癌患者7例,并选取患者术后食管鳞状细胞癌及相对应癌旁组织蜡块,且蜡块组织经病理学诊断为食管恶性肿瘤及无瘤组织。实验中选用组织蜡块,按照医学伦理学相关管理规定,并获得医院医学伦理学委员会的批准(LW-027)。
1.1.3主要试剂及耗材 RPMI1640培养基(美国Gibco公司);特级胎牛血清、胰蛋白酶(北京利维宁生物有限公司);双抗(HyClone公司);DR6 Rabbit Polyclonal Antibody(ORIGENE公司、赛默飞公司);CCN1 Rabbit Polyclonal Antibody、DR6 primer、GAPDH primer(ORIGENE公司);辣根酶标记山羊抗鼠IgG、辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);β-actin Mouse Monoclonal Antibody(Santa Cruz Biotechnology公司);Pierce BCA Protein Assay Kit、96孔板、Lipofectamine LTX® &PLUSTMReagent试剂盒(赛默飞世尔科技有限公司);细胞裂解液、Western一抗稀释液(碧云天生物技术公司);免疫组化试剂盒、EDTA抗原修复液(福州迈新生物技术公司);Trizol试剂盒(invitrogen);GEArray Kit(SABiosciences,Frederick,USA)。
1.1.4仪器 全自动数码凝胶成像系统、Mini-REOTEAN Tetra System、酶标仪imark(美国伯乐);CO2细胞培养箱(赛默飞世尔有限公司);金属干浴锅(中山大学达安基因股份有限公司)
1.2方法
1.2.1细胞培养 食管癌细胞株KYSE150、食管腺癌细胞株OE-19,均使用含10 %特级胎牛血清、1 %链霉素、青霉素的RPMI1640培养液培养;食管上皮细胞HET-1A使用KBM-2培养基,内含10 %特级胎牛血清,1 %链霉素、青霉素及多种细胞生长因子培养,于5 %CO2恒温恒湿无菌培养箱内培养,观察细胞生长状态良好,常规换液、胰蛋白酶传代。
1.2.2免疫组织化学 使用免疫组化试剂盒,检测同一食管鳞状细胞癌患者的癌旁组织及癌肿CCN1、DR6的表达。石蜡块-20 ℃降温10 min,切片机蜡块切片4 μm,烤片90 min,再快速浸入二甲苯脱蜡5 min,梯度乙醇水化,EDTA抗原修复液热修复20 min,内源性过氧化物酶阻断剂、非特异性染色阻断剂室温孵育10 min,抗体稀释液稀释抗体CCN1(1 ∶200)、DR6(1 ∶100),4 ℃过夜孵育;孵育盒室温复温30 min,PBS冲洗3次 × 10 min,孵育二抗,链霉菌抗生素蛋白-过氧化物酶孵育10 min,DAB显色、苏木素复染,盐酸乙醇分化,自来水返蓝,梯度乙醇透明,中性树脂封片。采用PBS阴性对照。
1.2.3蛋白质印迹法 食管正常上皮细胞HET-1A、食管肿瘤细胞0E-19、KYSE150,饥饿同步化后,给予刺激处理。含有蛋白酶抑制剂的RIPA裂解液提取总蛋白。冰面裂解30 min,4 ℃离心机15 000 r/min离心10 min;收集蛋白液,Pierce BCA Protein Assay Kit测定每组蛋白样的浓度,配置上样缓冲液,进行聚丙烯酰胺凝胶电泳,恒流转膜至PVDF膜,抗体稀释液稀释CCN1(1 ∶1 000)、DR6(1 ∶1 000)、β-actin(1 ∶500),4 ℃恒温摇床过夜。室温下二抗孵育PVDF膜,TBST洗膜,配制ECL发光液并于凝胶成像仪成像。
1.2.4Real-Time RT-PCR 使用Trizol 试剂盒,参考试剂盒使用说明提取总RNA,RNeasy试剂盒纯化RNA。使用反转录试剂盒以总mRNA作为模板反转录合成cDNA。反转录按照下列程序进行:25 ℃/10 min-55 ℃/30 min-85 ℃/5 min-4 ℃/∞,使用对应引物序列对DR6、GAPDH基因进行RT-PCR扩增,完成3次独立实验。数据分析使用ΔΔCt法:ΔΔCt=(食管癌细胞株DR6基因Ct-GAPDH基因Ct)-(食管上皮细胞DR6基因Ct-GAPDH基因Ct)。最后表达量=2(-ΔΔCt).。
DR6基因引物序列:
上游引物: 5′-CCAGTGCCATTGTGGAAAAGGC-3′
下游引物: 5′-CTTCCCACTTGGGCTGCTACAA-3′
1.2.5细胞瞬时转染 转染前培养细胞至对数生长期,传代至6孔板内过夜培养,镜下观察细胞状态良好,融合度达到80 %时,按照Lipofectamine® LTX &PLUSTMReagent试剂说明书进行细胞转染。为过表达CCN1,运用载有靶基因序列的pCMV6质粒和其空质粒转染目的细胞OE-19、HET1A。为了敲低CCN1的表达,通过采用载有特定shRNA序列的质粒转染细胞KYSE150。对照组细胞采用不含shRNA序列的空载质粒转染细胞。细胞转染48 h后提取细胞总蛋白,进行WB实验。
shRNA序列:5′-GCCCTTCTACAGGCTGTTCAA-3′
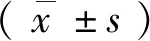
2 结果
2.1食管癌中死亡受体6 mRNA的表达 与食管上皮细胞相比,食管鳞状细胞癌、食管腺癌mRNA的表达量升高。现有研究尚不清楚DR6在食管癌肿中的表达情况及其与食管上皮正常组织、细胞的差异。本研究通过RT-PCR证实食管腺癌、鳞癌中DR6表达较食管正常上皮细胞升高(表1)。这两种不同亚型的食管肿瘤,其发病部位不同,对其基因和分子的分析显示,食管鳞癌实际上与头颈部鳞状细胞癌有着更多的共同特征,而食管腺癌更像胃腺癌[5],这些分子差异可能为肿瘤治疗提供新的靶点。

表1 死亡受体6 mRNA在食管癌与食管正常上皮中相对表达量(fold change,n=3, P<0.05)
2.2死亡受体6(DR6)在食管鳞癌中较食管正常上皮蛋白表达量升高 如前所述,通过RT-PCR证实了DR6在mRNA转录层面,在食管腺癌、鳞癌细胞中较食管上皮细胞表达上升。我们通过Western Blot分析DR6的蛋白表达情况,证实相较于食管正常上皮细胞(HET-1A),DR6的表达量在食管鳞状细胞癌(KYSE150)中升高(图1), 其结果与RT-PCR相一致;而在食管腺癌中未发现明显差异。同时,7例食管鳞癌患者免疫组化结果呈现出癌旁组织DR6染色较癌肿染色减低的趋势,染色部位主要位于细胞膜、细胞质,染色呈棕褐色(图2),且在食管鳞癌中过表达DR6后并未发现其诱导细胞的凋亡/坏死。这种肿瘤组织与正常组织基因表达的差异可能提示DR6表达参与食管鳞癌的发生、发展或可能是新的靶点。
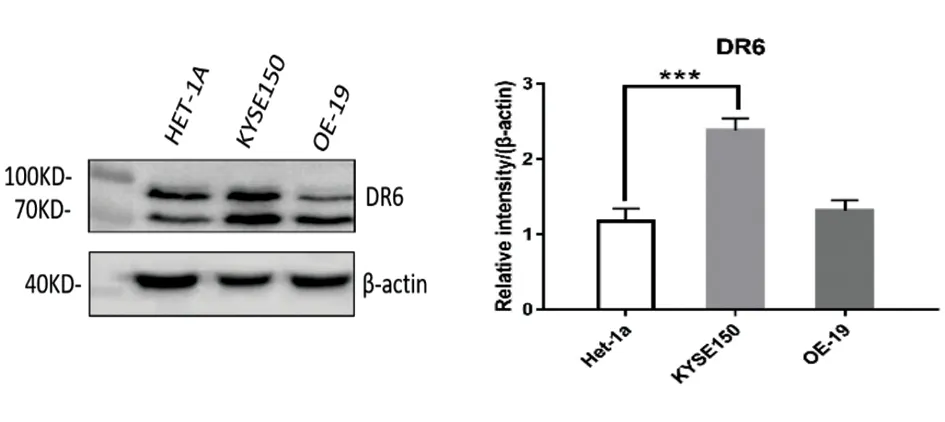
图1 DR6在食管上皮细胞HET-1A、食管鳞癌细胞KYSE150、食管腺癌细胞OE-19中的表达情况
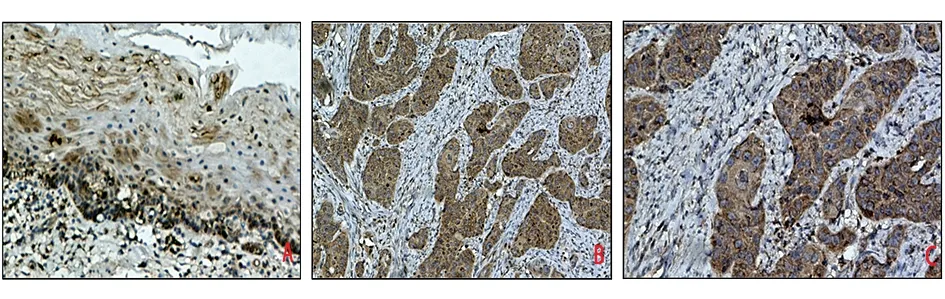
图2 DR6在食管癌旁组织及食管癌中的表达情况
2.3在食管肿瘤细胞中,CCN1促进了食管鳞癌和腺癌DR6的表达 研究发现,在食管腺癌细胞中过表达CCN1会引起细胞凋亡[4,6],这种凋亡是由于CCN1促进了DR5(death receptor 5)的表达。我们猜测,如同DR5,DR6也是死亡受体,其功能在食管癌中尚不清楚。那么,在食管肿瘤细胞中过表达CCN1会引起DR6表达变化吗?本研究首先检测了CCN1的表达,发现与食管正常上皮相比,CCN1在食管鳞状细胞癌细胞株中(KYSE150)中表达升高,在食管腺癌表达减低(图3)。同样在食管鳞癌组织免疫组化结果显示,7例食管癌患者中癌旁组织CCN1染色程度与癌瘤组织相比减低,细胞学与组织学结果相符(图4)。
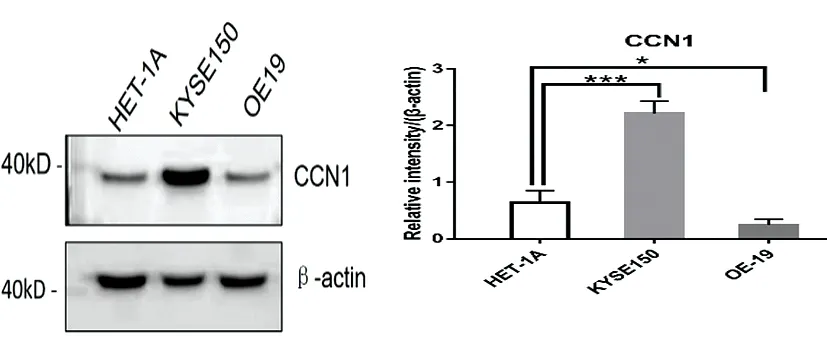
图3 CCN1在食管上皮细胞HET-1A、食管鳞癌细胞KYSE150、食管腺癌细胞OE-19中的表达情况

图4 CCN1在食管癌旁及食管鳞癌中的表达
分析所得结果发现,DR6和CCN1在食管癌肿中的表达呈相似的倾向。由此我们推测两种分子存在内部联系。在食管腺癌细胞株中过表达CCN1模型中,食管腺癌细胞株中DR6蛋白表达升高(图5),食管鳞癌中CCN1表达升高,为此建立CCN1敲低表达模型,显示DR6蛋白表达降低(图6)。
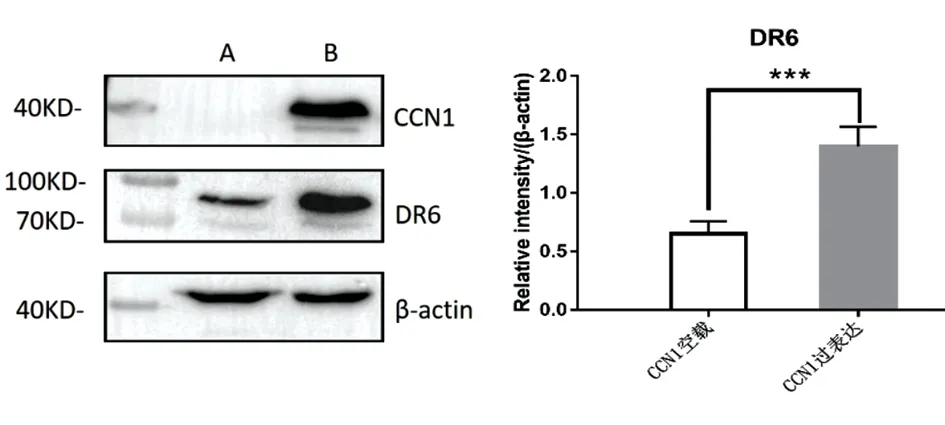
图5 食管腺癌细胞(0E-19)中CCN1对DR6的表达影响
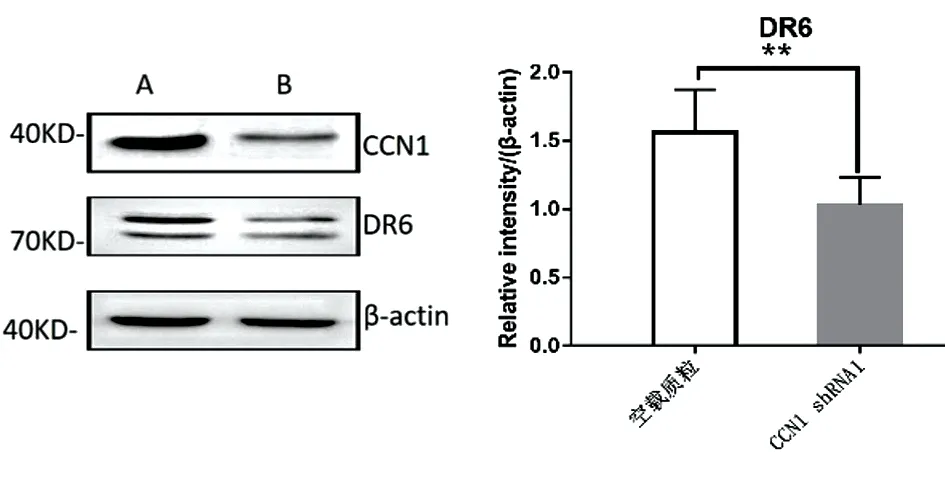
图6 食管鳞癌细胞(KYSE150)CCN1对DR6表达的影响
3 讨论
食管癌目前仍是全世界癌症相关死亡的重要原因之一。食管癌主要有食管鳞状细胞癌和食管腺癌两个组织学亚型,前者发病率约占90 %。虽然食管切除术仍然是食管癌治疗的主要手段,但因在早期症状缺乏特异性,很多患者诊断时错失手术时机,导致术后仍有很高的复发率和死亡率[7]。加之术后患者的消化道正常结构、功能的缺失,严重地降低了患者的生活质量[8]。此外,部分患者失去手术机会,只能选择传统的放化疗,但其会损伤正常组织。在人类与癌症的斗争中,寻找一种安全、有效的治疗方法至关重要。诱导癌细胞凋亡是可供选择的方法之一,因为靶细胞特异性蛋白的表达可以使凋亡具有高选择性,对邻近组织干扰较小,从而使生物体保持内环境稳定和良好的生命周期[9-10],因此寻找正常组织与病变组织特异性蛋白表达变化作为靶点,一直是疾病研究的热门。
死亡受体6(DR6)广泛表达在多种组织细胞中,因含有胞内死亡结构域(death domain,DD),被归为死亡受体亚家族。DR6在细胞转录因子的激活、凋亡和免疫反应中起着重要作用[11]。DR6既可以通过死亡结构(DD)诱导细胞凋亡,也可激活NF-κB、JNK促细胞存活[11-12]。DR6在许多肿瘤细胞系和临床肿瘤样本中高度表达。据报道DR6在卵巢癌、前列腺癌、成人肉瘤、神经胶质瘤中表达升高[12-14]。DR6作为一种膜蛋白,其膜外片段可被基质金属蛋白酶切割并释放至胞外,可从血清中被检测到。在对部分成人肉瘤患者血清学检测中,发现DR6的表达较无病健康对照组患者升高,并且在评估脂肪肉瘤治疗前后DR6水平,发现处于稳定期的病人较进展期病人DR6表达水平显著下降[14]。在关于神经胶质瘤的研究中,DR6表达水平与肿瘤分期呈正相关[13]。这些研究都在提示DR6是肿瘤潜在的分子标志物,但在食管组织中DR6的表达尚未得到重视。本研究中,食管鳞癌细胞DR6的表达,在mRNA转录、蛋白翻译水平均较食管正常上皮细胞升高;而在食管腺癌细胞中,在mRNA转录水平较食管正常上皮细胞升高,而在蛋白翻译水平蛋白表达并没有升高,推测其可能原因与mRNA翻译蛋白过程中调控相关。DR6在食管鳞癌中的转录、翻译表达较正常上皮有上升的趋势,这种特异的蛋白分子差异,提示DR6可能是食管鳞癌潜在的诊断、预后分子标志物。
本实验发现,在食管癌肿中,与正常上皮细胞相比,CCN1在食管腺癌中表达减低,在食管鳞癌中表达升高。研究发现,超表达CCN1可以通过调控肿瘤坏死因子相关配体(TRAIL)及DR5的表达,诱导腺癌细胞凋亡[5-6]。同是死亡受体家族的DR6,CCN1能否影响DR6的表达和功能?为此本研究通过强制表达CCN1转染实验,证实了CCN1确实可以影响DR6的表达。且在食管两种亚型的肿瘤细胞中证实,CCN1促进了DR6的表达。我们的研究为阐明DR6、CCN1的信号通路提供一定的参考。在另一项研究中证实CCN1在食管鳞状细胞癌高表达促进肿瘤存活并增加其侵袭性[15]。本实验结果显示,CCN1促进死亡受体DR6的表达,且DR6在食管鳞癌中的表达较正常细胞组织上升。分析结果后发现DR6在食管鳞癌中可能是利于肿瘤发展的,此结果与死亡家族特有促凋亡的生物学功能相矛盾,但正如前述,DR6因包含死亡结构域(DD),属于死亡受体亚家族,且DD是诱导细胞死亡的重要组成部分,没有DD无法实现诱导细胞死亡的功能,但这并不是绝对的,因为DR6的死亡结构域也是其激活NF-κB和JNK、促细胞存活所必需的。除此之外,DR6作为膜受体,目前其配体尚不明确,对阐明其功能造成很大的困扰。
本研究为一阶段性总结,存在着许多不足之处,如免疫组化样本量不足(7例),未能与临床肿瘤分期分型相结合,同时未阐明死亡受体6在食管癌中的生物学功能。后续将通过扩大组织样本量、动物实验等研究方法探讨死亡受体6在食管癌中的生物学功能,以及细胞基质蛋白CCN1调控死亡受体6表达的信号通路。
