头孢哌酮钠舒巴坦钠联合喹诺酮类抗菌药物对肝炎合并胆道感染患者肝纤维化的影响研究
2023-08-07张秀传
张秀传
肝炎是一种常见病、多发病, 胆道感染是肝炎的常见并发症之一, 约占肝炎并发症的22.4%, 了解胆道感染病原体及耐药情况, 对选择针对抗病原体药物, 控制胆道感染起到非常重要的作用[1]。头孢哌酮钠舒巴坦钠由两种物质组成, 其中头孢哌酮是头孢菌素类的抗菌药物, 属于第三代, 能够治疗细菌感染, 并且对敏感菌效果较好[2]。舒巴坦是一种β 内酰胺酶抑制剂,因为有较多细菌对头孢菌素类抗菌药物耐药, 其耐药机制是分泌β 内酰胺酶将头孢哌酮分解掉, 所以药物中加入舒巴坦, 能够抑制β 内酰胺酶, 从而使头孢哌酮耐药的细菌不再耐药, 进而将其杀灭, 产生协同效果[3,4]。喹诺酮类抗菌药物是指含有4-喹诺酮类母核的合成抗菌药物, 属于静止期杀菌剂, 具有抗菌谱广、抗菌力强、组织浓度高、口服吸收好、与其他常用抗菌药无交叉耐药性、抗菌后效应较长等特点[5]。因此,本文旨在研究头孢哌酮钠舒巴坦钠联合环丙沙星治疗肝炎合并胆道感染患者对其肝纤维化指标的影响。
1 资料与方法
1.1 一般资料 选取2020 年4 月~2021 年4 月在本院初次就诊的肝炎合并胆道感染患者100 例作为研究对象, 年龄40~85 岁;男47 例, 女53 例;病程0.5~5 年, 体质量指数20~30 kg/m2, 根据治疗方法的不同分为对照组和联合组, 各50 例。两组患者年龄、性别、病程、体质量指数、收缩压、舒张压等一般资料比较,差异无统计学意义(P>0.05), 具有可比性。见表1。本文研究患者及其家属均知情, 签署知情通知书, 并且经过本院伦理委员会批准。
表1 两组患者一般资料比较( ±s, n)
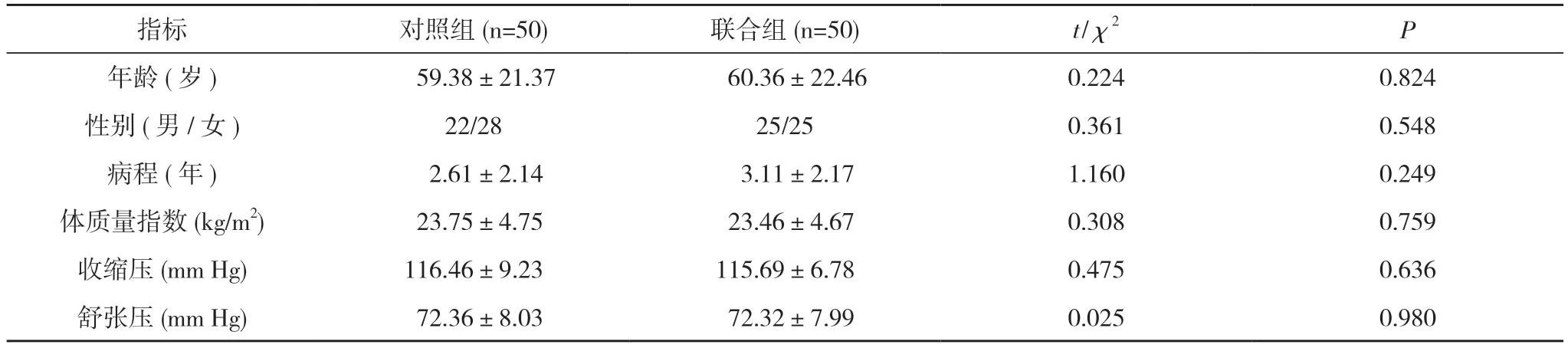
表1 两组患者一般资料比较( ±s, n)
注:两组比较, P>0.05;1 mm Hg=0.133 kPa
指标 对照组(n=50) 联合组(n=50) t/χ2 P年龄(岁) 59.38±21.37 60.36±22.46 0.224 0.824性别(男/女) 22/28 25/25 0.361 0.548病程(年) 2.61±2.14 3.11±2.17 1.160 0.249体质量指数(kg/m2) 23.75±4.75 23.46±4.67 0.308 0.759收缩压(mm Hg) 116.46±9.23 115.69±6.78 0.475 0.636舒张压(mm Hg) 72.36±8.03 72.32±7.99 0.025 0.980
1.2 纳入及排除标准 纳入标准:均符合《慢性乙型肝炎基层诊疗指南》[6]中关于慢性乙型肝炎的诊断标准;符合《急性胆道系统感染的诊断和治疗指南》[7]中关于胆道感染的诊断标准;无其他感染性疾病。排除标准:使用抗病毒药物或免疫抑制剂患者;合并肝癌或病情危重者;病历资料不详者。
1.3 治疗方法 药物来源:注射用头孢哌酮钠舒巴坦钠(齐鲁制药有限公司, 国药准字H20043200, 规格:1 g/支)。环丙沙星(Bayer Vital GmbH, 国药准字BX20010011, 规格:500 mg/片)。
两组患者均进行保肝以及抗菌等基础治疗。对照组给予环丙沙星口服治疗, 1 g/次, 2 次/d。联合组在对照组基础上联合头孢哌酮钠舒巴坦钠进行治疗,50 ml 的5%葡萄糖注射液稀释头孢哌酮钠舒巴坦钠后静脉滴注治疗, 2 g/次, 1 次/d。两组均连续治疗28 d。1.4 观察指标及判定标准 比较两组患者治疗前后肝功能指标(ALT、AST、GGT、TBil), 治疗前后肝纤维化指标(HA、LN、PCⅢ), 治疗前后炎性指标(IL-6、TNF-α、PCT), 治疗效果, 治疗后不良反应发生情况。
1.4.1 肝功能指标及肝纤维化指标检测 采集患者治疗前、治疗后28 d 的清晨空腹肘部静脉血3 ml,2000 r/min 离心处理5 min(离心半径为13.5 cm), -20℃保持。采用博科BK-400 全自动生化检测仪检测肝功能指标ALT、AST、GGT、TBil。采用放射免疫法测定肝纤维化指标HA、LN、PCⅢ, 试剂盒由上海生物科学技术有限公司提供, 操作时, 严格按照试剂盒说明书进行。
1.4.2 炎性指标检测 采用酶联免疫吸附法(ELISA)检测:将提前稀释好的血液标本100 μl 加入相应的微孔板反应空中, 第1 孔只加样品稀释液为零孔, 混合均匀, 在37℃下处理90 min, 甩去孔内液体, 吸干水分;将提前制备的抗体滴加0.1 ml/孔, 在37℃下处理60 min, 空白孔不加底物四甲基联苯胺(TMB);甩去孔内液体, 加满0.01 M 磷酸缓冲液(PBS)/孔, 浸泡1~2 min, 甩去孔内液体, 吸干水分;每孔中滴加90 μl TMB 反应, 避光20 min;再次滴加90 μl TMB 终止反应。在波长450 mm 处分析IL-6、TNF-α 水平。PCT 采用双抗体夹心法检测:PCT 抗体包被微孔板, 制成固相抗体, 往包被单抗的微孔中依次加入PCT, 再与辣根过氧化物酶(HRP)标记的PCT 抗体结合后形成抗体-抗原-酶标抗体复合物, 经过洗涤后加底物TMB 显色。TMB 在HRP 酶的催化下转化成蓝色, 最终在酸的作用下转化成黄色。颜色深浅与样品中的PCT 呈正相关。采用酶标仪在450 mm 波长下的吸光度(OD 值), 通过标准曲线计算样品中人PCT 浓度。
1.4.3 疗效评定标准[8]以肝功能、肝纤维化、炎性指标进行综合评定疗效。显效:治疗28 d 后, 各项指标达到正常;好转:治疗28 d 后, 炎性指标显著改善, 有些肝纤维化情况发生;无效:治疗前后无变化,症状并未得到改善。总有效率=显效率+好转率。
1.4.4 不良反应发生情况 不良反应包括疲乏、纳差、腹胀、胆囊区压痛。
1.5 统计学方法 采用SPSS25.0 统计学软件对数据进行处理。计量资料以均数±标准差(±s)表示,采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者治疗前后肝功能指标比较 治疗前,两组ALT、AST、GGT、TBil 比较差异无统计学意义(P>0.05);治疗后, 两组患者ALT、AST、GGT、TBil均低于本组治疗前, 且联合组ALT、AST、GGT、TBil均低于对照组, 差异具有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后肝功能指标比较( ±s)
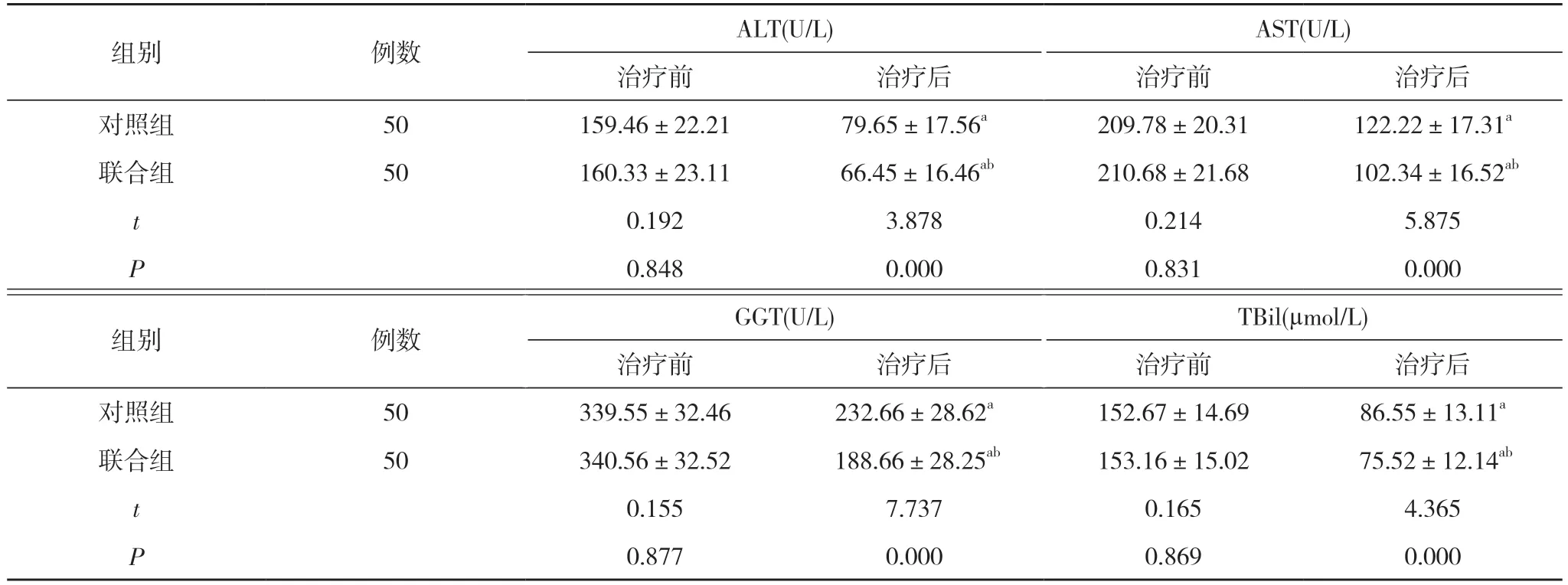
表2 两组患者治疗前后肝功能指标比较( ±s)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 ALT(U/L) AST(U/L)治疗前 治疗后 治疗前 治疗后对照组 50 159.46±22.21 79.65±17.56a 209.78±20.31 122.22±17.31a联合组 50 160.33±23.11 66.45±16.46ab 210.68±21.68 102.34±16.52ab t 0.192 3.878 0.214 5.875 P 0.848 0.000 0.831 0.000组别 例数 GGT(U/L) TBil(µmol/L)治疗前 治疗后 治疗前 治疗后对照组 50 339.55±32.46 232.66±28.62a 152.67±14.69 86.55±13.11a联合组 50 340.56±32.52 188.66±28.25ab 153.16±15.02 75.52±12.14ab t 0.155 7.737 0.165 4.365 P 0.877 0.000 0.869 0.000
2.2 两组患者治疗前后肝纤维化指标比较 治疗前,两组HA、LN、PCⅢ比较差异无统计学意义(P>0.05);治疗后, 两组患者HA、LN、PCⅢ均低于本组治疗前,且联合组HA、LN、PCⅢ均低于对照组, 差异具有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后肝纤维化指标比较( ±s)
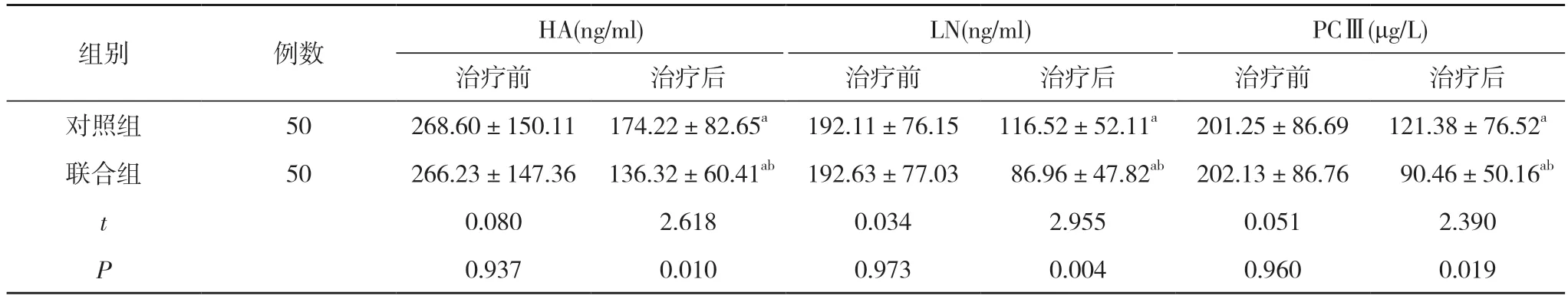
表3 两组患者治疗前后肝纤维化指标比较( ±s)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 HA(ng/ml) LN(ng/ml) PCⅢ(μg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 50 268.60±150.11 174.22±82.65a 192.11±76.15 116.52±52.11a 201.25±86.69 121.38±76.52a联合组 50 266.23±147.36 136.32±60.41ab 192.63±77.03 86.96±47.82ab 202.13±86.76 90.46±50.16ab t 0.080 2.618 0.034 2.955 0.051 2.390 P 0.937 0.010 0.973 0.004 0.960 0.019
2.3 两组患者治疗前后炎性指标比较 治疗前, 两组IL-6、TNF-α、PCT 比较差异无统计学意义(P>0.05);治疗后, 两组患者IL-6、TNF-α、PCT 均低于本组治疗前, 且联合组IL-6、TNF-α、PCT 均低于对照组,差异具有统计学意义(P<0.05)。见表4。
表4 两组患者治疗前后炎性指标比较( ±s)
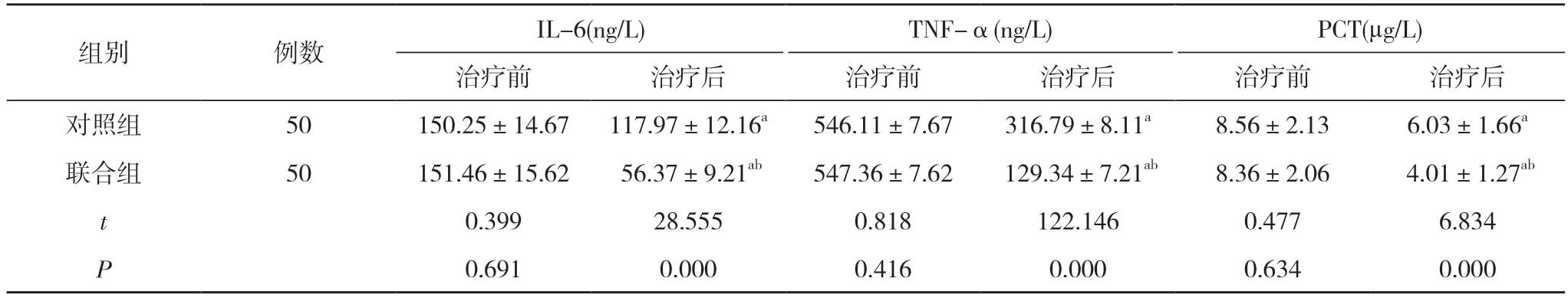
表4 两组患者治疗前后炎性指标比较( ±s)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 IL-6(ng/L) TNF-α(ng/L) PCT(µg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 50 150.25±14.67 117.97±12.16a 546.11±7.67 316.79±8.11a 8.56±2.13 6.03±1.66a联合组 50 151.46±15.62 56.37±9.21ab 547.36±7.62 129.34±7.21ab 8.36±2.06 4.01±1.27ab t 0.399 28.555 0.818 122.146 0.477 6.834 P 0.691 0.000 0.416 0.000 0.634 0.000
2.4 两组患者治疗效果比较 联合组患者的治疗总有效率显著高于对照组, 差异具有统计学意义(P<0.05)。见表5。
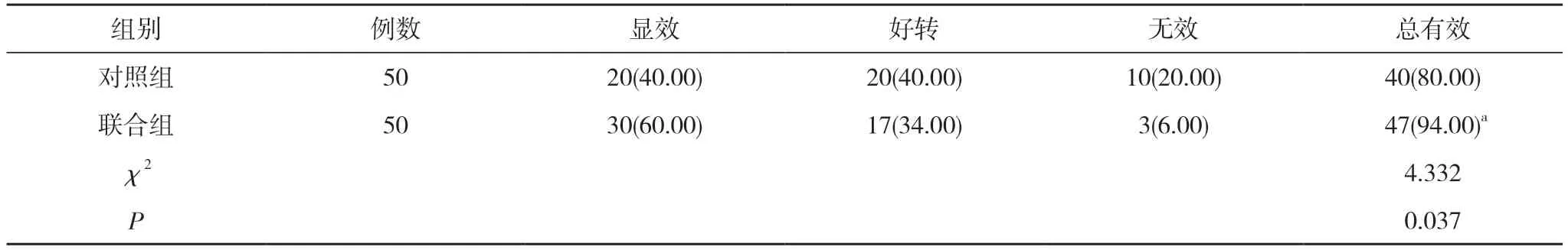
表5 两组患者治疗效果比较[n(%)]
2.5 两组患者治疗后不良反应发生情况比较 两组患者治疗后的不良反应发生率比较差异无统计学意义(P>0.05)。见表6。

表6 两组患者治疗后不良反应发生情况比较[n(%)]
3 讨论
肝炎由于大量肝细胞坏死, 肝脏细胞数量明显减少, 吞噬功能降低, 补体合成严重不足, 机体抗感染的能力显著下降;另外由于肝炎患者胆汁分泌不足, 胆汁成分改变, 胆管和胆囊上皮抵抗力下降易导致胆道感染。及时了解胆道感染的病原体分布及药敏谱, 可以为治疗和控制胆道感染、合理应用抗菌药物提供理论依据。头孢哌酮钠舒巴坦钠是一种较为常见的抗菌药物, 其具有抗菌谱广、药物效能高、毒性较低等特点[9]。喹诺酮类抗菌药物是一种合成抗菌药, 包括环丙沙星, 具有口服吸收快的特点, 该类药物的血药浓度在体内可以保持较长时间, 根据浓度大小分别可以起到抑制细菌、杀死细菌的作用[10]。
头孢哌酮钠舒巴坦钠联合环丙沙星的杀菌作用强,具有很强的渗透性, 可以很快地分布在各个需要的器官内, 可以最大程度治疗肝功能及胆道感染, 能够有效的抑制肝部及胆道感染的病原菌繁殖, 从而缓解患者的症状[11]。本文研究指出, 头孢哌酮钠舒巴坦钠联合环丙沙星可以降低患者的ALT、AST、GGT、TBil 水平,改善患者的肝功能。
肝脏是摄取和降解HA 的主要场所, HA 由间质细胞合成、分泌, 经淋巴系统入血, 其代谢绝大部分由肝脏内皮细胞完成, 慢性肝病由枯否细胞合成HA 增加, 内皮细胞受损, 数量减少及门脉短路, 对HA 降解不足, 以致HA 水平升高[12]。HA、LN、PCⅢ是评估肝纤维化程度的有效指标[13]。有研究指出[14], 头孢哌酮钠舒巴坦钠联合环丙沙星可以降低患者的血液粘稠度, 对患者肝损伤具有保护作用, 有利于肝细胞的再生和修复, 达到抗肝纤维化的作用。本文研究证明,头孢哌酮钠舒巴坦钠联合环丙沙星可降低HA、LN、PCⅢ水平, 具有抗肝纤维化的作用。
TNF-α 是炎症反应的启动介质, 介导胆道局部和全身炎症反应[15]。研究显示[16], 肝炎合并胆道感染时可释放大量TNF-α, 它可参与诱导IL-6、PCT 及自身基因表达, 造成细胞因子及炎症介质大量释放, 引起肝炎合并胆道感染更进一步扩展。重要的促炎细胞因子IL-6、TNF-α、PCT 必定参与肝炎合并胆道感染的发生及发展。本文研究发现, 头孢哌酮钠舒巴坦钠联合环丙沙星能够降低IL-6、TNF-α、PCT 水平, 并减少炎性因子的释放。本文研究结果表明, 头孢哌酮钠舒巴坦钠联合环丙沙星可以清除患者体内的炎性因子且能避免肝部造成损害, 改善免疫系统紊乱, 可使患者的症状改善, 安全性较高, 具有积极的意义[17-20]。
综上所述, 头孢哌酮钠舒巴坦钠联合环丙沙星治疗肝炎合并胆道感染, 能够有效地降低患者IL-6、TNF-α、PCT 水平, 改善患者肝功能、肝纤维化, 提高治疗效果, 值得推广应用。
