挤压组织化对芝麻蛋白理化性质及结构的影响
2023-01-13黄纪念张富重宋国辉张国治
黄纪念,孙 强, ,张富重,宋国辉,张国治
(1.河南省农业科学院农副产品加工研究中心,河南郑州 450002;2.河南省农科院农副产品加工研究所,河南郑州 450002;3.河南工业大学粮油食品学院,河南郑州 450001)
蛋白质是人类生存必需的营养物质,人们每天摄入的蛋白质主要为动物性蛋白和植物性蛋白两大类[1]。随着社会的不断进步,人们对健康饮食的要求越来越高。从口感上来说,动物性蛋白是植物性蛋白所不能比拟的[2-5],这是植物性蛋白无法取代动物性蛋白的问题所在。但动物蛋白中含有大量的胆固醇,食用过多会影响机体健康,不仅会引起“三高”和肥胖等疾病,还易造成饮食结构紊乱等危害。据Kumer等[2]统计,生产动物肉类需消耗接近其七倍的植物资源,以及非常多的水资源,环境资源压力大。植物蛋白挤压组织化为解决这些问题提供了可行的方案[6]。植物组织化蛋白是一种具有纤维结构和类似动物蛋白口感的高蛋白产品,在食品加工中可以替代部分动物蛋白,以此达到降低食品中脂肪和胆固醇含量的目的[7-8]。Samard等[9]研究发现,植物蛋白挤压组织化后在咀嚼性、氮溶解度和剪切力等方面接近于真实的鸡肉。目前市场上的植物组织化蛋白主要以大豆蛋白、小麦蛋白和花生蛋白为主,关于芝麻蛋白的未见有相关报道。
挤压组织化是一个短时处理的过程,蛋白原料在此期间受到高温、高压和高剪切力的作用,原料中蛋白质会发生变性,导致结构改变,进一步影响其理化性质[10-11]。原料水分含量的高低直接影响组织化程度,一般把原料水分含量在40%~80%的挤压过程叫作高水分挤压,也是生产替代动物蛋白的植物蛋白挤压组织化的主要方式[12]。本实验以利用亚临界萃取方法脱除油脂而得到的亚临界芝麻蛋白粉为主要原料,利用双螺杆挤压技术,生产组织化蛋白,并对挤压组织化前后蛋白原料的理化性质和结构进行了研究,分析挤压组织化对蛋白原料理化性质和结构的影响,探究其组织化形成机理,为以后的深入研究奠定基础。
1 材料与方法
1.1 材料与仪器
亚临界芝麻蛋白粉 自制;谷朊粉 中纺汇泽生物科技有限公司;胃蛋白酶(酶活≥250 U·mg-1)、胰蛋白酶(酶活1:250) 北京索莱宝科技有限公司;5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、盐酸胍、Tris Sigma公司;硫酸铜、硫酸钾、氢氧化钾、磷酸氢二钠、磷酸二氢钠、无水乙醚 分析纯,天津市天力化学试剂有限公司;浓硫酸、氢氧化钠、硼酸、无水乙醇 分析纯,国药集团化学试剂有限公司。
CLEXTRAL Ev025型双螺杆挤压机 法国克莱斯特罗集团公司;CEB-5L亚临界流体萃取设备河南省亚临界生物技术有限公司;K-1100型全自动凯氏定氮仪 山东海能科学仪器有限公司;S433D型氨基酸分析仪 德国SYKNM公司;JSM-5310型扫描电子显微镜 日本电子株式会社;UV-2802型紫外可见分光光度计 梅特勒托利多仪器有限公司;is5型傅里叶红外光谱 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 亚临界芝麻蛋白粉的制备 参照刘日斌[13]的亚临界芝麻粕的制备工艺并稍加修改,具体工艺为:萃取温度50 ℃,萃取时间40 min,料液比1:1.5(萃取溶剂为丙烷),萃取次数5次,将得到的亚临界芝麻粕进行粉碎过80目筛即得到亚临界芝麻蛋白粉。
1.2.2 原料理化性质的测定 水分的测定:GB 5009.3-2016;灰分的测定:GB 5009.4-2016;粗蛋白含量的测定:GB 5009.5-2016;粗脂肪含量的测定:GB 5009.6-2016;粗纤维含量的测定:GB/T 5009.10-2003;NSI的测定:AACC 46-23。
1.2.3 挤压组织化实验的设计 将亚临界芝麻蛋白粉与谷朊粉以7:3的比例混合,利用双螺杆挤压机参照挤压组织化工艺:喂料速度2 kg/h,挤压温度160 ℃,水分含量65%,螺杆转速190 r/min进行组织化蛋白的生产。
1.2.4 持水性的测定 将样品冷冻干燥,粉碎过筛后,参考薛晓程等[14]的方法进行持水性测定。称取3.0 g左右样品,倒入到离心管中,加入18 mL蒸馏水,混合均匀后,静置0.5 h,然后离心,将上清液倒掉,最后称重。
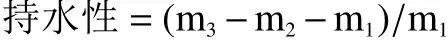
式中:m1为样品质量,g;m2为离心管质量,g;m3为称重的质量,g。
1.2.5 吸油性的测定 将样品冷冻干燥,粉碎过筛后,参考Li等[15]的吸油性测定方法进行测定,并稍作修改。称取0.3 g左右的样品,倒入到离心管中,加入5 mL芝麻油,混合均匀后,静置0.5 h后,离心处理,将上清液倒掉,最后称重。公式为:
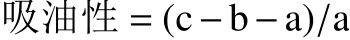
式中:a为样品质量,g;b为离心管质量,g;c为离心去上清后离心管的总质量,g。
1.2.6 蛋白质消化率的测定 样品经冷冻干燥,粉碎处理后,参考刘文华等[16]的蛋白消化率的测定方法进行测定。准确称量1.00 g样品加入到250 mL锥形瓶中,加入pH为1.5的盐酸80 mL配成溶液,设置空白组。加入0.01 g胃蛋白酶于39 ℃下在水浴恒温振荡器中酶解3 h,然后调节溶液pH为6.8,加入0.5 g的胰蛋白酶相同条件下酶解3 h,最后离心处理得到上清液。蛋白含量利用全自动凯氏定氮仪进行测定。
目前,在人体中一共发现了22种炎症体[26],常见的包括NLRP1、NLRP2、NLRP3、NLRP6、NLRP10和NLRP12等[27]。不同类型的NLRPs的激活组装形式不尽相同,所起到作用也不尽相同。
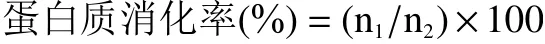
式中:n1为消化后上清液的蛋白含量;n2为样品粗蛋白含量。
1.2.7 游离巯基的测定 样品经冷冻干燥,粉碎过筛处理后参考Fischert[17]的游离巯基含量测定方法进行测定。首先取240 mg左右的样品于离心管中,然后取10 mL 5 mol/L,pH8.0的盐酸胍/Tris-Gly溶液加到离心管中,混合搅拌后离心,然后在上清液中各取3 mL于烧杯中,一个烧杯中加入5 mL盐酸胍/Tris-Gly溶液,另一个烧杯中加入1.5 mL 1×10-3mol/L DTNB,混合均匀后在水浴加热处理0.5 h,最后在412 nm处测定吸光值,以不加DTNB的为对照组。

式中:73.53=106/13600(13600为Elman试剂与巯基反应生成物5-硫代-2-硝基苯甲酸(盐)阴离子的摩尔消光系数,单位为L/mol系数;106为L/mol换算为L/μmol的倍数);D为稀释倍数;C为蛋白质浓度(g/L)。
1.2.8 氨基酸含量的测定 参照GB 5009.124-2016方法进行测定
1.2.9 蛋白质溶解度的测定 参照Prudencio-Ferreira等[18]的方法,通过蛋白质溶解度的变化来观察蛋白质中化学键的变化。
浸提溶液:A溶液为pH7.6,0.035 mol/L磷酸盐缓冲液,B溶液为pH7.6,A+0.015 g/mL SDS,C溶液为pH7.6,A+2% 2-巯基乙醇,D溶液为A+pH7.6,0.015 g/mL SDS+2% 2-巯基乙醇。
蛋白浸提步骤:参考马宁等[19]的操作方法。各取0.5 g样品于离心管中,分别加入适量的A、B、C、D溶液,在室温下,振荡提取120 min,然后离心,取上清液。对所得沉淀重复上述操作,最后将两次上清液混到一块,定容到50 mL,得到便是蛋白质浸提溶液。蛋白质溶解度为上清液中蛋白质含量与总蛋白含量之比。
a.溶于A溶液中的为可溶性蛋白质;
b.溶于B溶液中的蛋白减去溶于A溶液中的蛋白为以非共价键结合的蛋白质;
c.溶于C溶液中的蛋白减去溶于A溶液中的蛋白为以共价键结合的蛋白质;
d.溶于D溶液中的蛋白与溶于A溶液中的蛋白之和减去溶于B溶液和C溶液之和得到为以非共价键与二硫键交互作用结合的蛋白质。
1.2.10 热分解特性的测定 称取少量冷冻干燥后的粉末于铝盘中,放入热重分析仪中进行测定。测定条件为:以10 ℃/min的速率从室温开始加热到600 ℃,在此过程中,N2以50 mL/min的流速做为保护气。
1.2.11 傅里叶红外光谱测定 样品经过冷冻干燥处理后,粉粹过筛,取1 mg样品与200 mg KBr粉末混合,充分研磨,在15 kg压力下压制成薄片。在波数范围为4000~400 cm-1内进行扫描。
扫描图谱的处理:测定样品前先测定空白背景,然后把酰胺I带分离出来,利用Excel 2016和Origin 2018对其进行去卷积、二阶导数和谱带拟合处理,不同子峰的面积代表不同的二级结构。
1.2.12 微观结构的测定 参照Dekkers等[21]方法将样品切成5 mm×5 mm×5 mm的块状,用4%的戊二醛浸泡,在4 ℃的环境中固定样品24 h,之后使用0.1 mol/L,pH为8的磷酸盐缓冲液冲洗,再分别用不同体积分数的乙醇溶液进行脱水处理,脱水后用真空冷冻机干燥,之后进行粘样,抽真空,最后在扫描电镜下观察微观结构的变化,并拍照。
1.3 数据处理
实验平行测定3次,数据结果取平均值±标准方差。采用SPSS 25.0软件对实验数据进行统计处理,利用Origin 2018软件绘图。
2 结果与分析
2.1 原料的基本性质
挤压组织化对蛋白原料要求比较严格,一般要求脂肪含量低于5%,粗纤维含量小于7%。亚临界芝麻蛋白粉和谷朊粉的脂肪含量为2.26%和2.11%,粗纤维含量为3.90%和0.62%,均符合要求。主要理化指标含量见表1。

表1 蛋白粉的基本理化指标Table 1 Basic physicochemical indexes of protein powder
2.2 挤压组织化对蛋白原料理化特性的影响
从表2可以看出挤压组织化对原料的持水性、吸油性、蛋白质消化率和游离巯基含量都有一定程度的影响。挤压后的蛋白原料持水性增加了14.16%,吸油性减少了14.52%,原因可能是挤压组织化后,原料蛋白质发生变性,结构改变,更多亲水氨基酸暴露出来,同时结构重排形成纤维结构,变得相对稀松,导致持水性增大、吸油性下降。蛋白质消化率相对于挤压前增加了11.18%,原因可能是原料中蛋白质在挤压组织化过程中发生变性,空间结构遭到破坏,分子内部的氨基酸残基暴露出来和组织化蛋白独特的稀松的结构,增大了与蛋白酶的接触面积,导致蛋白消化率增大。挤压后的游离巯基含量相对于挤压前的减少了11.55%,原因可能是在挤压组织化过程中,蛋白质中的含硫氨基酸和游离巯基在高温、高剪切力、高压条件下发生热分解生成噻唑类、噻吩类、乙醛等含硫化合物,损失了一部分[22],或者是氧化生成二硫键造成的。
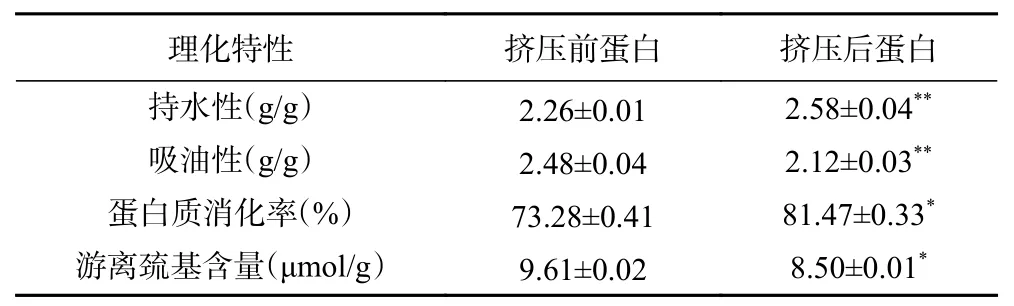
表2 蛋白原料挤压前后持水性、吸油性、消化率和游离巯基含量的变化Table 2 Changes of water holding capacity, oil absorption,digestibility and free sulfhydryl content of protein materials before and after extrusion
2.3 挤压组织化对蛋白原料氮溶解指数的影响
2.3.1 水分含量对蛋白原料的氮溶解指数的影响从图1可以看出随着水分含量的增加,氮溶解指数先减少再增加然后又降低。在水分含量为50%时最大为14.4%,在水分含量为60%时最小为10.63%。在水分含量为65%时略有上升。原因可能是在挤压过程中水分参与蛋白组织化过程中的化学反应并影响挤压机内的压力和温度,从而影响蛋白的组织化程度,随着水分含量的增加,一方面蛋白伸展变性程度增加,天然状态的蛋白质明显减少,另一方面组织化程度逐渐升高[23-24],水分含量为60%时蛋白伸展变性程度最大,氮溶解指数最低;水分含量为65%时,组织化程度达到最大,纤维结构最多,原有结构变化最大,氨基酸残基解离出来较多,造成了氮溶解指数有所升高。继续增加水分则稀释弱化了组织化结构的形成,使得氮溶解指数降低。
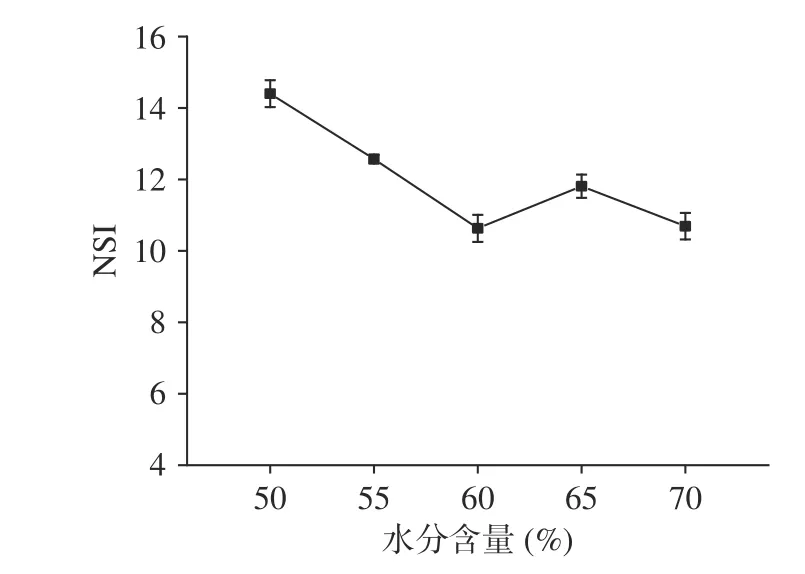
图1 不同水分含量对蛋白原料的氮溶解指数的影响Fig.1 Effect of different moisture content on the nitrogen solubility index of protein raw materials
2.3.2 挤压温度对蛋白原料的氮溶解指数的影响温度是影响组织化蛋白产品质量的关键因素,组织化的形成是以蛋白质变性为前提的。从图2可以看出氮溶解指数随着挤压温度的升高,呈现先降低后升高的趋势。在130 ℃时氮溶解指数降到最低,说明此时蛋白质变性程度最大,但由于需要更高的温度来断裂蛋白质分子中的二硫键并进行定向排列形成蛋白组织化,然后随着挤压温度的升高,挤压产品组织化程度逐渐加强,解离出来一些小分子物质或氨基酸残基增多,造成了氮溶解指数逐渐增大。
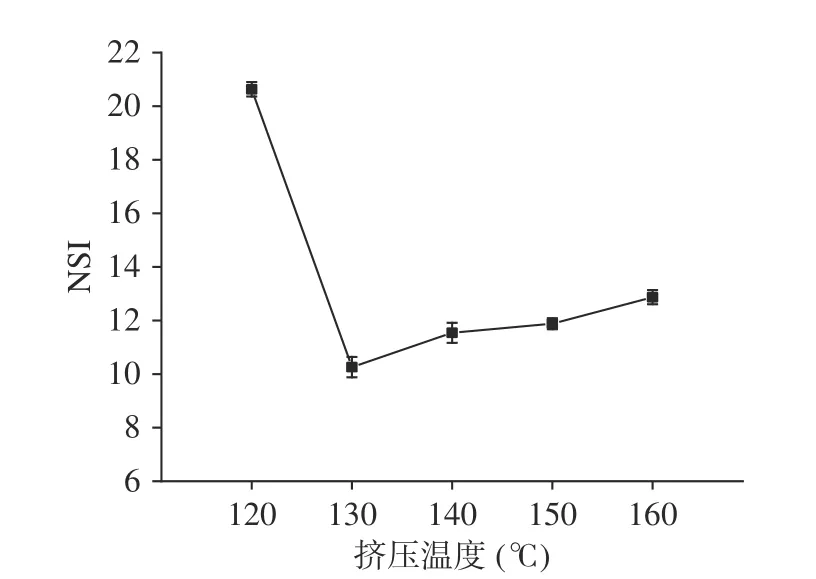
图2 不同挤压温度对蛋白原料的氮溶解指数的影响Fig.2 Effect of different extrusion temperatures on the nitrogen solubility index of protein materials
2.3.3 螺杆转速对蛋白原料的氮溶解指数的影响螺杆转速对挤压组织化有两方面的影响,一是随着螺杆转速的升高,剪切强度逐渐增大,蛋白质变性程度会升高;二是螺杆转速的升高缩短了物料滞留时间,蛋白质变性的时间也相应地缩短,从而导致变性程度降低。从图3可以看出氮溶解指数随着螺杆转速的增大,先降低后增大。在190 r/min时降到最低,然后再增加其螺杆转速,氮溶解指数随之上升。说明螺杆转速在180~190 r/min阶段剪切强度对蛋白质变性程度的影响占主导地位,继续增大螺杆转速物料滞留时间对蛋白质变性程度的影响逐渐占主导地位,物料在机筒中受到温度、压力和剪切力的作用时间变短,从而使变性程度减轻,氮溶解指数有所回升。
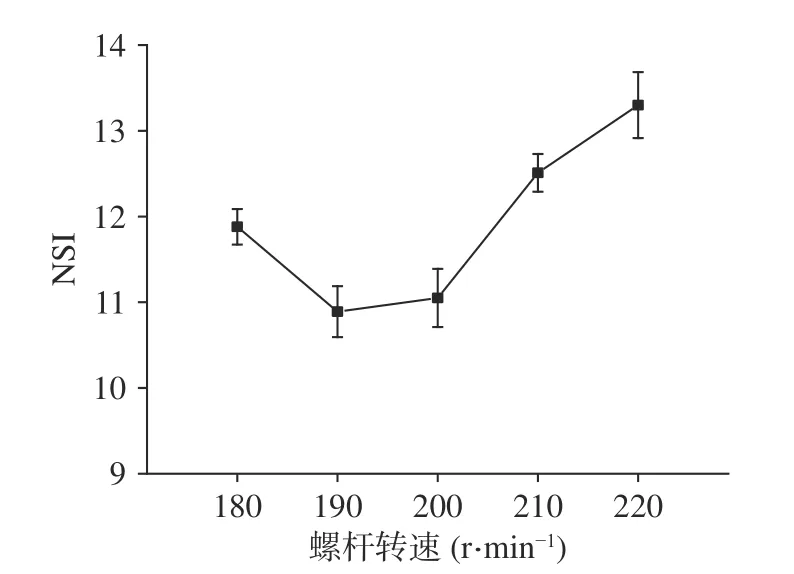
图3 不同螺杆转速对蛋白原料的氮溶解指数的影响Fig.3 Effect of different screw speeds on the nitrogen solubility index of protein materials
2.4 挤压组织化对蛋白原料的氨基酸含量的影响
从表3可以看出人体必需的8种氨基酸,谷朊粉大部分都比芝麻蛋白中的含量高,所以在芝麻蛋白粉挤压组织化研究中加入一定量的谷朊粉,可以提高组织化蛋白产品的氨基酸含量和营养价值,同时还可以改善产品的品质。
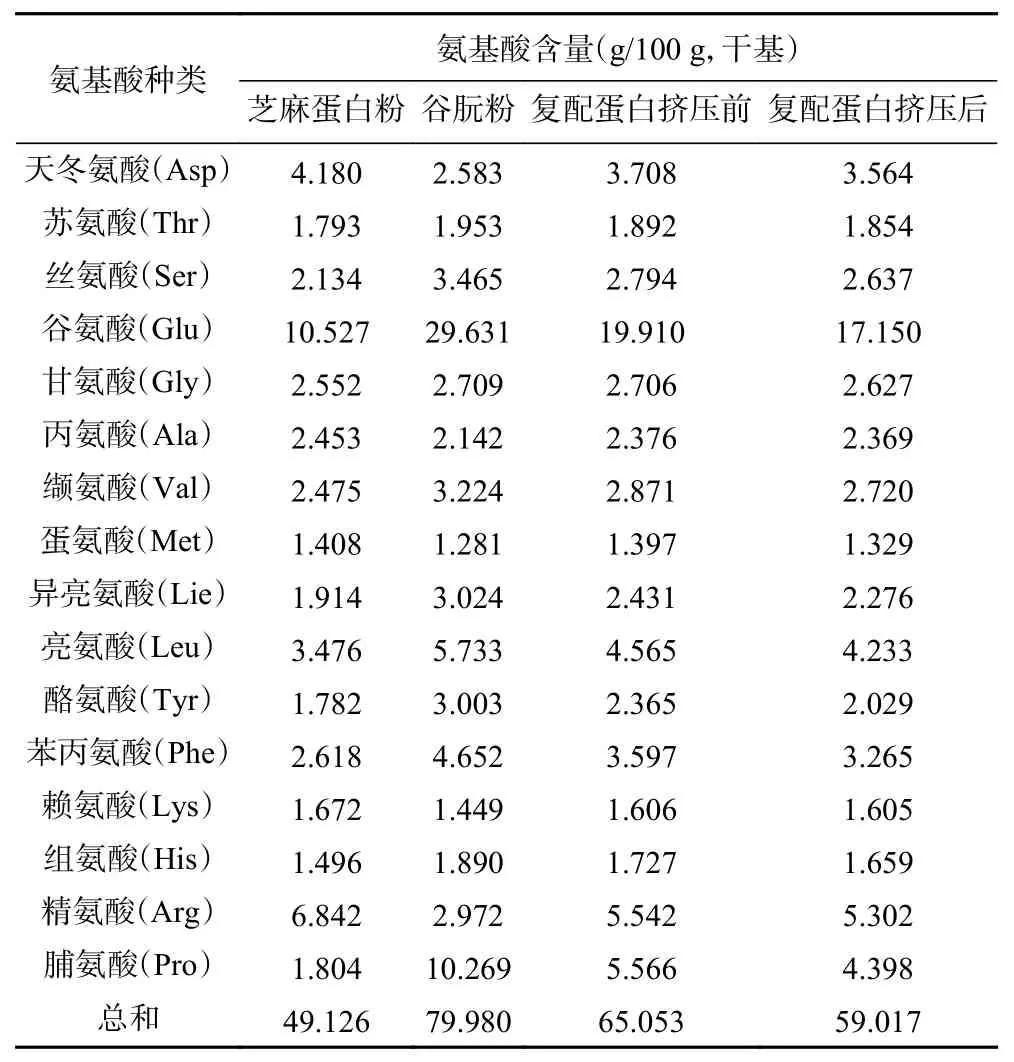
表3 挤压前后各氨基酸的组分含量Table 3 Content of each amino acid before and after extrusion
本实验得到的是样品中氨基酸总含量。从表3中可以看出挤压组织化后氨基酸各组分含量与挤压组织化前相比都有不同程度的减少,除了赖氨酸和丙氨酸损失率在1%以下,其他氨基酸组分含量损失率均超过1%。其中损失较多的氨基酸为脯氨酸、酪氨酸、谷氨酸、亮氨酸、异亮氨酸等。虽然在挤压组织化过程,氨基酸各组分因高温、高剪切力、高压作用,参与美拉德、氧化、热分解等反应生成各类挥发性物质,导致含量有所减少,但是与其他加工方式相比,由于它加工时间短,水分含量高,氨基酸含量损失会相对较低。
2.5 挤压组织化对化学交联键变化的影响
共价键和非共价键是构成蛋白质结构的主要作用力。常见的共价键有二硫键,非共价键有氢键、离子键、静电作用等。二硫键和非共价键极易被2-巯基乙醇溶液和十二烷基硫酸钠溶液破坏。因此可以根据蛋白质在不同溶剂中的溶解度的变化,来分析挤压组织化前后蛋白质中化学键的变化情况[25]。
从表4可以看出挤压前蛋白在B(SDS)溶液、C(2-ME)溶液和D(SDS+2-ME)溶液中的溶解度都比在A(磷酸盐缓冲液)液中大,表明在磷酸盐缓冲液中加入SDS和2-ME后蛋白质溶解度会增大,并在D(SDS+2-ME)溶液中溶解度达到最大。说明二硫键和非共价键之间的交互作用对复配蛋白的结构影响很明显。挤压后相对于挤压前在不同溶剂中的溶解度都有所下降,且在B(SDS)溶液中变化最大,溶解度由挤压前的31.42%下降到挤压后的14.59%,降低了53.56%,说明在挤压组织化过程中蛋白的非共价键遭到的破坏最大。

表4 蛋白挤压组织化前后溶解度的变化Table 4 Changes in solubility of protein before and after extrusion
如表5所示,为了更加清楚的了解化学键对蛋白质溶解度的影响,根据Kitabake等[20]的方法将样品在不同浸提液中的溶解度转换为化学键的形式。
从表5可以看出挤压前后的蛋白都是主要通过二硫键和非共价键两者相互作用共同维持其结构,除此之外还有其他方式参与维持蛋白结构的稳定。挤压前蛋白以非共价键单独作用的力占到21%,是除了二硫键与非共价键互相作用外最多,以二硫键单独作用的最少,而挤压后蛋白是天然状态下最大,占到8.03%,最小的与挤压前蛋白一样,占到3.86%。将挤压前后进行对比发现,以二硫键作用的,减少了27.03%,非共价键作用的减少了68.76%,而以二硫键和非共价键交互作用的增加了32.6%,说明在挤压组织化对非共价键的破坏比较大,二硫键虽然单独看时有所减少,但结合二硫键和非共价键交互作用增加的量来看,还是有生成的。综上所述非共价键与二硫键的交互作用是维持组织化蛋白的结构的主要作用力。

表5 不同结合状态蛋白挤压组织化前后溶解性变化Table 5 Solubility changes of proteins in different binding states before and after extrusion
2.6 热分解特性的研究
从图4可看出挤压组织化前后蛋白原料在室温~600 ℃之间都发生了3次热分解反应,第一次热分解反应的峰值出现在50~100 ℃之间,第二次热分解反应的峰值出现在250~350 ℃之间,第三次热分解反应峰值出现在450~500 ℃之间。热分解速率曲线中一般应该有四个主要的热分解反应峰,原料中的水分蒸发会造成第一次热分解峰的出现,一般不做研究,增塑剂的分解会造成第二次热分解峰的出现,蛋白质分子的化学键如S-S发生断裂会导致第三次热分解峰的出现,蛋白质完全分解会造成第四次热分解峰的出现[26]。本实验中少了位于110~250 ℃的热反应峰,可能是原料中油脂含量过少,变化不明显。
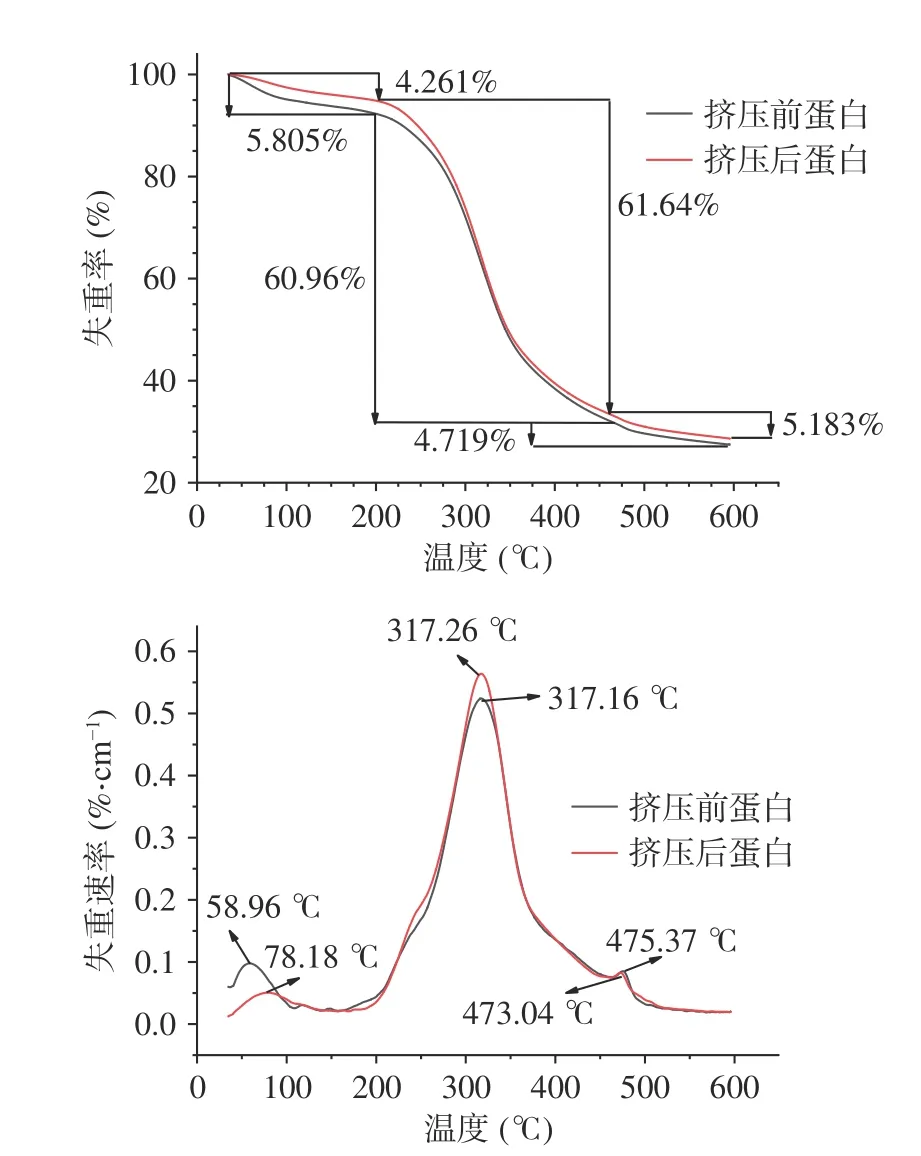
图4 蛋白挤压组织化前后的失重曲线和失重速率曲线Fig.4 Weight loss curve and weight loss rate curve before and after protein extrusion and organization
从图4还可看出在250~350 ℃之间出现的峰值中挤压前后蛋白原料的分解温度相差不大,但失重速率挤压后蛋白原料明显比挤压前的快,从450~500 ℃之间出现的峰值可以看出两者的失重速率大小相差不大,但挤压后蛋白的分解温度明显低于挤压前蛋白的分解温度。所以可以得到挤压组织化处理会降低蛋白原料的热稳定性。
2.7 傅里叶红外光谱分析
2.7.1 挤压组织化对原料蛋白二级结构的影响
2.7.1.1 峰的指认 酰胺Ⅰ带各峰的指认标准如表6所示。

表6 酰胺Ⅰ带各峰的指认标准[27]Table 6 Designation standard of each peak of amide I[27]
2.7.1.2 原料中蛋白质的二级结构的含量变化 从表7可以看出亚临界芝麻蛋白粉中α-螺旋结构含量最高,为44.51%,谷朊粉中β-折叠含量最高,为32.90%,两者以7:3的比例混合后,α-螺旋和β-折叠的含量减少,无规则卷曲含量增加,说明两者混合之后二级结构与之前相比变得比较无序。可能是由于两种蛋白混合后,会出现交联现象,导致无规则卷曲含量增加,故变得无序。

表7 不同蛋白质的二级结构含量Table 7 Secondary structure content of different proteins
2.7.1.3 不同挤压温度对蛋白质二级结构的影响在挤压组织化过程中,保持水分含量和螺杆转速不变,改变挤压温度,来研究不同挤压温度对原料中蛋白质二级结构的影响,具体含量变化如表8所示。
从表8可以看出与原料二级结构相比,120 ℃以上高温下的蛋白质的二级结构发生了较大变化,β-折叠和β-转角增加,无规则卷曲、α-螺旋和β-逆折叠减小,说明复配蛋白原料中相对稳定的结构为β-折叠和β-转角。
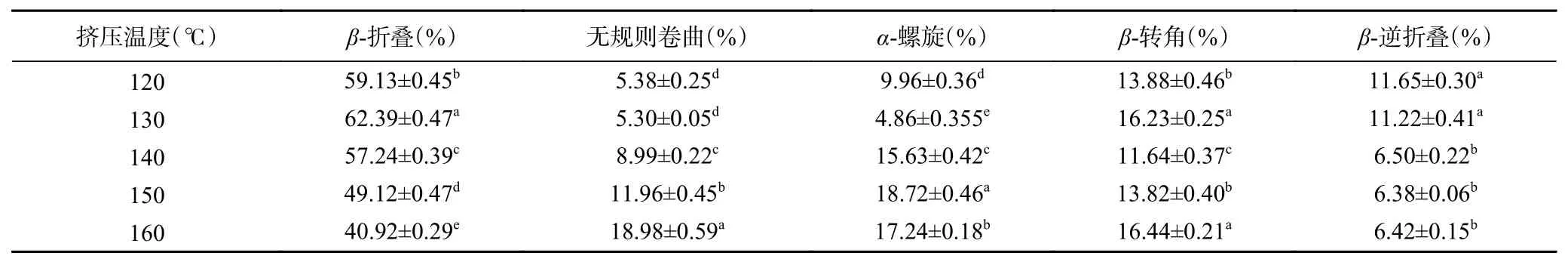
表8 挤压温度对蛋白质二级结构含量的影响Table 8 Influence of extrusion temperature on the content of protein secondary structure
在120~130 ℃时,无规则卷曲变化不大,α-螺旋含量大幅度减小,β-折叠和β-转角增加,130~140 ℃时,β-折叠和β-转角含量减小,无规则卷曲和α-螺旋含量增加,在140~160 ℃时,β-折叠含量减小,α-螺旋、β-转角和无规则卷曲含量增加。β-折叠含量减小应该是由于β-折叠在此温度区内不稳定,主要结构为β-折叠的蛋白在此温度区间发生了降解导致β-折叠含量减小[28],无规则卷曲含量增加,主要是温度会加剧蛋白质变性的程度,使其原有的结构被破坏,β-转角的含量增加,说明在蛋白质重新排列时,氢键减少,促进了β-折叠向β-转角的转变[29]。
2.7.1.4 不同水分含量对蛋白质二级结构的影响在挤压组织化过程中,保持挤压温度和螺杆转速不变,改变水分含量,来研究不同水分含量对原料中蛋白质二级结构的影响,具体含量变化如表9所示。
从表9可以看出与原料相比,总体上水分含量促进了α-螺旋和无规则卷曲向β-折叠和β-转角的转变。在水分含量为50%~60%时,α-螺旋向β-折叠转变,无规则卷曲和β-转角基本保持不变,在水分含量为60%~65%时,β-折叠和无规则卷曲减少,β-转角增加,在65%~70%时二级结构的含量变化主要为无规则卷曲和β-逆折叠减少,β-折叠增加,β-转角基本保持不变。说明了水分含量的增加促进了蛋白分子链在高温、高压和高剪切力的综合作用下的展开,从而变得更加有序[30]。
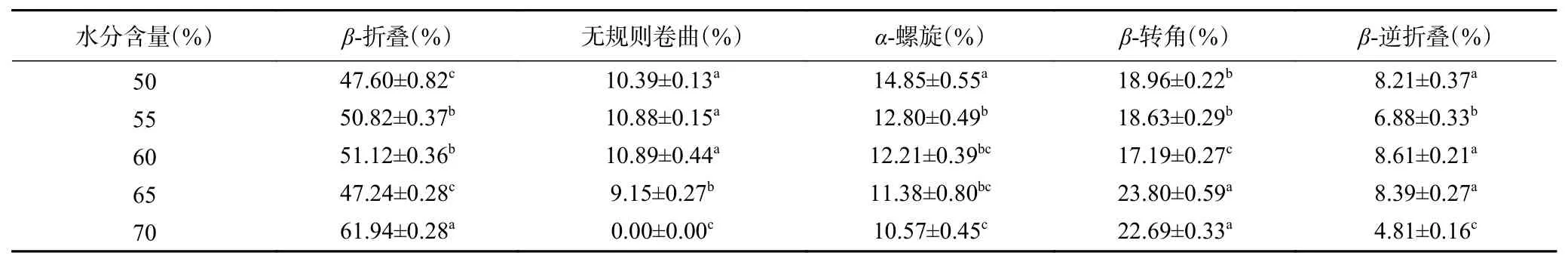
表9 水分含量对蛋白质二级结构含量的影响Table 9 Influence of moisture content on protein secondary structure content
2.7.1.5 不同螺杆转速对蛋白质二级结构的影响在挤压组织化过程中,保持水分含量和挤压温度不变,改变螺杆转速,来研究不同挤压温度对原料中蛋白质二级结构的影响,具体含量变化如表10所示。
从表10可以看出与原料相比,总体上螺杆转速对原料中蛋白质二级结构的影响与水分含量对其的影响类似,都是α-螺旋和无规则卷曲的含量减小,β-折叠和β-转角的含量增大。在螺杆转速为180 r/min时,相比其他螺杆转速,原料在机筒内停留时间长蛋白质变性程度相对来说大,导致无规则卷曲含量相对较高。螺杆转速为200 r/min之后,受热时间变短,但剪切力变大,在综合作用下促进了α-螺旋和无规则卷曲向β-折叠和β-转角转变。
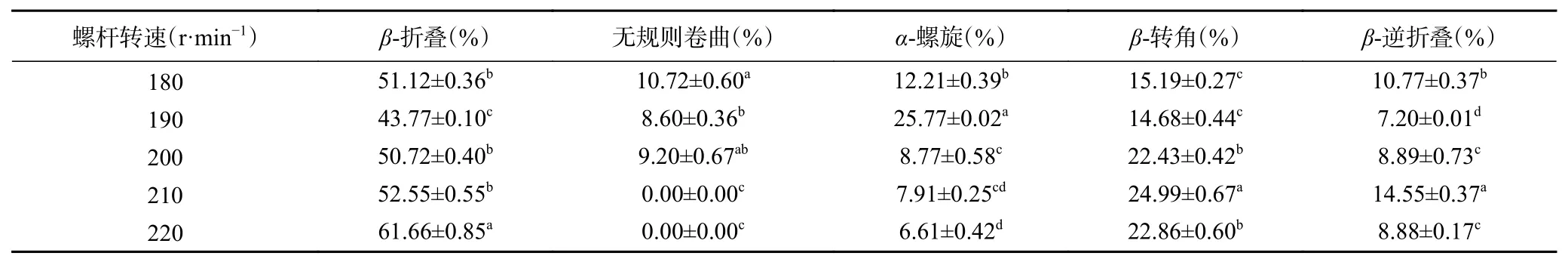
表10 螺杆转速对蛋白质二级结构含量的影响Table 10 Effect of screw speed on protein secondary structure content
2.7.2 傅里叶红外光谱法测定挤压前后结构的变化傅里叶红外吸收光谱是一种分子振动-转动光谱,是由分子的振动-转动能级间的跃迁而产生的[31]。某种特定的官能团和相关的化学键,不管其结构如何变化,它在光谱图中都会显示出几乎相同的频率或波数。所以,可以根据光谱图中显示的特征吸收谱带的位置,鉴别分子中所含有的特征官能团和化学键的类型[32]。为了研究原料在挤压过程中是否生成的新的肽键,故将挤压组织化前后的光谱图放在一起对比。从图5中可以看出挤压组织化前后的蛋白原料的特征吸收峰并无差别,说明挤压组织化过程中没有新的肽键生成。
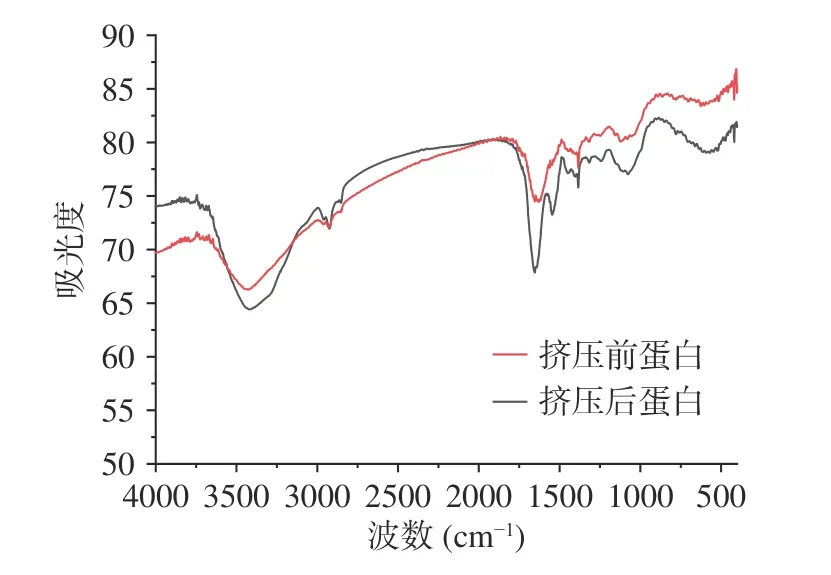
图5 挤压前后蛋白原料的傅里叶红外光谱图Fig.5 FT-IR spectra of protein materials before and after extrusion
2.8 挤压组织化前后微观结构的变化
从图6可以看出芝麻蛋白与谷朊粉在混合后在天然状态下以不规则球状颗粒形态存在,没有特定的排列规律,经过挤压组织化处理后,蛋白质发生变性,结构改变,呈熔融状态,从模头中挤出时由于压力和剪切力的作用下,结构重新排列,呈线性排列形成了纤维结构[33],吸水性有所增加,吸油性有所降低。但可能是原料含有芝麻皮等杂质,导致组织化蛋白电镜图中出现裂缝等形状。

图6 原料和组织化蛋白的扫描电镜图(纵截面)Fig.6 SEM of raw materials and texturized protein(longitudinal section)
3 结论
挤压组织化过程比较复杂,很难通过某些指标来彻底解释,本实验通过对挤压组织化后的蛋白原料的理化性质及结构的初步探究,得到挤后的蛋白原料持水性增加了14.16%,吸油性减少了14.52%,蛋白消化率增加了11.18%,游离巯基含量减少了11.55%,氨基酸各组分均有一定损失,其中损失较多的氨基酸为脯氨酸、酪氨酸、谷氨酸、亮氨酸、异亮氨酸等。挤压组织化过程中没有新的肽键生成,有大量的二硫键生成,挤压后得到的组织化蛋白的结构主要是由二硫键和非共价键共同作用维持,同时挤压组织化并未完全破坏蛋白质的二级结构,只有部分不稳定的α-螺旋和无规则卷曲向相对稳定的β-折叠和β-转角转变;蛋白排列由无序变为有序,并产生了大量的纤维结构,为后续深入开展组织化蛋白形成机理研究、开发组织化芝麻蛋白产品提供理论基础。
