发酵枸杞酒沉淀物成分鉴定及稳定性提升研究
2023-01-13王丽卫蹇艾君王春光张柏林王晓楠
李 娜,任 杰,王丽卫,蹇艾君,王春光,张柏林,王晓楠,
(1.北京林业大学生物科学与技术学院食品科学系,林业食品加工与安全北京市重点实验室,北京 100083;2.中国科学院过程工程研究所生化工程国家重点实验室,北京 100190)
枸杞(Lycium barbarumL.)是我国传统的药食同源食物,富含枸杞多糖、黄酮、甜菜碱、类胡萝卜素等营养成分[1],具有提高免疫力[2],降低血压,保护视力等保健功效[3-4]。我国枸杞产量很大,但市场上多为其干制品,深加工产品不多,发酵枸杞酒是近年来的一个新兴产业。
发酵枸杞酒是经过酵母发酵而制成的一种低度果酒,随着枸杞功能性成分的不断发现,发酵枸杞酒日益受到青睐,市场需求量逐年扩大。成品酒不仅较好地保留了枸杞的多糖、甜菜碱、黄酮、氨基酸等成分,具有丰富的营养价值,而且发酵赋予了枸杞酒特有的发酵风味[5]。然而,实际的生产过程中,发酵枸杞酒在短期内极易产生白色、黄色絮状沉淀,严重影响其感官品质[6-7]。为了实现果酒瓶装后的稳定,目前常用的方法是在灌装前向酒液中添加澄清剂,作用原理一般分成两类:第一种是加入的澄清剂与果酒中有机物反应使其发生分解或沉淀;第二种是吸附作用,通过加入澄清剂吸附酒液中的不稳定物质,使其沉淀下来[8]。目前果酒中常用的澄清剂主要有以下几类,较为常见的是皂土,包括钠型、钙型以及各种复合型皂土;另一类使用较多的是明胶类,包括明胶、酪蛋白、鱼胶等;其他还包括聚乙烯聚吡咯烷酮(PVPP)、琼脂、阿拉伯胶、多糖和果胶酶等[9]。
目前对于发酵枸杞酒的研究中,吴桂君[10]确定了发酵枸杞酒沉淀物的主要成分包括蛋白质沉淀、蛋白质-单宁沉淀、果胶复合物沉淀、蒽醌类成分和色素,但未对其定量 ,朱银龙等[11]测定了枸杞酒中氨基酸、矿物质及金属元素等营养成分的含量,但没有测定有机酸、多糖和多酚等基本成分。李亚辉等[6]筛选出了最佳澄清剂并优化其澄清条件,同时对枸杞果酒的冷稳定性、热稳定性和微生物稳定性进行了研究,但没有测定澄清剂处理后枸杞酒化学成分的变化。本研究以发酵枸杞酒及其沉淀物为对象,对沉淀物的组成成分进行定性、定量分析,同时还研究了不同种类的澄清剂(皂土、明胶、蛋清粉、蛋白酶等)对枸杞酒稳定性的影响,旨在为发酵枸杞酒的生产提供技术依据。
1 材料与方法
1.1 材料与仪器
发酵枸杞酒(还原糖1.31 g/L,总酸8.44 g/L,酒精度10.68%) 宁夏森淼枸杞科技开发有限公司,酿造工艺参考文献[12];考马斯亮蓝 天津市津科精细化工研究所;福林酚 天津市光复科技发展有限公司;无水乙醇、正磷酸、酒石酸、没食子酸、三氟乙酸、苯酚、浓硫酸(分析纯) 北京化工厂;葡萄糖标品、甲醇、甲酸(色谱纯) Sigma公司;GranuBent PORE-TEC皂土(皂土GB)、NaCalit® PORE-TEC皂土(皂土NC)、MostRein®PORE-TEC皂土(皂土MTR) 德国Erbsloeh集团;TOPGRAMTM+皂土(皂土TOP)、BENTO.ZERO皂土(皂土ZERO)、GELBENTONITETM DC皂土(皂土GEL) 意大利DAL CIN集团;W食品明胶(明胶W) 北京易秀博古生物公司;GPS100酿酒明胶(明胶GPS100)、GPS200酿酒明胶(明胶GPS200) 法国罗赛洛明胶集团;ATOCLAR M澄清剂明胶(明胶奥克莱M)、PULVICLAR S澄清剂明胶(明胶奥克莱S) 意大利Enartis集团;阿拉伯胶、乙二胺四乙酸(EDTA)
食品级,北京易秀博古生物公司;聚乙烯吡咯烷酮(PVPP)、六偏磷酸钠 食品级,北京朗逸卓越有限公司;BestClar OvoT蛋清粉(简称蛋清粉) 丹麦Sanovo蛋品集团;碱性蛋白酶(200 U/mg) 食品级,河南圣斯德实业有限公司;酸性蛋白酶(100 U/mg)食品级,湖南鸿鹰生物工程公司。
TGL-16G高速离心机 上海安亭科技仪器厂;FD-1冷冻干燥机 北京德天佑科技发展有限公司;RE2000A旋转蒸发仪 上海亚荣生化仪器厂;FA2004分析天平 上海舜禹恒平科学仪器有限公司;VISTA-MPX型ICP-AES 美国VARIN公司;DRC-e型ICP-MS、UV-3300紫外可见分光光度计
上海美普达仪器有限公司;PHS-3C型pH计 上海雷磁仪器厂;AGS型Turbiscan多重光散射分析仪
法国Formulation公司;HI93703-11浊度计 哈纳沃德仪器(北京)有限公司;LC-20 A T高效液相色谱仪 日本岛津公司;TD5A-WS台式离心机 长沙湘仪离心机仪器有限公司;HH-4电热恒温水浴锅金坛市荣华仪器制造有限公司。
1.2 实验方法
1.2.1 样品预处理 将瓶装的发酵枸杞酒在20 ℃下避光贮藏15个月,产生了较明显的沉淀。离心(6000 r/min,10 min)获得沉淀物,冻干,即为发酵枸杞酒沉淀。测定其理化指标前取适量冻干沉淀物配制成合适浓度的溶液。
1.2.2 理化指标测定方法
1.2.2.1 蛋白质测定 采用考马斯亮兰G-250法测定蛋白质含量,参照文献[13]进行。
1.2.2.2 多糖测定 依据Dubois等[14]的方法测定多糖含量。选择适量的酒液,加入4倍体积的80%的乙醇溶液,在4 ℃下放置24 h。离心(8000 r/min,10 min)后的沉淀物用丙酮清洗2次,再用乙醚清洗1次,自然挥干,获得酒液中的多糖。将酒样中的多糖或枸杞酒沉淀物配成合适浓度溶液,取0.2 mL于试管中,补水至2.0 mL。
1.2.2.3 总酚测定 采用福林酚法测定总酚含量,参照文献[15]进行。
1.2.2.4 有机酸测定 采用高效液相色谱法[16]测定有机酸含量。进样前取适量酒样或沉淀物粉末制成水溶液,离心(7000 r/min,10 min)后的上清液通过0.45 μm的滤膜过滤,过滤后取上清液进行检测。色谱条件:色谱柱为VenusilA SB C18(4.6 mm×250 mm,5 μm);流动相:96.9%超纯水-3.0%甲醇-0.1%甲酸;流速:0.5 mL/min;柱温:室温;检测波长:210 nm;进样量:20 μL。定性定量方法:在相同的色谱条件下,将样品色谱图与有机酸混标的色谱图进行对照,根据保留时间确定样品中各有机酸组分的色谱峰,结合有机酸的标准曲线,对样品中的有机酸定量。
1.2.2.5 金属元素测定 参考文献[17]的方法,使用DRC-e型ICP-MS和VISTA-MPX型ICP-AES进行测定。ICP-MS的条件:RF功率为1.2 kW,冷却气流量为15 L/min,雾化器气体流量为0.7 L/min,辅助气气体流量为1.0 L/min。ICP-AES的条件:RF功率为1.15 kW,冷却气流量为15 L/min,雾化器气体流量为0.75 L/min,观测高度12 mm,辅助气气体流量为1.5 L/min。
1.2.2.6 浊度测定 采用HI93703-11便捷式浊度测定仪测浊度。
1.2.3 澄清剂的前处理
1.2.3.1 皂土类 选取6种皂土,分别是皂土GB、皂土NC、皂土MTR、皂土TOP、皂土ZERO和皂土GEL。均配制成20%的皂土溶液使用[18]。
1.2.3.2 明胶类 选取5种明胶,分别是明胶W、明胶GPS100、明胶GPS200、明胶奥克莱M和明胶葡维克S。明胶W、明胶奥克莱M和明胶葡维克S配制成10%的溶液使用。明胶GPS100和明胶GPS200配制成20%的溶液使用[19]。
1.2.3.3 其他种类 除了常用的皂土、明胶类澄清剂,生产中还会使用一些其他澄清剂来促进果酒的澄清稳定。本研究选用了6种其他种类的澄清剂,分别是阿拉伯胶、硅胶、PVPP、六偏磷酸钠、EDTA和蛋清粉。除硅胶外,均配制成10%的溶液使用[20]。硅胶依据所设定的用量梯度,直接加入到待处理的酒液中。
1.2.4 澄清剂适宜添加量的确定 澄清剂的适宜添加量筛选依据是酒液的热稳定性变化[21]。根据不同澄清剂在枸杞酒中的适用量,分别按照表1中的添加量梯度加入到0.5 L的发酵枸杞酒中,充分混匀,20 ℃下静置48 h,取离心(6000 r/min,10 min)后的上清液测定其浊度,记为N1;将离心后的酒液置于加热容器中,90 ℃水浴1 h,然后于4 ℃保持6 h,再恢复到室温,取离心(6000 r/min,10 min)后的上清液测定其浊度,记为N2。热稳定性用两次浊度的差值来表示(△N=N2-N1),差值越小表示酒液越稳定。△N值最小时的澄清剂用量即为该澄清剂的适宜添加量。

表1 澄清剂的添加量Table 1 Addition amount of each clarifier
1.2.5 澄清剂处理对发酵枸杞酒指标的影响 根据澄清剂添加量优化的结果,使用各澄清剂的适宜添加量处理0.5 L发酵枸杞酒,混合均匀,20 ℃静置48 h,取上清液测定澄清剂处理后发酵枸杞酒的蛋白质、有机酸、多糖含量及稳定性动力学指数,以未经澄清剂处理的发酵枸杞酒作为对照。实验平行重复3次,结果取平均值。
1.2.6 稳定性动力学指数的测定 采用稳定性Turbiscan多重光散射分析仪测定[22]。采用近红外光作为光源,光源与透射光和背散射光两个光检测器组成测量探头。取20 mL样品到测试瓶中,置于Turbiscan多重光散射分析仪扫描池中检测。扫描温度为25 ℃,间隔2 h扫描1次,总扫描时间为48 h,所有样品重复测定3次。最终由稳定性分析仪获取的稳定性动力学指数(TSI)判断样品体系稳定性。TSI值越大,体系就越不稳定,反之体系就越稳定。
1.3 数据处理
所有的实验重复三次,使用SPSS 22.0(SPSS Inc., Chicago, IL, USA)对所得实验数据进行统计学分析,使用Turbisoft-Lab-2.2.0.82对稳定性分析仪的数据进行分析。
2 结果与分析
2.1 沉淀物的化学组成
2.1.1 蛋白质 对沉淀物蛋白质进行测定,发现蛋白质占比为30.68%,说明蛋白质参与了枸杞酒的沉淀。陆晓滨等[23]报道发酵型枸杞酒中沉淀物中含有31%蛋白质。蛋白质导致酒体浑浊可能的原因有:一是蛋白质与单宁形成带正电的蛋白质-单宁大分子络合物,然后与酒中带负电的果胶胶体由于电荷中和作用和分子架桥吸附作用形成大颗粒蛋白质-单宁-果胶絮凝体;二是蛋白质与枸杞酒中的金属离子形成复合物等[10]。
2.1.2 有机酸 对沉淀物有机酸进行测定,发现有机酸占比为28.22%,主要含三种有机酸:柠檬酸、酒石酸和草酸,含量分别为13.53%、12.42%和2.27%。目前还未见对于发酵枸杞酒沉淀物有机酸含量的研究,刘延琳等[24]报道枸杞鲜果发酵酒中的柠檬酸、苹果酸和酒石酸来源于果实,草酸和乳酸来源于发酵。Focea等[25]对贮藏前后的白葡萄酒进行了分析,发现经过6个月和11个月的贮藏,酒中酒石酸显著减少,柠檬酸、苹果酸和乳酸均有小幅度上涨。
2.1.3 多糖 对沉淀物多糖进行测定,发现多糖占比为19.23%,说明多糖参与了沉淀的形成。果胶是一种广泛存在于植物中的多糖,枸杞酒在酿制过程中,由于水解不完全等原因,酒中会含有一定量的果胶。果胶会与枸杞酒中的钙离子、铁离子形成絮状的果胶酸钙和果胶酸铁沉淀[10]。由此可见,多糖也是造成枸杞酒不稳定的原因之一。已有研究报道发酵枸杞酒的多糖含量高于葡萄酒等果酒[26],这可能也是造成发酵枸杞酒更不稳定的原因之一。
2.1.4 总酚 对沉淀物的总酚进行测定,发现总酚占比为7.73%,这和已有葡萄酒的研究结果相似,证明酚类化合物也参与了沉淀的形成[27]。酒的多酚类物质直接影响酒的抗氧化性,在贮藏过程中,由于酚类物质的反应或是和蛋白质、多糖类物质结合生成沉淀,导致总酚的含量会不断降低[28]。Zafrilla等[29]对不同种类葡萄酒进行分析,发现经过7个月的贮藏,其总酚含量下降了约10%。
2.1.5 金属元素 目前,果酒的稳定性研究主要集中在葡萄酒,常见的金属元素铁、铜、铝、铅等会影响酒液的稳定性,国标要求红葡萄酒、白葡萄酒的含铁量不得大于8 mg/L,否则会引起浑浊,铜的含量不得大于0.5 mg/L,否则会产生红棕色沉淀[30]。发酵枸杞酒沉淀物中金属元素的测定见表2,共测定到12种元素,总含量占沉淀物的5.13%,表明金属元素也参与了沉淀的形成。其中,钾、钙和锌的含量与朱银龙等[11]在枸杞酒渣中的测定结果相近。

表2 沉淀物中金属元素的含量Table 2 Metal elements content in precipitate
综上,对发酵枸杞酒沉淀物各组分进行了详细的测定,实验结果如图1所示,可以看到,沉淀物中已鉴定组分占90.99%,已基本解析沉淀物的主要组分。沉淀物的主要成分是蛋白质、有机酸和多糖,三者共占沉淀的78.13%,因此可以说明,发酵枸杞酒的沉淀主要包括蛋白质、有机酸和多糖类物质。

图1 沉淀物中各组分比例Fig.1 Proportion of each compound in the precipitate
2.2 澄清剂的适宜添加量
不同种类的果酒需要使用的澄清剂用量是不同的,为了达到最好的澄清效果,同时避免浪费,澄清剂在使用前需要进行添加量的实验,以最优的添加量作为生产上的实际用量。本研究选用6种皂土、5种明胶和6种其他种类的澄清剂,对澄清剂的添加量优化结果如图2所示。
图2A~图2F是皂土类澄清剂对枸杞酒稳定性的影响。从图中可以看出,皂土能够明显降低枸杞酒的浊度差,增强热稳定性。其原因是皂土吸水膨胀形成的悬浮液带负电荷,会和酒中带正电荷的蛋白质、色素和金属离子等相互吸引产生絮状沉淀物,从而除去不稳定物质使葡萄酒澄清稳定[31]。随着皂土添加浓度的增大,酒液的浊度变化量呈现先下降后升高的趋势,当浊度变化量最低时,对应的皂土浓度为该皂土的最佳添加量,此时,枸杞酒最稳定。皂土GB、皂土NC和皂土MTR的适宜添加量均为2.0 g/L。与其他皂土相比较,皂土TOP在适宜添加量2.1 g/L下枸杞酒的浊度变化量最小,热稳定性最好。
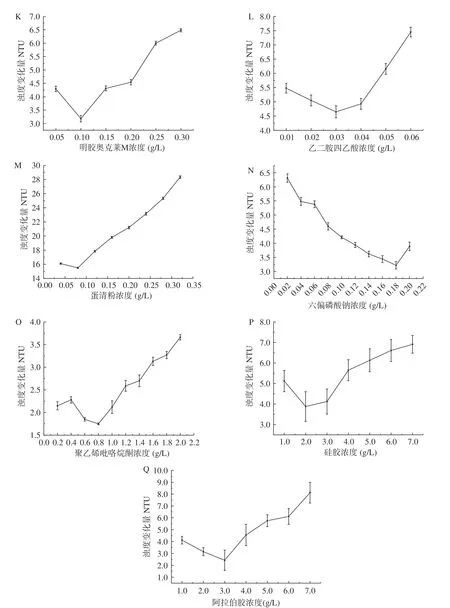
图2 不同澄清剂对枸杞酒热稳定性的影响Fig.2 Effect of different clarifiers on thermal stability of fermented goji wine
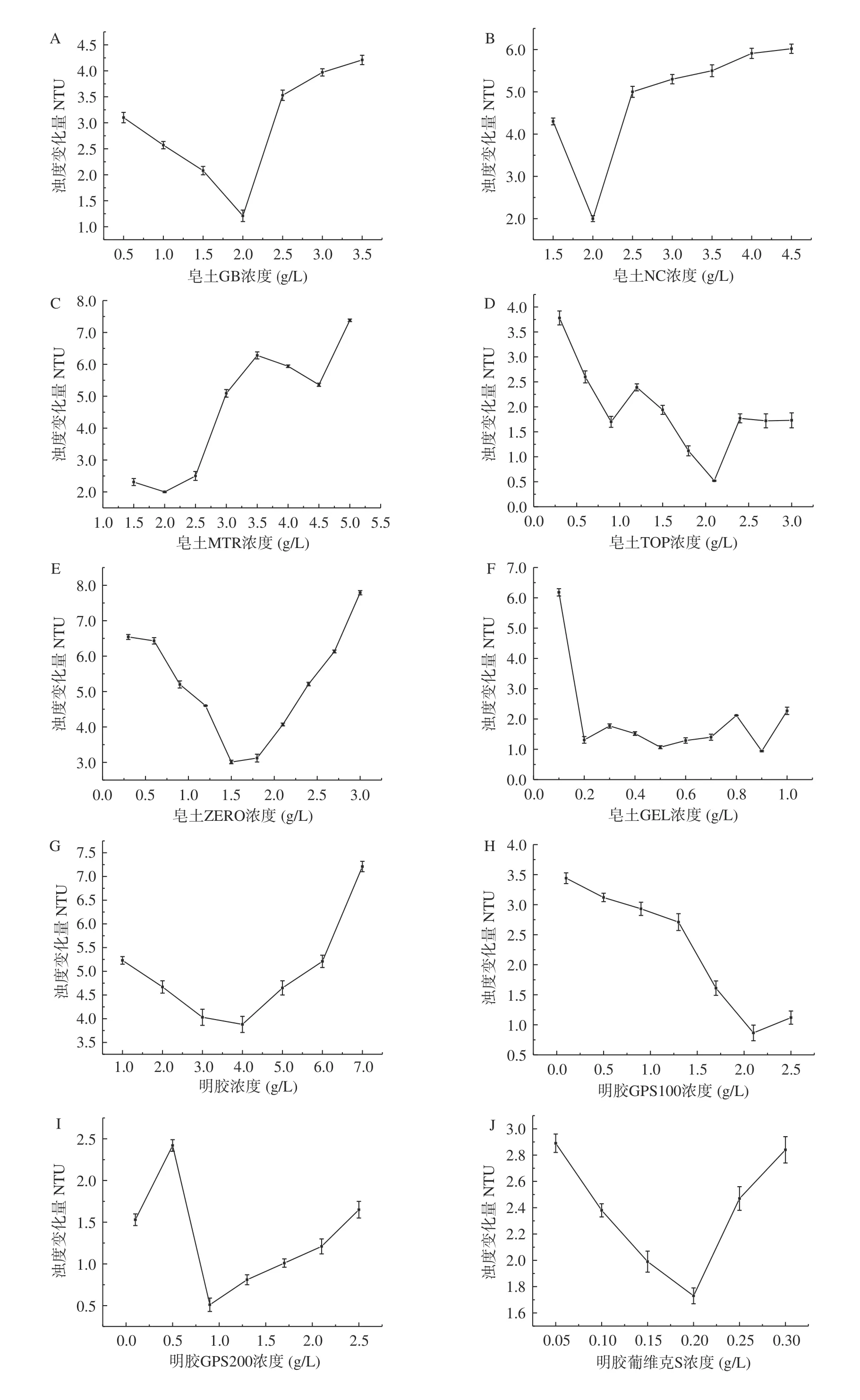
图2G~图2K是明胶类澄清剂对枸杞酒稳定性的影响。明胶带正电荷,会与酒中带负电荷的单宁相聚合,在聚合过程中会吸附、下沉果酒中的不稳定组分,从而使果酒稳定性增强。从图中可以看出,明胶类澄清剂除GPS200外,其他明胶类澄清剂随着明胶浓度的增加,枸杞酒的浊度变化量先下降后升高。这是由于明胶浓度较高使过量的明胶残留在枸杞酒中,构成了不稳定因素,从而无法使枸杞酒达到完全的热稳定[19]。
图2L~图2Q是其他类澄清剂对枸杞酒稳定性的影响。有研究将乙二胺四乙酸(EDTA)用在果酒中,EDTA是一种极易与金属离子形成可溶性络合物的化合物,这在一定程度上加强了果酒的稳定性[32]。蛋清粉溶于水后会与单宁相互结合,形成凝聚力很强的絮状沉淀,而且蛋清粉对果酒整体品质的不利影响很小[33]。阿拉伯胶具有保护胶体的能力,能和溶液中其他胶体的表面电荷相互中和,减少了胶体的聚集能力,提高了果酒的稳定性[34]。从图中可以看出,其他类澄清剂的枸杞酒浊度变化量整体均呈现先减小后增大的变化趋势,其中,聚乙烯吡咯烷酮(PVPP)在适宜添加量0.8 g/L下的枸杞酒浊度变化量最小,热稳定性最好。张国栋等[35]使用聚乙烯吡咯烷酮(PVPP)和蛋清粉处理植物性配制酒,发现随着添加浓度的增大,植物配制酒的澄清度增加,一定浓度后澄清度不再增加。
2.3 澄清剂处理后发酵枸杞酒的理化指标变化
2.3.1 蛋白质含量变化 蛋白质是导致果酒不稳定的重要因素,因此需要将其去除[36]。本研究使用不同种类的澄清剂(皂土组、明胶组和其他组)处理发酵枸杞酒,依照澄清剂的类型,处理后枸杞酒中的蛋白含量如图3所示。对照组枸杞酒中蛋白质含量为511.43 mg/L,而Dufrechou等[37]报道白葡萄酒中蛋白质的含量为15~330 mg/L,枸杞酒蛋白质含量远高于白葡萄酒,使发酵枸杞酒不稳定,更容易产生沉淀。可以看出,除皂土处理组以外,其余两个处理组均使枸杞酒中的蛋白含量上升。皂土处理使发酵枸杞酒的蛋白含量降低为初始对照的12.3%~28.1%,其中皂土NC去除的蛋白最多。这是由于皂土吸水后膨胀变得疏松多孔,形成带负电的胶体,吸附酒中带正电的不稳定蛋白产生沉淀,从而使果酒澄清[6]。这与Jaeckels等[38]的研究结果一致,Jaeckels使用不同类型的皂土处理葡萄酒,发现处理后的蛋白质含量下降4%~33%。明胶和其他类两个处理组,除加入盐酸调节pH的处理组外,其他处理组均使枸杞酒的蛋白质含量增加。这可能是因为澄清剂含有蛋白质类物质,导致检测结果高于对照组,这和祁海平等[39-40]的结果相似。
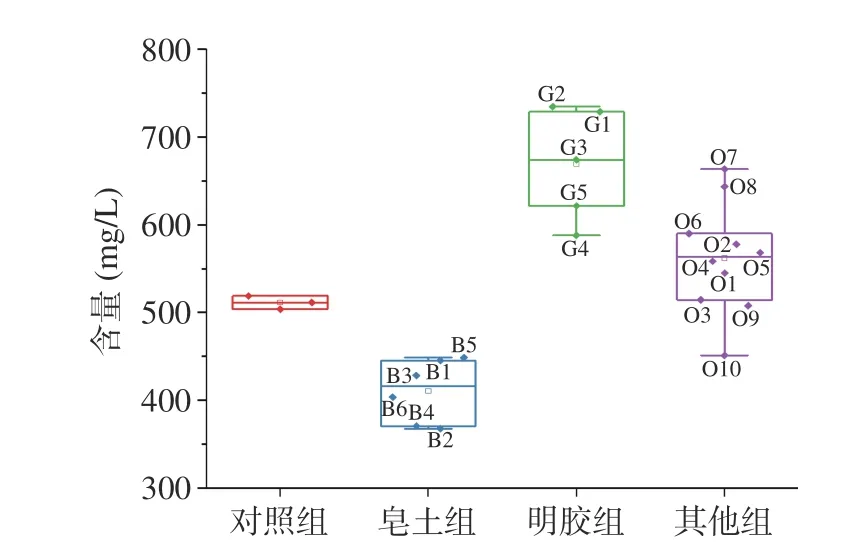
图3 不同澄清剂处理对枸杞酒蛋白含量的影响Fig.3 Effect of different clarifier treatments on the protein content of fermented goji wine
2.3.2 有机酸含量变化 枸杞酒沉淀物中有机酸含量仅次于蛋白质,使用不同澄清剂处理发酵枸杞酒,有机酸含量如表3所示。皂土组处理对发酵枸杞酒有机酸的含量影响不大,有机酸的变化趋势较为相似,苹果酸和乳酸含量略有降低,可能是由于有机酸中的-OH基团与皂土澄清剂表面的-Si-O或-AlO基团通过氢键结合导致[41]。在明胶处理组中,酒石酸含量都有所下降,其余有机酸差异不显著或升高,这5种明胶对酒石酸都有吸附作用。除明胶GPS100和GPS200外,其他3种明胶处理后苹果酸的含量降低。在其他处理组中,pH调节对酒液有机酸的含量影响较大,草酸、酒石酸和苹果酸有较为明显的下降,其他处理对有机酸含量的影响较小。
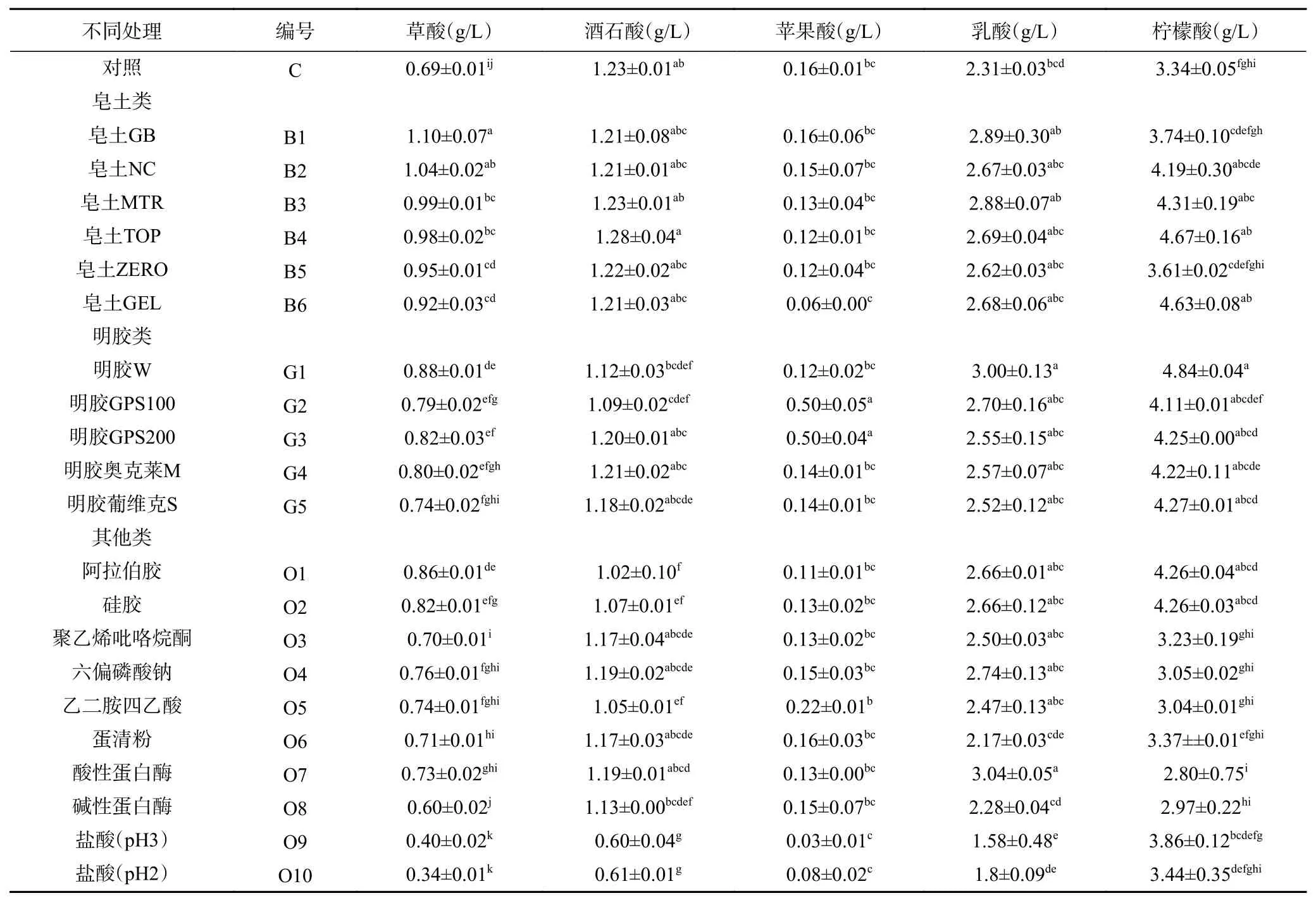
表3 不同澄清剂处理对枸杞酒有机酸含量的影响Table 3 Effect of different clarifier treatments on the organic acid content of fermented goji wine
2.3.3 多糖含量变化 多糖是广泛存在于果酒中的一种大分子化合物,目前认为多糖参与到果酒沉淀的形成,但是其参与的机制不清,发酵枸杞酒是多糖含量较高的一类果酒,通过前面的测定,在沉淀中发现了19.23%的多糖。使用不同澄清剂处理后,发酵枸杞酒的多糖含量变化如图4。可以看出,多数的处理组使多糖的含量下降。在皂土处理组中,皂土ZERO使枸杞酒中的多糖含量明显增加,分析原因可能是,在实验中皂土ZERO未像其他几种皂土一样最终沉淀在容器底部,而是漂浮在酒中,从而干扰了多糖含量的测定。在明胶处理组中,明胶W对发酵枸杞酒的多糖吸附能力最好,使多糖的含量下降为初始对照的53.84%。在其他处理组中,当用盐酸调pH为2时,测定出的多糖含量极低,仅为对照的39.11%,这可能是因为溶液状态影响了测定的准确性。
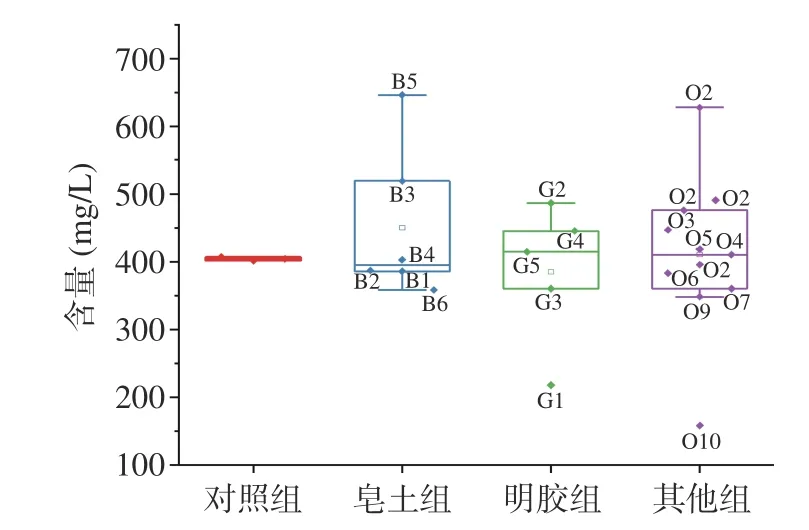
图4 不同澄清剂处理对枸杞酒多糖含量的影响Fig.4 Effect of different clarifier treatments on the polysaccharide content of fermented goji wine
2.3.4 稳定性动力学指数变化 稳定性分析仪是一种可以快速判断体系稳定性的方法,在饮料等方面应用较广,但在果酒领域研究较少。王蔚瑜等[42]基于这种方法研究了不同胶体对褐色饮料稳定性的影响,发现添加结冷胶后TSI值最小,饮料的稳定性最好,因此可以用稳定性动力学指数(TSI)快速准确地判断样品体系的稳定性。
不同澄清剂处理发酵枸杞酒,酒的稳定性动力学指数(TSI)曲线如图5所示。在皂土处理组中,随着时间的延长,各处理组的TSI值均有所增加,皂土MTR增加显著,远高于对照值,这表明皂土MTR处理后的酒液极不稳定,其他皂土处理组的最终TSI值均小于对照组,说明经过处理后发酵枸杞酒稳定性提高。其中,皂土GEL的最终TSI值最小,表明其对应处理的枸杞酒最稳定。观察各条曲线在终点48 h处的斜率可以发现,除皂土MTR外,其余皂土处理的斜率均小于对照组,因此,可以用曲线斜率来评价酒液的稳定性。在明胶处理组中,除了明胶葡维克S,其他明胶处理组的最终TSI值均低于对照组。明胶W的TSI值最低,表明其处理后的酒体最稳定,且其斜率远小于对照组,符合曲线反应的规律。在其他处理组中,只有添加硅胶和调节pH2处理后的酒体最终TSI值低于对照组,其他处理对于酒体稳定性的改善效果欠佳。碱性蛋白酶处理使酒液TSI值显著增加,特别是在30 h以后呈近直线上升,表明此时最不稳定。综合比较,明胶W处理后的曲线斜率最低,处理终点酒体的稳定性最高。
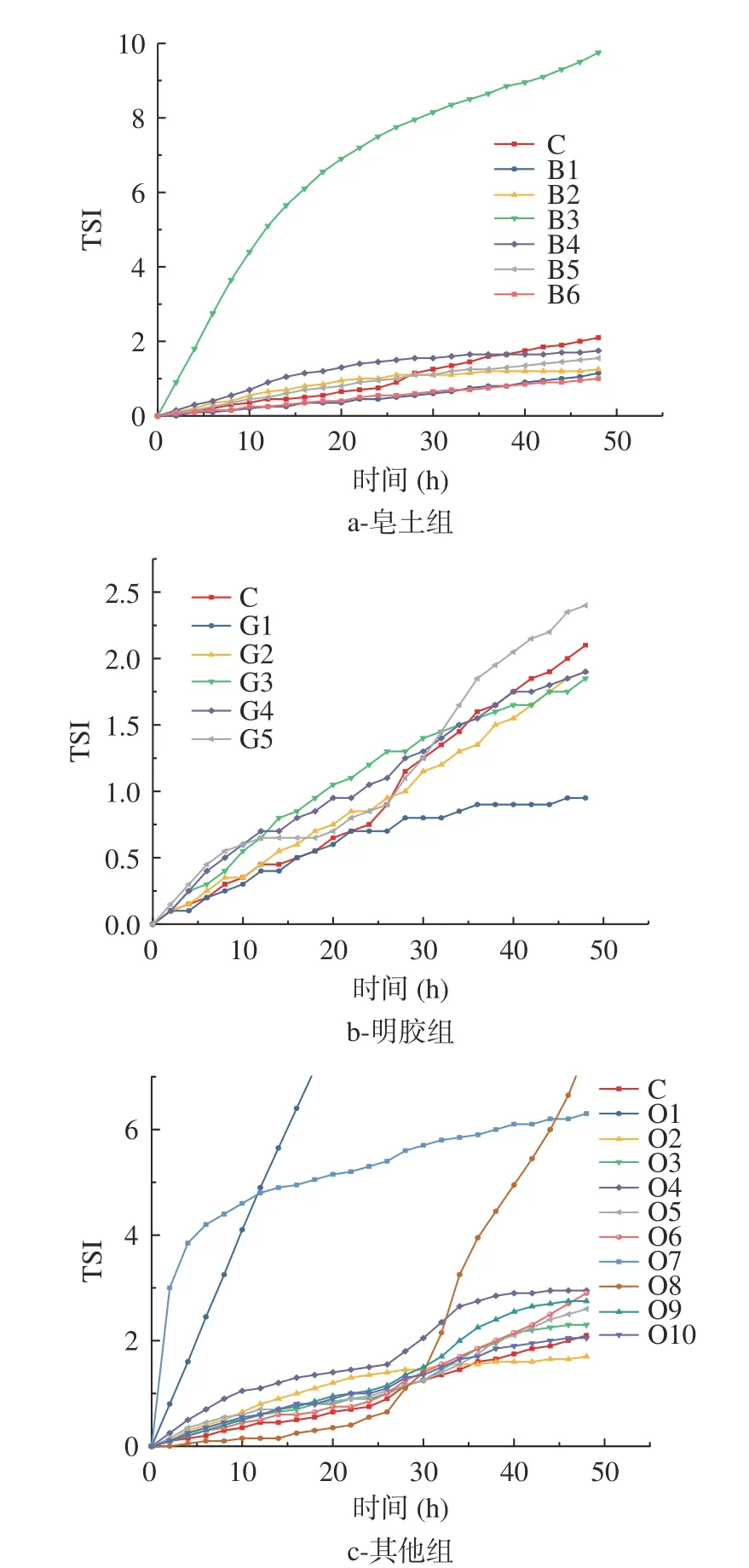
图5 不同澄清剂处理后枸杞酒的TSI值Fig.5 TSI values of fermented goji wine by different clarifiers
3 结论
本研究对发酵枸杞酒沉淀物的组成成分进行了研究,发现其沉淀物主要包括蛋白质、有机酸、多糖、多酚和金属元素等,其中,蛋白质占24%~34%,有机酸占22%~28%,多糖占15%~23%,总酚和金属元素分别占7.73%和5.13%。添加皂土和明胶等澄清剂能够减少枸杞酒沉淀的生成,显著提高枸杞酒的稳定性。不同种类的澄清剂对枸杞酒各组分的影响不同,皂土类主要影响蛋白的含量,尤其是使用皂土NC处理后的枸杞酒蛋白含量为367.55 mg/L,与对照组相比下降了28.13%。有机酸的含量主要受蛋白酶和pH的影响,尤其是调节pH为3可以减少枸杞酒中酒石酸和苹果酸的含量。实验中所选用的多数澄清剂对多糖含量的影响不明显,少数如明胶W和明胶GPS200能够吸附多糖,降低其在酒中含量。结合稳定性动力学指数分析,综合比较,添加明胶对于提高枸杞酒的稳定性效果较好。本实验的开展为改善果酒稳定性提供参考。
