乳突骨膜下注射新霉素建立小型猪单侧药物性聋模型
2022-11-05张丽媛张季蕾静媛媛余力生
张丽媛 张季蕾 静媛媛 余力生
北京大学人民医院耳鼻喉科(北京 100034)
近年来,梅尼埃病、突发性耳聋等内耳疾病发病率逐渐升高,严重影响患者生活质量,这些内耳疾病多以单侧起病为主[1,2]。既往此类内耳疾病的相关基础研究多以大鼠、小鼠等小型啮齿类动物为研究对象。最近,小型猪由于其内耳各器官在遗传背景、解剖和生理等方面与人类更相似而备受关注[3,4],利用噪声暴露建立的小型猪双侧聋模型已被广泛应用[5-8],但模拟临床常见内耳疾病的小型猪单侧聋模型却鲜有报道。
耳后给药是一种新的针对内耳疾病的局部给药方法,是将药物直接注射至颞骨乳突区骨膜下或颞肌内[9]。临床发现耳后给药可取得较好疗效[9-11],在豚鼠上的基础研究发现乳突骨膜下给药后注射侧内耳药物浓度高于对照侧[12,13]。新霉素是一类广泛使用的氨基糖甙类抗生素,它可以损伤动物耳蜗外毛细胞,造成听功能损害,而对前庭毛细胞损伤相对较小[14]。
本研究拟通过连续7天单侧乳突部骨膜下注射硫酸新霉素100mg/kg,建立巴马小型猪单侧药物性聋模型,为内耳疾病提供新的动物模型。
1 实验材料
1.1 实验动物
选取健康巴马小型猪(北京实创世纪小型猪养殖基地)6只,雌雄各半,体重5-6kg。筛选标准:双耳各频率ABR阈值基本正常,左右耳同频率阈值差异≤5dB。
1.2 实验仪器与设备
Ellipse全自动生化分析仪(0.1-0.9A,法国优德公司);TDT系统测听设备(MCO-18A20,美国);激光共聚焦显微镜(Leica SP8,德国)。
1.3 实验试剂
硫酸新霉素:上海阿拉丁公司;4%多聚甲醛:北京化工厂;PBS缓冲液:北京中杉试剂公司;10%乙二胺四乙酸脱钙液:厦门海标科技公司;免洗DAPI液:中杉金桥;Phalloidin-iFluor 594 Reagent:Abcam。
2 实验方法
2.1 实验分组及设计
6只实验动物均选择左侧耳为注射侧(实验侧),右侧耳为对照侧。入组后于笼中饲养观察7天以适应环境,期间自由取水取食,避免噪声、捉取等不良刺激。入组后第9天开始连续7天予实验侧乳突骨膜下注射新霉素100mg/kg,对照侧不做处理。给药前1天及给药结束后第1天抽取静脉血测定肌酐及尿素氮水平,给药前1天及给药结束后第7天进行ABR测听。
2.2 经乳突骨膜下给药方法
将硫酸新霉素溶解于0.9%NaCl注射液制成200mg/mL的溶液。按100mg/kg的剂量(该日龄、该体重下小型猪全身用药时单次最大安全剂量的2倍[15])抽取药液,于体表触及小型猪乳突最为明显处进针,针尖触及乳突部骨面后开始注射药物(如图1),将药物注射于骨膜下,注射过程中密切观察小型猪是否发生呼吸麻痹。每天固定时间给药1次,连续7天,每日称量体重,按实际体重所对应的剂量给药。

图1 乳突骨膜下注射Fig.1 Neomycin injection under mastoid periosteum
2.3 ABR检测
本实验采用TDT系统测听设备对小型猪进行ABR检测。麻醉满意后(3%戊巴比妥注射液,1ml/kg,臀部肌肉注射)取俯卧位。将记录电极、参考电极及接地电极分别置于小型猪颅顶中线处、测试耳耳垂处及鼻尖正中。将给声管置于测试耳外耳道口并确认无接触,对侧外耳道以海绵耳塞加以堵塞。刺激声为短纯音,测试频率为4kHz、8kHz、16kHz、24kHz、32kHz,叠加1024 次,扫描时间10ms,声强从90dB开始逐渐递减,每次递减10dB,接近阈值时递减幅度减至5dB,以能分辨、可重复的ABR波形对应的最低刺激声强度为ABR阈值。因所能达到的最大声强为90dB,故如90dB重复3次仍无法引出可重复的波形,阈值记录为100dB。
2.4 耳蜗基底膜铺片及显微镜观察
小型猪深度麻醉后断头处死、取材,4%PFA进行耳蜗灌流,并于4℃放置12小时以固定标本。后将标本移入10%EDTA内脱钙7天。于解剖显微镜下剥除蜗壳骨质,去除蜗轴、螺旋韧带、盖膜和前庭膜,得到基底膜标本。取双侧耳蜗顶转和底转相同位置的基底膜用于铺片。将所得基底膜移入离心管中,加入 Phalloidin-iFluor 594 Reagent,37℃下避光放置1小时,PBS漂洗3次,每次15分钟。在载玻片上滴加适量免洗DAPI液,将基底膜平整放入,盖玻片封片。应用激光共聚焦显微镜对基底膜铺片进行观察,选择405nm、552nm波长的激发光,对所选区域的毛细胞从上至下进行层扫,并叠加获得最后的图像。
2.5 统计学分析
所得数据均以均值±标准差()的形式表示,使用SPSS 22.0进行统计学分析。配对样本首先以箱式图检查有无异常值、Shapiro-Wilk检验是否服从正态,然后行配对样本t检验,以P<0.05为标准判断存在统计学差异。
3 实验结果
3.1 一般情况
连续给药7天后,全部6只巴马小型猪均存活,给药过程中均未发生呼吸麻痹,未见明显少尿、拒食。注射点皮肤未见明显红肿、破溃,皮肤及皮下组织未触及硬结,皮肤弹性良好。给药前后小型猪血肌酐及尿素氮水平无统计学差异(如表1,P>0.05,t检验)。
表1 给药前后血清肌酐、尿素氮浓度(umol/L)(±s)Table 1 The concentration of creatinine and urea nitrogen in serum before and after drug administration(umol/L)(±s)
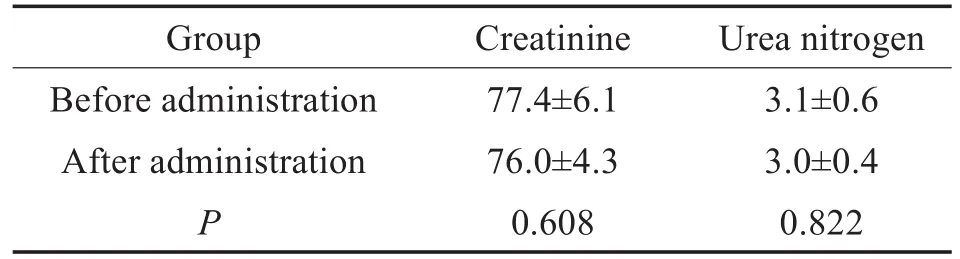
表1 给药前后血清肌酐、尿素氮浓度(umol/L)(±s)Table 1 The concentration of creatinine and urea nitrogen in serum before and after drug administration(umol/L)(±s)
Notes:n=6,*P<0.05,**P<0.01.
Group Before administration After administration P Creatinine 77.4±6.1 76.0±4.3 0.608 Urea nitrogen 3.1±0.6 3.0±0.4 0.822
3.2 给药前小型猪ABR结果
巴马小型猪正常状态下经短纯音刺激所引出的ABR波形见图2,Ⅱ波及Ⅴ波最为明显,可作为阈值判读标准,而Ⅲ、Ⅳ波融合呈M形。双耳各个频率听阈如表2所示,随着频率升高,小型猪双耳ABR听阈逐渐升高;给药前,小型猪双耳ABR阈值在各频率均无显著差异(P>0.05,t检验)。
表2 给药前两组ABR阈值比较(dB)(±s)Table 2 Comparison of ABR thresholds between the two groups before administration(dB)(±s)
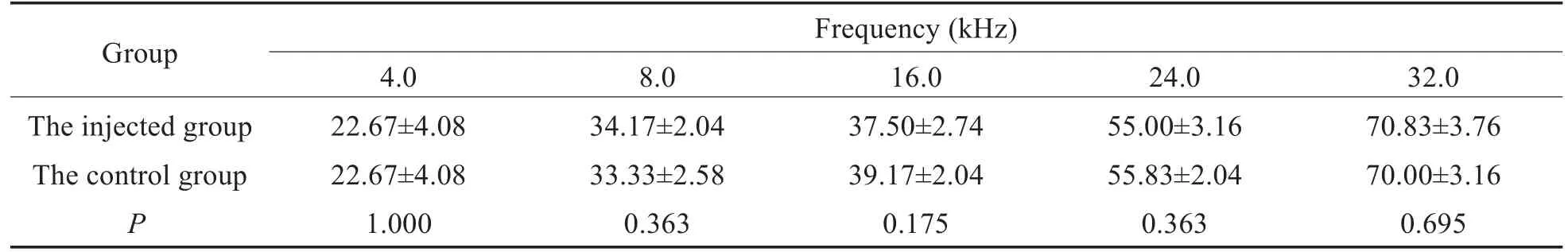
表2 给药前两组ABR阈值比较(dB)(±s)Table 2 Comparison of ABR thresholds between the two groups before administration(dB)(±s)
Notes:n=6,*P<0.05,**P<0.01.
Group The injected group The control group P Frequency(kHz)4.0 22.67±4.08 22.67±4.08 1.000 8.0 34.17±2.04 33.33±2.58 0.363 16.0 37.50±2.74 39.17±2.04 0.175 24.0 55.00±3.16 55.83±2.04 0.363 32.0 70.83±3.76 70.00±3.16 0.695
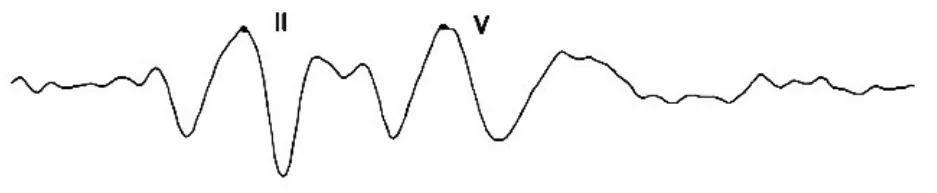
图2 正常状态下巴马小型猪经短纯音刺激所引出的ABR波形Fig.2 ABR wave induced by short pure tone sound in Bama miniature pigs under normal conditions
3.3 给药后小型猪ABR结果
连续7天耳后注射新霉素后,多数小型猪双侧耳经4kHz、8kHz、16kHz短纯音刺激所引出的波形变化不明显。但在24kHz,注射侧耳的ABR阈值明显升高(图3)。在32kHz处,多数小型猪注射侧耳以90dB的声强仍无法引出可重复的波形;其对照侧所引出的波形较给药前亦相对畸形,部分波峰不清晰(图 4)。
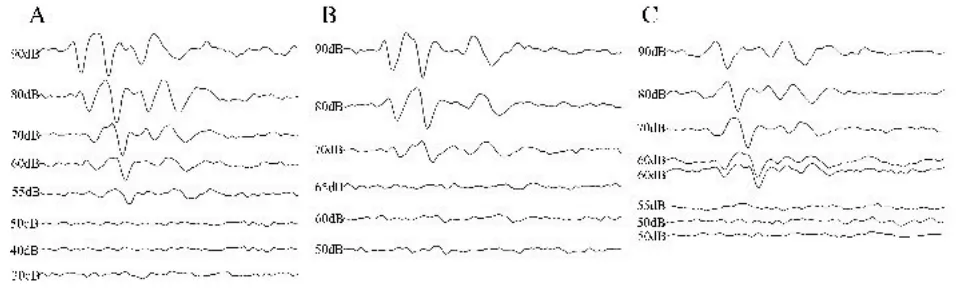
图3 24kHz短纯音引出的小型猪ABR波形图(A给药前;B注射组给药后;C对照组给药后)Fig.3 ABR wave induced by 24kHz short pure tone sound in Bama miniature pigs(A:Before administration;B:Injected group after administration;C:Control group after administration)

图4 32kHz短纯音引出的小型猪ABR波形图(A给药前;B注射组给药后;C对照组给药后)Fig.4 ABR wave induced by 32kHz short pure tone sound in Bama miniature pigs(A:Before administration;B:Injected group after administration;C:Control group after administration)
小型猪双耳给药前后的ABR阈值变化见表3,给药后小型猪注射侧和对照侧耳在24kHz、32kHz处ABR阈值均较给药前显著升高(P<0.01,t检验),在16kHz处注射侧ABR阈值较给药前有显著差异(P<0.01,t检验)。计算每只实验动物双耳各频率给药前后ABR阈值的变化,即为该耳该频率ABR阈移。给药前后,注射侧耳的ABR阈移均值均高于或等于对侧耳,且在16kHz、24kHz、32kHz处存在统计学差异(如表4,P<0.01,t检验);随着频率的增高,双侧耳的ABR阈移均逐渐增大。给药后,小型猪注射侧和对照侧ABR阈值在16kHz、24kHz、32kHz处显著高于对侧(如表5,P<0.01,t检验)。
表3 两组给药前后ABR阈值比较(dB)(±s)Table 3 Comparison of ABR thresholds before and after administration at each frequency in both groups(dB)(±s)

表3 两组给药前后ABR阈值比较(dB)(±s)Table 3 Comparison of ABR thresholds before and after administration at each frequency in both groups(dB)(±s)
Notes:n=6,*P<0.05,**P<0.01.
Group Frequency(kHz)The injected group The control group Before administration After administration P Before administration After administration P 4.0 22.67±4.08 27.50±5.24 0.363 22.67±4.08 26.67±4.08 1.000 8.0 34.17±2.04 35.00±0.00 0.363 33.33±2.58 34.17±3.76 0.363 16.0 37.50±2.74 44.17±2.04 0.001 39.17±2.04 40.00±0.00 0.363 24.0 55.00±3.16 72.50±2.74 0.000 55.83±2.04 63.33±2.58 0.001**32.0 70.83±3.76 98.33±4.08 0.000 70.00±3.16 82.50±2.74 0.000**
表4 两组ABR阈移比较(dB)(±s)Table 4 Comparison of ABR threshold shifts between the two groups(dB)(±s)
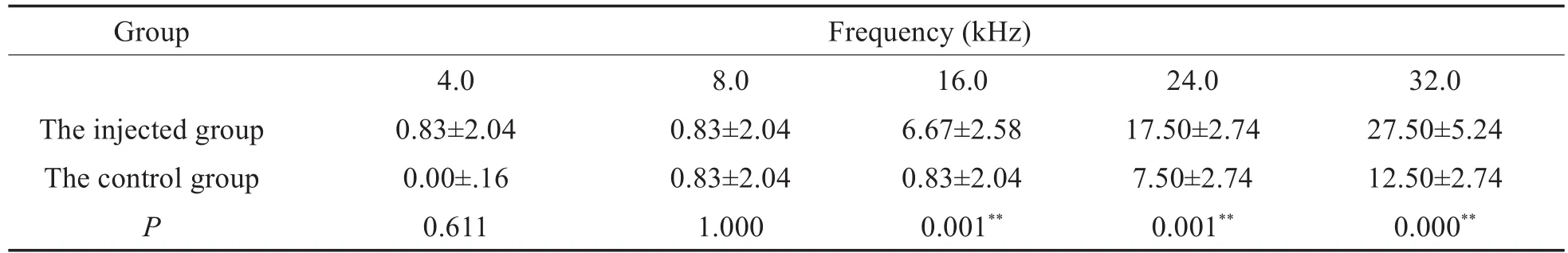
表4 两组ABR阈移比较(dB)(±s)Table 4 Comparison of ABR threshold shifts between the two groups(dB)(±s)
Notes:n=6,*P<0.05,**P<0.01.
Group Frequency(kHz)The injected group The control group P 4.0 0.83±2.04 0.00±.16 0.611 8.0 0.83±2.04 0.83±2.04 1.000 16.0 6.67±2.58 0.83±2.04 0.001**24.0 17.50±2.74 7.50±2.74 0.001**32.0 27.50±5.24 12.50±2.74 0.000**
表5 给药后两组ABR阈值比较(dB)(±s)Table 5 Comparison of ABR thresholds between the two groups after administration(dB)(±s)
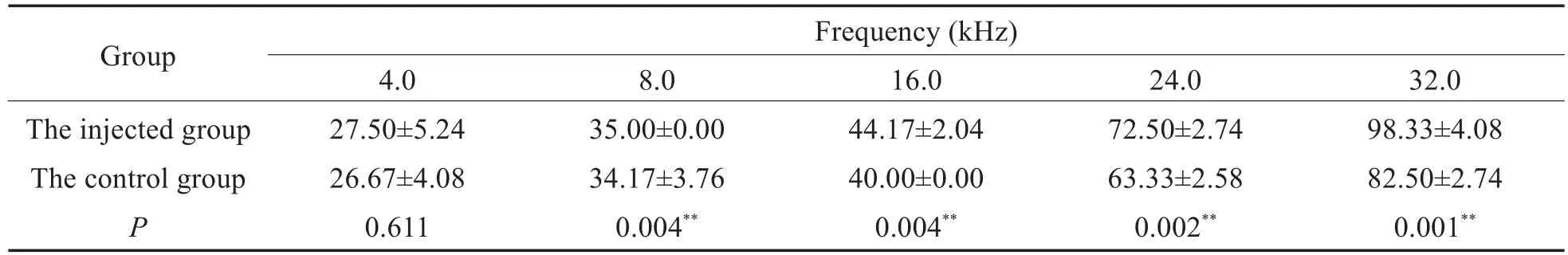
表5 给药后两组ABR阈值比较(dB)(±s)Table 5 Comparison of ABR thresholds between the two groups after administration(dB)(±s)
Notes:n=6,*P<0.05,**P<0.01.
Group The injected group The control group P Frequency(kHz)4.0 27.50±5.24 26.67±4.08 0.611 8.0 35.00±0.00 34.17±3.76 0.004**16.0 44.17±2.04 40.00±0.00 0.004**24.0 72.50±2.74 63.33±2.58 0.002**32.0 98.33±4.08 82.50±2.74 0.001**
3.4 毛细胞形态学观察
DAPI染色下,给药后注射侧外毛细胞三层结构基本存在,外毛细胞核绝大部分存在,结构尚清晰,较对侧排列略显紊乱(图5A,B)。Phalloidin染色下,给药后注射侧耳蜗可见个别外毛细胞缺失,且存留的外毛细胞其纤毛结构呈现紊乱、融合成团等特点,排列不规则,尤其以底转为明显,部分外毛细胞的纤毛结构几不可辨;而对侧耳蜗顶转外毛细胞纤毛结构清晰,排列整齐,仅底转部分外毛细胞的纤毛结构稍模糊(图5C-F)。

图5 给药后小型猪外毛细胞形态(A注射侧;B对侧;C注射侧,耳蜗底转;D对侧,耳蜗底转;E注射侧,耳蜗顶转;F对侧,耳蜗顶转。蓝色:DAPI;红色:phalloidin)Fig.5 The morphology of the outer hair cell of miniature pigs after administration(A:Injected group;B:Controlled group;C:Injected group,the base turn of the cochlear;D:Controlled group,the base turn of the cochlear;E:Injected group,the apical turn of the cochlear;F:Controlled group,the apical turn of the cochlear.Blue:DAPI;red:phalloidin)
4 讨论
突发性聋、梅尼埃病等内耳疾病是导致听力下降的重要原因,其发病率逐年升高,严重影响患者生活质量,造成巨大医疗负担[1,2]。研究表明,这些内耳疾病多以单耳起病:95.1-99.6%的突发性聋患者表现为单侧聋[16];大多数梅尼埃病患者在最初被诊断时仅累及单侧耳,45-47%的患者最终会发展成双侧梅尼埃病[1,17,18]。但现有听力损伤动物模型多为双侧聋[19],与突发性聋、梅尼埃病等内耳疾病的发病特点有一定差异。本实验以巴马小型猪为研究对象,通过乳突骨膜下注射新霉素,成功建立单侧聋模型,为进一步探索单侧听力下降的发病机制及治疗手段提供研究工具。
本研究选择巴马小型猪作为建立单侧药物性聋模型的实验动物。小型猪体型较普通猪小,且在解剖结构、病理生理和遗传等方面与人类颇为相似,因此被广泛应用于多个生物医学研究领域[20]。近年来,研究表明,小型猪中耳及内耳形态结构与人类极其类似,且听力学资料稳定[3,4],是耳科学基础研究的理想实验动物。与之相比,小型啮齿类动物虽有繁殖周期短、易于操控等优点,但其颅骨较小,且中耳、内耳器官形态及遗传背景均与人类有较大差异,对人类疾病代表性有限[19]。尹海金、郭维维等人研究表明,小型猪存在乳突气房系统,其气化程度相当于人类板障型乳突气房[21];而豚鼠和大鼠颞骨乳突部仅为骨壁,缺乏与人类似的乳突气房结构[22,23]。因此前者更可能模拟出人体进行耳后给药后的药物浓度分布情况及毛细胞受损程度,在耳后给药及单侧聋研究领域具有独特优势。
本实验中,研究者首次在小型猪身上尝试耳后给药的方式,发现连续7天每天进行单侧颞骨乳突部骨膜下注射硫酸新霉素100mg/kg后,小型猪双耳ABR听阈均有升高,且注射侧耳ABR阈值上升程度明显高于对侧耳(P<0.01,t检验),注射后双侧耳ABR阈值在16kHz、24kHz、32kHz处有显著差异(P<0.01,t检验),耳蜗基底膜铺片可观察到注射侧耳蜗外毛细胞的纤毛结构受损重于对侧,成功建立小型猪单侧药物性聋模型。耳后给药是一种新型局部给药方式,是指依据药物水溶性或脂溶性将药物直接注射至颞骨乳突区的骨膜下或颞肌内[9]。既往研究表明,相比于腹腔注射或肌肉注射,耳后给药可以在注射侧内耳达到更高的药物浓度,且持续时间较长,在全身血液循环中浓度较低[13,24,25]。依据以往在小型啮齿类动物中的研究,我们推测新霉素可能通过局部直接渗透、乙状窦-内淋巴囊途径、全身血液循环等途径进入内耳[13,25-27]。本研究中耳后注射新霉素后小型猪双耳均出现一定程度的听力损失,且患侧听力损失大于对侧听力损失,注射侧耳蜗外毛细胞的纤毛结构受损重于对侧,说明小型猪双侧内耳均有新霉素分布,但患侧内耳局部药物浓度可能高于对侧内耳。研究者曾尝试对比新霉素耳后给药与全身给药对小型猪听功能及毛细胞的损伤,但在进行新霉素100mg/kg肌肉注射后,2只实验动物均未存活。
耳毒性药物的全身毒性反应是建立药物性聋动物模型的挑战,一旦高于药物安全剂量,实验动物死亡率高。本研究采用的新霉素是一类广泛使用的氨基糖甙类抗生素,它可以造成动物耳蜗外毛细胞损伤以及不可逆听力损害[28]。但氨基糖苷类抗生素神经毒性和肾毒性均明显,单次大量给药可造成呼吸麻痹而急性致死,且全身用药时肾毒性一般早于耳毒性发生[15,29],因此,为了保证动物存活,局部给药是必要的。本研究选择的局部给药剂量远高于全身给药时的最大安全剂量,但所有实验动物均未观察到呼吸麻痹、少尿等表现,且给药前后静脉血肌酐及尿素氮水平无统计学差异,证明本实验采用的造模方式较为安全。
本研究存在一些不足之处,由于样本量较小,小型猪新霉素给药剂量和给药时间与对小型猪听力影响的变化有待进一步探究,后续研究中可以继续增大药物剂量或延长给药和观察时间,观察是否发生进一步听力下降。
5 结论
总之,单侧颞骨乳突部骨膜下注射硫酸新霉素可以造成小型猪双耳高频听力损伤,注射侧听阈显著高于对侧,是理想的单侧药物性聋动物模型。
