水稻叶早衰突变体es33的鉴定和基因定位
2022-10-29郭铧艳叶胜海翟荣荣朱国富俞法明巫明明张小明
郭铧艳 叶胜海 翟荣荣 朱国富 俞法明 巫明明 叶 靖 张小明, *
(1 浙江师范大学生命科学学院,浙江 金华 321004;2 浙江省农业科学院作物与核技术利用研究所,浙江 杭州 310021)
叶片是植物进行光合作用的主要器官。水稻生长和发育过程中由叶片提供能量和营养,其过早衰老会直接影响植株的光合作用和呼吸作用。早期叶片衰老情况下,叶绿体破坏,叶绿素降解,光合色素含量急剧降低导致叶片颜色从绿色变为黄色、棕色和枯萎[1],有的出现衰老斑点;衰老的同时伴随着其他细胞器的解体[2],水解酶活性升高、数量增多,加剧水解反应,导致可溶性蛋白含量降低[3]、rRNA和tRNA的合成减少[4],细胞内活性氧清除系统功能紊乱导致大量的活性氧[5]、自由基和丙二醛等有害物质积累,导致细胞膜被破坏,加剧衰老[6]。抽穗期水稻籽粒灌浆的营养物质主要来源于叶片的光合作用,水稻叶片早衰导致光合作用和呼吸作用下降,叶片功能期缩短,严重影响籽粒发育[7-8],导致产量与品质下降[9-11]。
水稻叶片提前进入衰老状态即叶片早衰突变,为研究早衰及抗衰提供了丰富的材料和理论基础。叶片早衰突变体分为叶片黄化、白化、有斑点等几大类[12]。水稻叶片早衰多由一对隐性核基因控制,根据基因的功能将其分为叶绿素合成与降解途径相关基因(OsSRLK[13]、OsPSE1[14]和OsPAO[15]等)、叶绿体发育相关基因(YPD1[16]、ELL1[17]、WGL5[18]、WLS5[19]、RLS3[20]和RLS1[21]等)、光合系统相关基因(PSL50[22])、蛋白质合成、降解及转运途径相关基因(SPL7[23]、SPL28[24]、ESL1[25]和LPS1[26]等)、细胞衰老凋亡相关基因(ES2[18]、OsNAP[27]和OsLED[6]等)、调控植物激素相关基因(LLB[28]、YL3[29]和OsDOS[30]等)、其他途径相关基因(PLS5[31]等)。其中OsSRLK基因通过参与激素介导通路降解叶绿素,在水稻叶片衰老过程中起重要作用;OsPSE1基因突变导致叶绿素缺失,叶片黄化枯死;OsPAO和OsRCCR1基因分别编码一个脱镁叶绿素加氧酶和红色叶绿素代谢产物还原酶,这两种酶是叶绿素降解途径中的关键酶,在叶片衰老过程中酶活性显著上调;YPD1基因调控叶绿体发育,基因突变导致植株分蘖期叶片早衰,细胞内活性氧积累,光合色素水平较低,叶绿体异常;ELL1基因参与叶绿体发育进程,基因突变导致植株叶绿体降解,叶片中H2O2和胼胝质积累,DNA降解严重、细胞异常死亡;WGL5基因编码的蛋白是一个1-脱氧-D-木酮糖-5-磷酸合酶,该酶主要作用在卡尔文循环中,对植物光合作用影响较大,WGL5基因突变导致叶绿体异常发育,导致植株早期白化;PSL50基因通过调控光合系统的稳定以及光合胁适性,在水稻叶片衰老和热胁迫响应中起双重调控作用;SPL7基因编码一种热胁迫转录因子,对还原型辅酶Ⅱ(nicotinamide adenine dinucleodite phosphate, NADPH)氧化酶有调节作用,对蛋白去磷酸化的信号传导通路有调控作用;ESL1基因编码黄嘌呤脱氢酶,通过调节尿素的含量影响植物的生长发育;LPS1是一种泛素结合酶,参与ABA的代谢途径;ES2基因编码肌醇多磷酸激酶OsIPK2,调控细胞凋亡,控制叶片衰老;OsNAP基因通过茉莉酸通路实现对叶片衰老的调控;LLB基因直接或间接抑制茉莉酸和油菜素内酯介导的反应,影响水稻的防卫反应和生长应答,调控水稻叶片的衰老;YL3基因编码转录因子OsNAC109,直接调控衰老和激素相关基因的转录,影响内源激素水平,影响衰老进程;OsDOS基因通过参与茉莉酸甲酯和细胞分裂素调控过程,从而调控叶片早衰;PLS5基因通过调控淀粉合成代谢途径调控叶片淀粉积累。目前已经克隆的水稻叶片早衰基因用来研究高产优质稻米仍不够,还需要深入了解叶片早衰基因的调控机制,为培育出抗早衰水稻新品种提供材料。
早衰突变体es33是由常规单季晚粳稻浙粳99经过甲基磺酸乙酯(ethyl methane sulfonate,EMS)化学诱变而来,在杭州和海南试验基地进行多代种植,受环境影响小、突变性状稳定,突变体从播种后第10天开始出现早衰表型,第2和第3叶的叶尖干枯变白,衰老持续到成熟期。本试验对早衰突变体es33(earlysenescence33)的衰老进程、衰老指标进行鉴定,并定位早衰基因ES33以及后续基因功能研究,旨在为培育抗早衰新品种提供参考。
1 材料与方法
1.1 试验材料
浙江省农业科学院作物与核技术利用研究所和浙江勿忘农种业股份有限公司选育的常规单季晚粳稻浙粳99经过化学试剂EMS处理诱变得到早衰突变体es33,在海南和杭州经过连续多代种植,使早衰性状稳定遗传。2019年7月在浙江省农业科学院海宁基地以es33为母本,分别与野生型浙粳99、籼稻明恢86杂交得到F1种子;将F1种子播种于浙江省农业科学院海南陵水南繁育种基地,F1自交,2020年4月得到F2种子,同年5月于浙江海宁基地播种F2种子,得到F2遗传群体和定位群体。
1.2 早衰表型分析和成熟期农艺性状的调查
1.2.1 早衰表型分析 取适量饱满的突变体es33和野生型浙粳99的种子分别放于牛皮纸种子袋中,置于装满清水的发芽盒常温下浸泡48 h,催芽48 h后播种于大田,播种后每天上午10:00左右到稻田随机观察并记录突变体es33和浙粳99的生长情况,观察期为一个月,记录突变体es33早衰开始时间,并拍照。
1.2.2 农艺性状的调查 于成熟期随机选取突变体es33和野生型浙粳99植株各10株,分别测量株高、穗长、粒长和粒宽,调查单株分蘖数、每穗粒数和每穗实粒数,计算结实率,称取千粒重,共10次重复,记录并用SPSS 22软件分析数据,分析突变体与野生型之间的差异。
1.3 光合色素含量和叶绿素荧光动力学参数的测定
1.3.1 光合色素含量的测定 苗期、分蘖初期和分蘖盛期,上午10:00在大田取突变体es33和浙粳99植株各3株,取相同部位的叶片0.1 g,剪成2 mm×2 mm左右的小片置于14 mL的离心管中,加入10 mL 95% 的乙醇,避光条件下置于4℃冰箱中浸提48 h,8 000×g高速离心5 min,UV-2550紫外可见分光光度计(日本岛津)分别测量665、649和470 nm 3个波长处上清液的吸光度值,3次重复,利用Lichtenthaler[32]修正的公式计算叶片单位鲜重叶绿素a(chlorophyll a, Chla)、叶绿素b(chlorophyll b, Chlb)、类胡萝卜素(carotenoid, Car)含量,取平均值:
Chla含量=(13.95×OD665-6.88×OD649)V/1 000W
(1)
Chlb含量=(24.96×OD649-7.32×OD665)V/1 000W
(2)
Car含量=(1 000×OD470+811.74×OD665-2 851.32×OD649)/245
(3)。
Chla含量、Chlb含量和Car含量单位为mg·g-1。V为叶绿素提取液总体积,mL;W为叶片鲜重,g。
1.3.2 叶绿素荧光动力学参数的测定 从大田取分蘖盛期突变体es33和野生型浙粳99植株各3株,黑暗处理20 min,使用PAM-2500 Imaging 叶绿素荧光快速成像仪(德国Walz)和Imaging win软件处理和分析叶绿素荧光各项参数并成像,将待测植株相同部位的叶片放在仪器的镜头下,测定PSII最大能转化效率(maximum photochemical,Fv/Fm)、光损伤程度Y(NO)值并成像,3次重复。
1.4 叶绿体超微结构的观察和光合指标的测定
1.4.1 叶绿体超微结构的观察 大田环境下突变体es33叶片出现早衰表型时,分别取突变体es33和野生型浙粳99相同部位的叶片,用手术刀切成2 mm×2 mm的小片,浸入2.5%戊二醛溶液,抽真空固定,4℃过夜;用0.1 mol·L-1的磷酸缓冲液(pH值7)漂洗样品3次,每次15 min;用1%锇酸溶液固定1~2 h后;经过0.1 mol·L-1的磷酸缓冲液(phosphate buffered saline, PBS)漂洗3次,依次用梯度浓度(30%、50%、70%、80%)的酒精脱水,每个浓度处理15 min后过渡到90%和95%丙酮溶液中脱水,分别处理15 min,最后用纯丙酮处理2次,每次20 min。用同等体积Spurr包埋剂与丙酮混合液处理1 h,再用Spurr包埋剂与3倍体积丙酮混合液处理3 h。用纯包埋剂Spurr处理样品过夜。将经过渗透处理过的样品包埋,70℃加热过夜,使用EM UC7超薄切片机切片(德国徕卡)(每片70~90 nm),柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液双重染色10 min 后干燥过夜,用H-7650透射电子显微镜(日本日立)观察叶绿体超微结构,采集图像。
1.4.2 光合指标的测定 于分蘖盛期,选择天气晴朗、光合作用稳定的上午10:00,在田间用LI-6400XT便携式光合作用测量系统(美国Li-COR)分别测定突变体es33和野生型浙粳99植株相同部位叶片的净光合速率(μmol CO2·m-2·s-1)、气孔导度(mmol·m-2·s-1)、胞间CO2浓度(μmol·mol-1)和蒸腾速率(g·(m-2·h-1),5次重复,取平均值,用SPSS 22软件独立样本T检验分析数据。
1.5 早衰生理指标测定
分蘖盛期,大田中分别取3株突变体es33和野生型浙粳99相同部位的叶片,迅速放入液氮中,用生物检测试剂盒(苏州格锐思生物科技有限公司)分别测定鲜重0.1 g叶片中丙二醛(malonaldehyde,MDA)含量、过氧化氢(hydrogen peroxide,H2O2)含量、过氧化氢酶(catalase,CAT)活性、过氧化物酶(peroxidase,POD)活性、超氧化物歧化酶(superoxide dismutase,SOD)活性、超氧阴离子(superoxide anion,OFR)含量和超氧阴离子产生速率,3次重复,取平均值。
1.6 遗传分析和基因定位
1.6.1 遗传分析 以野生型浙粳99为母本,与稳定遗传的早衰突变体es33杂交获得F1种子,F1植株自交得到F2种子;播种F2种子,构建遗传群体,观察并统计F1和F2植株表型性状分离情况,并进行遗传分析。
1.6.2 基因定位 以稳定遗传的早衰突变体es33为母本,以籼稻明恢86为父本,杂交获得F1种子,F1植株自交得到F2种子;后播种F2种子,构建F2基因定位群体。
从F2定位群体中选择570株具有早衰突变表型的单株作为定位植株,用CTAB法[33]分别提取母本、父本和F2早衰植株叶片DNA;根据浙江省农业科学院作物与核技术利用研究所常规稻实验室己有的均匀分布在水稻12条染色体上174对简单重复序列(simple sequence repeat, SSR)分子标记,通过PCR扩增和聚丙烯酰胺凝胶电泳,用10个早衰单株进行多态筛选和初步定位,确定叶片早衰基因ES33定位区间,之后在RiceVarMap(http://ricevarmap.ncpgr.cn/)设计Indel引物,用560个早衰单株进行精细定位。其中PCR扩增体系总计10 μL:2 × Taq master mix酶5 μL、目的DNA 1 μL、正、反向引物各1 μL、ddH2O 2 μL。PCR扩增程序为:95℃预变性5 min,94℃变性1 min,56℃退火45 s,72℃延伸1 min,32个循环;72℃延伸6 min,产物于4℃条件下保存。
1.7 基因重测序、候选基因的分析及尿酸含量的测定
1.7.1 基因重测序 在精细定位的基础上,取早衰突变体es33苗期叶片,由北京诺禾致源生物信息科技有限公司完成基因ES33的重测序工作。
1.7.2 候选基因的分析 在利用分子标记和基因组重测序的基础上,筛选到候选基因,设计候选基因突变位点测序引物(见附表1),在野生型浙粳99和早衰突变体es33之间进行PCR扩增和测序验证。引物合成和测序工作由杭州擎科生物技术有限公司完成。
1.7.3 尿酸含量的测定 分蘖盛期,分别取3株突变体es33和野生型浙粳99相同部位的叶片,放入液氮中,用Grace尿酸含量生物检测试剂盒测定鲜重0.1 g叶片中尿酸含量,3次重复。
1.8 基因突变位点氨基酸序列比对分析和同源性分析
在NCBI(https://www.ncbi.nlm.nih.gov/)网站上获取不同物种的ES33基因cDNA序列及蛋白质黄嘌呤脱氢酶(XANTHINE DEHYDROGENASE,XDH)氨基酸序列,筛选出与水稻同源性较高的22个物种的氨基酸序列,用MEGA 7.0进行序列比对,构建系统发育树。
2 结果与分析
2.1 早衰突变体es33的表型特征及农艺性状分析
与野生型相比,叶片早衰突变体es33在播种后第10天出现早衰表型,第2和第3叶的叶尖干枯,到第28天除了新叶,其他叶片的叶尖均出现干枯现象(图1),成熟后,对突变体和野生型进行农艺性状统计分析,结果显示,与野生型(WT)浙粳99相比,突变体es33的株高、单株分蘖、穗长、每穗粒数、每穗实粒数、结实率和千粒重都极显著降低,粒宽显著降低,而粒长无显著差异(表1)。成熟期突变体es33植株整株叶片基本干枯,穗明显比沂粳99短小(图2)。

注:A、B、C、D分别是播种后第10、第14、第21和第28天野生型浙粳99和早衰突变体es33的表型。Note: A, B, C and D are the phenotypes of Zhejing 99 and early senescence mutant es33 at the 10th, 14th, 21th and 28th days after sowing.图1 早衰突变体es33和浙粳99苗期表型Fig.1 Seedling phenotypes of early senescence mutant es33 and Zhejing 99

表1 早衰突变体es33和浙粳99的农艺性状Table 1 Agronomic traits of early senescence mutant es33 and Zhejing 99

注:A:成熟期株型对比;B:成熟期叶形对比;C:成熟期穗型对比;D:成熟期粒型对比。Note: A: Comparison of plant type at maturity. B: Comparison of leaf shape at maturity. C: Comparison of panicle type at maturity. D: Comparison of grain shape at maturity.图2 早衰突变体es33和浙粳99成熟期表型Fig.2 Maturity phenotypes of early senescence mutant es33 and Zhejing 99
2.2 早衰突变体es33光合色素含量和叶绿素动力学参数分析
2.2.1 光合色素含量变化分析 为了确定早衰突变体es33叶尖干枯表型是否由光合色素含量变化导致,测定了大田环境下生长的野生型浙粳99和早衰突变体es33在苗期、分蘖初期和分蘖盛期时相同部位叶片光合色素含量。结果显示(图3),早衰突变体es33在苗期,即早衰表型出现时期,叶绿素a和叶绿素b的含量分别显著低于野生型18%和37%,类胡萝卜素的含量无明显变化,表明早衰突变体es33的叶尖早衰退绿表型主要由叶绿素a和叶绿素b含量下降所致;类胡萝卜素的含量无明显下降,导致叶尖发黄。分蘖初期,早衰突变体es33的叶绿素a、叶绿素b和类胡萝卜素含量分别显著低于野生型26%、9%和26%,差异均达极显著水平。分蘖盛期,早衰突变体es33的叶绿素a、叶绿素b和类胡萝卜素含量分别显著低于野生型43%、48%和34%。上述结果表明,从苗期开始,突变体es33伴随着光合色素含量的下降,以及随着生长进程的推进,早衰逐渐严重,光合色素含量下降程度逐渐加大,由此推测突变体es33叶尖早衰表型与光合色素含量下降有关。

图3 早衰突变体es33和浙粳99不同生长时期光合色素含量Fig.3 Photosynthetic pigment contents of early senescence mutant es33 and Zhejing 99 at different growth stages
2.2.2 叶绿素荧光动力学参数分析 在光合色素含量显著下降的基础上,为了比较野生型浙粳99与早衰突变体es33叶片之间光合效率的差异,在分蘖盛期对突变体和野生型进行了叶绿素荧光动力学参数的测定。其中Fv/Fm是最大光化学量子产量,亦称最大PSII的光能转换效率,Y(NO)是光损伤的重要标志,Y(NO)值越大,表明入射光超过了植物能接受的程度,植物已经受到损伤或者继续照光的植物将受到损伤。结果显示,与野生型浙粳99相比,早衰突变体es33 的Fv/Fm显著降低(图4),表示光转换效率越低,Y(NO)值显著增大,表明es33受到损伤较严重,早衰特征明显。

注:A:分蘖盛期野生型和es33叶片Fv/Fm;B:分蘖盛期野生型和es33叶片Y(NO);C:分蘖盛期野生型和es33叶片叶绿素荧光动力学参数对比。Note: A: Wild type and es33 leaf Fv/Fm in tillering stage. B: Leaf Y(NO)of wild type and es33 in tillering stage. C: Histogram of comparison of chlorophyll fluorescence dynamic parameters between wild type and es33 leaves at tillering stage.图4 早衰突变体es33和浙粳99分蘖盛期叶绿素荧光动力学参数Fig.4 Chlorophyll fluorescence kinetics parameters of early senescence mutant es33 and Zhejing 99 at tillering stage
2.3 早衰突变体es33叶绿体超微结构的变化和光合指标分析
2.3.1 叶绿体超微结构变化分析 为了探究早衰突变体es33发生早衰的过程中伴随的叶绿体超微结构变化,在苗期突变体es33开始出现早衰表型时,用透射电镜观察了野生型和突变体叶绿体的超微结构。结果显示,野生型浙粳99叶绿体形状规则,基粒数较多,类囊体片层结构排列紧密有序,早衰突变体es33叶绿体发育畸形、形状不规则,基粒数明显减少,类囊体疏松紊乱,嗜锇颗粒明显增多、变大(图5),推测叶片早衰表型与叶绿体发育不正常有关。

注:A、B、C为野生型浙粳99叶绿体超微结构图;D、E、F为早衰突变体es33叶绿体超微结构图;G为基粒;OG为嗜锇颗粒。Note: A, B, and C are the chloroplast ultrastructure of the wild type Zhejing 99. D, E, and F are the chloroplast ultrastructure of the early senescence mutant es33. G: Grana. OG: Osmophilic gramules.图5 早衰突变体es33和浙粳99分蘖盛期叶绿体超微结构Fig.5 Chloroplast ultrastructure of early senescence mutant es33 and Zhejing 99 at tillering stage
2.3.2 光合指标变化分析 分蘖盛期,与野生型浙粳99相比,早衰突变体es33叶绿体结构发生了变化,推测其光合性能受到影响,用光合作用测量系统测得分蘖盛期野生型和突变体的光合指标,结果如表2所示。突变体es33净光合速率极显著低于野生型,气孔导度显著低于野生型,蒸腾速率显著低于野生型,胞间CO2浓度与野生型无显著差异,说明叶绿体结构的变化进一步影响了突变体es33的光合性能。

表2 早衰突变体es33和野生型浙粳99的光合性能Table 2 Photosynthetic properties of early senescence mutant es33 and wild type Zhejing 99
2.4 早衰突变体es33早衰生理指标变化分析
为了得知变体es33植株胞内有害物质和活性氧含量的变化,检测了突变体和野生型各项生理指标。结果显示,突变体es33的MDA、H2O2、OFR等有害物质的含量极显著高于野生型(图6),CAT活性、POD活性、SOD活性极显著低于野生型,说明突变体细胞已受到极大的损伤。

图6 早衰突变体es33和浙粳99分蘖盛期生理指标Fig.6 Physiological parameters of early senescence mutant es33 and Zhejing 99 at tillering stage
2.5 早衰突变体es33遗传分析和基因ES33的定位
2.5.1es33的遗传分析 为了分析突变体es33早衰表型的遗传特性,将其与野生型浙粳99杂交,观察F1和F2表型,并统计数量。结果显示,F1植株均为野生型表型,没有出现早衰现象,F2植株出现早衰性状分离,总株数为2 196株,其中正常表型株数为 1 655 株,早衰表型株数为541株,用SPSS软件卡方检验进行遗传分析,结果显示(表3),正常植株与早衰植株的分离比符合3∶1的孟德尔分离定律,说明es33受单隐性核基因控制。

表3 es33突变基因的遗传分析Table 3 Genetic analysis of es33 mutant gene
2.5.2 早衰基因ES33的定位 根据实验室己有的均匀分布在水稻12条染色体上的174对SSR标记和后续设计的9对InDel分子标记对早衰基因ES33进行定位,通过PCR扩增和聚丙烯酰胺凝胶电泳,用10个早衰单株进行多态筛选和初步定位,将基因ES33初步定位在水稻第3号染色体上,用8对InDel引物对560个早衰单株连锁分析,最终将该基因定位在STS-15(17.9 Mb)和G24(18.8 Mb)标记之间(图7),物理距离为0.9 Mb(图7)。

注:n:群体大小。Note: n: Number of group.图7 早衰基因ES33定位图Fig.7 Map of the early senescence gene ES33
2.6 早衰基因ES33重测序、突变位点及尿酸含量变化分析
2.6.1 早衰基因ES33重测序 通过基因定位得到的精细区间(17.9~18.8 Mb)位于3号染色体的着丝粒(17.7~20.2 Mb)上,着丝粒位于染色体的异染色质区域,该区域含有大量DNA重复序列,通常认为该区域是转录沉默区,限制了进一步的精细定位,因此借助全基因组重测序的方法将候选基因暂定为LOC_Os03g31550。
2.6.2 早衰基因ES33突变位点分析 基因测序结果发现,用日本晴和野生型浙粳99作为对照,突变体es33中基因LOC_Os03g31550编码区第11个外显子出现4个碱基AACA缺失,造成移码突变。突变体es33的氨基酸序列与野生型浙粳99的氨基酸序列比对显示碱基缺失造成的移码突变导致翻译提前终止(图8)。

注:突变体es33和野生型浙粳99的碱基序列比对图(上)和氨基酸序列对比图(下)。Note: Comparison of base sequence (top) and amino acid sequence (bottom) of mutant es33 and wild type Zhejing 99.图8 早衰基因ES33突变位点分析Fig.8 Mutation locus analysis of early senescence gene ES33
2.6.3 早衰突变体es33和野生型浙粳99尿酸含量变化分析 由National Center for Biotechnology Information(NCBI)数据库得知,基因ES33(LOC_Os03g31550)编码黄嘌呤脱氢酶(xanthine dehydrogenase, XDH),该酶在植物细胞中参与重要的酶促反应,催化黄嘌呤和次黄嘌呤生成尿酸。本研究测得突变体es33分蘖盛期叶片中尿酸含量极显著低于野生型浙粳99(图9),说明突变体中该酶促反应被阻滞,推测基因ES33突变导致蛋白XDH结构的改变,造成酶活性降低,酶促反应受阻。

图9 早衰突变体es33和浙粳99分蘖盛期尿酸含量Fig.9 Uric acid content of early senescence mutant es33 and Zhejing 99 at tillering stage
2.7 早衰基因ES33的同源性分析
用NCBI筛选出与水稻同源性较高的22个物种的氨基酸序列,对水稻(Oryzasativa)和二穗短柄草(Brachypodiumdistachyon)、乌拉尔图小麦(Triticumurartu)、山羊草(Aegilopstauschiisubsp)、狗尾草(Setariaviridis)、高粱(Sorghumbicolor)、玉米(Zeamays)、油菜(Brassicarapasubsp)、野大豆(Glycinesoja)、黍(Panicummiliaceum)、拟南芥(Arabidopsisthaliana)、豌豆(Pisumsativum)、葡萄(Vitisvinifera)、芭蕉(Musaacuminatasubsp)、油棕(Elaeisguineensis)、大叶藻(Zosteramarina)、茶(Camelliasinensis)、木豆(Cajanuscajan)、江南卷柏(Selaginellamoellendorffii)、原壳小球藻(Auxenochlorellaprotothecoides)、克里藻(Klebsormidiumnitens)和超微藻(Bathycoccusprasinos)中蛋白系统发育树分析显示(图10),水稻中ES33基因与二穗短柄草(Brachypodiumdistachyon)、小麦(Triticumurartu)、山羊草(Aegilopstauschiisubsp)等禾本科亲缘关系较近;用DNA MAN软件对水稻与山羊草、二穗短柄草、黍、狗尾草、高粱、小麦和玉米等禾本科作物的氨基酸序列比对结果显示,该基因在进化的过程中蛋白质的氨基酸序列在禾本科作物中高度保守(图11)。

图10 早衰基因ES33的系统发育树Fig.10 Phylogenetic tree of the early senescence gene ES33

图11 不同物种中蛋白ES33的氨基酸序列比对分析Fig.11 Comparative analysis of amino acid sequences of protein ES33 from different species
3 讨论
ES33编码黄嘌呤脱氢酶,该蛋白有一个β折叠和α-β-α核心结构域,在泛素中可以找到相似的结构[34]。在2Fe-2S铁氧还蛋白家族[35]和2Fe-2S铁氧还蛋白相关家族(包括醛还原酶和黄嘌呤脱氢酶)[36]中可以找到类似的结构。醛氧化酶和黄嘌呤脱氢酶都是含有钼辅助因子的酶[37],其共有的锤状结构域是一种进化保守的2Fe-2S铁氧还蛋白结构域[38-39]。该区域为β折叠,是由4个β链和1个β螺旋侧翼组成的β-薄片,由大约100个氨基酸和4个保守的半胱氨酸残基组成,连接2Fe-2S基团。在植物中,活性中心是2Fe-2S团簇,其中2个铁原子由2个无机硫原子和4个保守的半胱氨酸残基提供的硫四面体配位[40]。醛氧化酶是一种同型二聚体,催化醛在氧和水的存在下转化成羧酸和过氧化氢,需要FAD、钼和2个2Fe-2S团簇作为辅助因子;黄嘌呤脱氢酶具有相同的辅助因子,该酶通过蛋白水解酶水解或巯基氧化,不可逆地从脱氢酶形式转化为氧化酶形式,催化黄嘌呤氢化成为次黄嘌呤和尿酸盐[41],这种活性通常存在于具有黄嘌呤氧化酶活性的双功能酶中。研究表明,XDH参与尿素和尿酸的合成,在水稻的各组织中表达,XDH基因沉默造成嘌呤代谢物酰尿类物质缺陷,酰尿类物质是一种有效的活性氧清除剂[42-43],导致植株出现生长延迟等不利的影响[44];XDH活性升高可以催化产生有效的活性氧清除剂,减少自由基对组织和细胞的损伤[45],提高植物抗氧化能力,有效延缓水稻叶片衰老过程,提高产量[46]。因此,XDH可通过调控植株内酰脲的含量[47],影响植物细胞清除ROS的能力,从而影响衰老进程。
本研究中突变体es33分蘖期叶片尿酸含量显著降低,推测由于基因ES33突变导致黄嘌呤脱氢酶的生物合成提前终止,造成XDH活性下调或者结构上的缺陷造成酶促反应受阻,尿酸的合成受阻,尿酸含量降低,加剧了活性氧自由基的积累,从而造成植株的衰老。
本研究发现,叶片早衰突变体es33苗期开始出现叶尖变黄早衰表型,衰老逐渐严重直到成熟期。ES33受一对隐性核基因控制,位于水稻3号染色体上,确定为LOC_Os03g31550,编码XDH,是基因ESL1[25]的等位基因。前人研究表明,XDH具有延缓叶片衰老的功能[45],含有钼辅助因子结合的结构域(455~561 AA),位于第4个外显子,构成底物结合部位和氧化还原部位[48],还存在进化保守结构域(620~727 AA),位于第5和第6个外显子中。基因ESL1的第4个外显子中碱基T的缺失(第558个AA),移码突变导致翻译提前终止,早衰可能是由XDH钼辅助因子结合域不完整和进化保守结构域缺失造成蛋白功能的损坏引起的。ES33第11个外显子出现4个碱基的缺失,造成移码突变(图12)导致蛋白质翻译提前终止。ES33的突变位点不在XDH的功能结构域和保守结构域,蛋白质结构相对比较完整,但是突变体es33出现早衰性状的时间比突变体esl1早,推测基因ES33在调控水稻衰老过程中,除了蛋白质XDH钼辅助因子结合结构域和进化保守结构域以外,还有其他因素起着关键性作用。
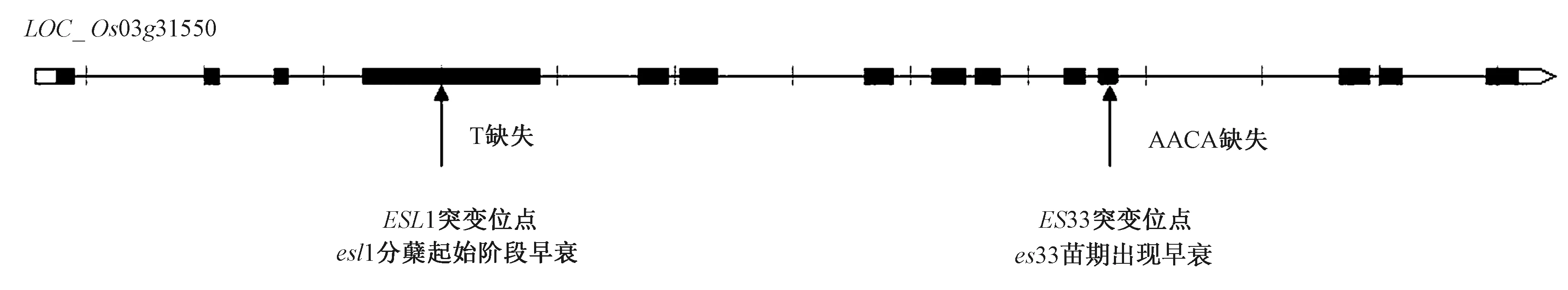
图12 不同突变位点比较Fig.12 Comparison of different mutation sites
迄今为止,黄嘌呤脱氢酶基因对水稻衰老调控的作用机制很少被报道,本研究为进一步明确黄嘌呤脱氢酶基因影响水稻衰老机制奠定了基础,同时为利用早衰分子机制培育出抗衰老新品种提供了依据。
4 结论
本研究发现,由于ES33基因发生碱基缺失突变,导致突变体es33苗期出现早衰表型,分蘖期叶绿体结构发生变化,光合作用减弱,植株衰老持续到成熟期,结实率和千粒重显著下降,产量降低。

附表1 本研究所用引物序列Table S1 Primer sequences used for this study
