大蒜扩展蛋白基因AsEXPA8的分离及其参与渗透胁迫响应的分析
2022-10-29王广龙刘梦婷王云鹏任旭琴陈伯清熊爱生
王广龙 刘梦婷 王云鹏 任旭琴 陈伯清 熊爱生
(1 淮阴工学院生命科学与食品工程学院,江苏 淮安 223003;2 淮阴工学院应用技术学院,江苏 淮安 223003;3 南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室,江苏 南京 210095)
扩展蛋白(expansin,EXP)又称膨胀素,是植物细胞壁的重要组成部分。该物质可以打断细胞壁中纤维素与半纤维素的非共价键,释放细胞壁多聚物的机械张力,继而加强细胞壁的柔韧性,使植物细胞壁松弛和伸展[1-2]。
1992年,在黄瓜(Cucumissativus)细胞壁中首次鉴定得到2个扩展蛋白CsEXP1和CsEXP2。上述蛋白可以在酸性条件下诱导细胞壁的扩展伸长[3]。后续研究发现,扩展蛋白具有一个庞大的基因家族。在植物中发现的扩展蛋白主要分为4类,包括α扩展蛋白(α-expansin,EXPA)、β扩展蛋白(β-expansin,EXPB)、类扩展蛋白A(expansin-like A,EXLA)和类扩展蛋白B(expansin-like B,EXLB)[4]。目前,在许多植物中已经分离得到扩展蛋白基因,如在胡萝卜(Daucuscarota)中获得24个DcEXPA基因、4个DcEXPB基因、1个DcEXLA基因和1个DcEXLB基因[5]。其中,以EXPA的研究较为广泛和深入,其在种子萌发[6]、果实成熟[7]、花粉管发育[8]以及产量形成[9]等植物生命活动中发挥着重要作用。
研究发现,EXPA除参与上述生命活动外,还参与植物应对非生物胁迫的进程。在小麦(Triticumaestivum)中过表达TaEXPA2提高了抗氧化酶的活性,促进了侧根形成,继而增强了植株对干旱的适应性[10];小麦中的TaEXPA8基因可以调控抗氧化酶活性以及可溶性蛋白和脯氨酸含量,增强植株在低温条件下的抗性[11]。在烟草(Nicotianatabacum)中的研究发现,相对于对照,EXPA4过表达植株在干旱和盐胁迫下呈现出更好的生长状态[12]。杨树(Populustomentosa)PtoEXPA12基因影响植株对Cd的吸收和积累,同时也改变了植株对Cd毒害的耐受性[13]。
大蒜(AlliumsativusL.)是重要的蔬菜作物,在世界范围内广泛种植。我国是世界上大蒜种植面积和产量最多的国家,同时也是最大的大蒜消费国[14-15]。但大蒜栽培过程中,容易遭受土壤干旱和盐渍化等非生物胁迫的侵害。挖掘抗逆基因可提高定向选育效率和水平,为高抗大蒜种质创新提供理论依据。鉴于此,本研究从大蒜中分离扩展蛋白基因AsEXPA8,对其进行序列分析,并检测其在大蒜不同组织和渗透胁迫下的表达模式,以期为鉴定该基因的生物学功能,以及为改造大蒜抗逆特性奠定基础。
1 材料与方法
1.1 植物材料及处理
供试大蒜品种为苍山四六瓣,来源于山东兰陵,蒜瓣一般为4~6片,肉质饱满,质地清脆,辣味浓郁,品质较高。
将大蒜蒜瓣分别于2017年10月3日和2018年10月12日播种于蛭石和有机质组成的混合基质(体积比为1∶1)中,分别于20 d(2017年)和16 d(2018年)后将幼苗移至Hogland标准营养液中培养。7 d后进行盐胁迫(200 mmol·L-1NaCl)和模拟干旱胁迫(15% PEG6000)处理,时间为0、1、4和12 h,分别取5株大蒜的叶片、根和蒜瓣进行液氮冻样并保存在 -80℃ 超低温冰箱中,用于后续分析。其中,叶片取样选择第1和第2片叶的中间部位各一半进行混合,根取样选取所有须根的中间部位进行混合,蒜瓣取样选取整个种瓣。
1.2 RNA提取及cDNA合成
采用天根生化科技(北京)有限公司的RNAprep Pure植物总RNA提取试剂盒提取大蒜根、叶片和蒜瓣的总RNA,利用南京诺唯赞生物科技有限公司的HiScriptⅡ QRT SuperMix for qPCR反转录试剂盒将RNA反转录为cDNA。
1.3 大蒜扩展蛋白基因AsEXPA8的克隆
根据淮阴工学院设施蔬菜绿色高效栽培及生理实验室测定的大蒜转录组数据库[16],检索AsEXPA8基因。设计克隆引物AsEXPA8-F(5′-A T G A C T A A C T C A T C T A C T G C C C C TT-3′)和AsEXPA8-R(5′-C T A A A T C T G G C T T C C C T C G A A G G TC-3′),以大蒜苍山四六瓣cDNA为模板进行扩增。根据2×Tag Master Mix试剂盒(南京诺唯赞生物科技有限公司)的说明书进行逆转录PCR(reverse transcription PCR, RT-PCR),扩增产物经琼脂糖凝胶电泳检测,并用琼脂糖凝胶DNA回收试剂盒(大连TaKaRa公司)回收和纯化,连接pMD19-T载体并转化DH5α大肠杆菌,将转化产物均匀涂于溶菌肉汤(lysogeny broth, LB)平板上培养,挑取单菌落进行菌液PCR验证,将阳性菌液送南京金斯瑞生物科技有限公司测序。
1.4 序列分析
采用ExPASy蛋白质组分析工具中的ProtParam软件预测相对分子量和等电点;通过NCBI数据库BLAST功能检索其他植物的EXPA序列,利用MEGA 5.1软件构建同源进化树;使用DNAMAN 6.0软件对预测的AsEXPA8及其他植物的EXPA8氨基酸进行多序列比对;利用Plant-mPLoc server在线软件预测亚细胞定位;采用SignalP 5.0软件进行信号肽预测分析;采用TMHMM 2.0软件进行网上运行分析跨膜结构域;使用STRING网站预测蛋白的相互作用。
1.5 实时荧光定量PCR
以大蒜SAND作为内参基因[17],其表达引物为BD-SAND-F(5′-G C G T C A A C G A A T G T T C C A A T T A C CA-3′)和BD-SAND-R(5′-T C T C T T C A G T C T C A A C T T C A T C A G C AT-3′)。根据从大蒜中分离的AsEXPA8序列设计表达检测引物BD-AsEXPA8-F(5′-C A C G G C G T T G T T C A A T A A T G G A C TT-3′)和BD-AsEXPA8-R(5′-G T A T G C G T T G C T C T G C C A G T T CT-3′)。按照南京诺唯赞生物科技有限公司提供的ChamQ SYBR qPCR Master Mix试剂盒进行实时荧光定量PCR反应,目的基因相对表达水平用2-ΔΔCt法[18]进行计算。
1.6 数据分析
采用Microsoft Office Excel 2019进行数据整理,采用SPSS 24.0软件进行统计分析,并采用Duncan法分析基因表达水平在P=0.05水平上的差异显著性。
2 结果与分析
2.1 大蒜AsEXPA8基因的分离
以大蒜品种苍山四六瓣cDNA为模板,以AsEXPA8-F和AsEXPA8-R为上下游引物进行扩增,得到一条介于750~1 000 bp的产物(图1)。测序结果发现,该基因含有1个774 bp的开放阅读框,编码257个氨基酸(图2)。预测其蛋白质相对分子量为27.75 kDa,理论等电点为7.57。

注:M:DNA分子量标准;1:AsEXPA8基因。Note: M: DNA marker. 1: AsEXPA8 gene.图1 大蒜AsEXPA8基因的RT-PCR扩增图谱Fig.1 RT-PCR amplification pattern of AsEXPA8 gene from garlic

注:*表示终止密码子。Note: * indicate termination codon.图2 大蒜AsEXPA8基因的核苷酸序列及其编码的氨基酸序列Fig.2 Nucleotide acids and deduced amino acid sequences of AsEXPA8 gene from garlic
2.2 大蒜AsEXPA8的进化树分析
采用MEGA 5.1软件中将大蒜AsEXPA8和拟南芥(Arabidopsisthaliana)的20个EXPA一同构建进化树(图3)。结果显示,大蒜AsEXPA8与拟南芥的AtEXPA8(NP_181 593.1)在进化关系上最为接近,并且与AtEXPA2同属于一个分支。

图3 大蒜与拟南芥EXPA氨基酸序列的进化树Fig.3 Phylogenetic tree of EXPA from garlic and Arabidopsis
2.3 大蒜AsEXPA8的氨基酸序列分析
将大蒜AsEXPA8氨基酸序列与拟南芥的AtEXPA8、莴苣(Lactucasativa)的LsEXPA8(XP_023737376.1)、 大桉(Eucalyptusgrandis)的EgEXPA8(XP_010031088.1)、棉花(Gossypiumhirsutum)的GhEXPA8(XP_016729402.1)和大麻(Cannabissativa)的CsEXPA8(XP_030506062.1)等进行比对(图4)。结果发现,来源于不同植物的EXPA8序列高度保守,序列一致性均高于70%,其中,AsEXPA8与大桉和棉花的EXPA8的一致性高达78.38%。AsEXPA8基因推导的氨基酸序列具有典型的扩展蛋白特征,有1个组氨酸-苯丙氨酸-天冬氨酸(His-Phe-Asp,HFD)基序,N端含有8个保守的半胱氨酸(Cys)残基,C端含有4个保守的色氨酸(Trp)残基。

注:红色横线表示保守功能结构域;*表示8个保守的半胱氨酸残基;#表示4个保守的色氨酸残基。Note: Red lines represent the conserved functional domain. * indicates 8 conserved Cys residues. # indicates 4 Trp residues.图4 AsEXPA8与其他植物EXPA的氨基酸序列比对Fig.4 Alignment of the deduced amino acid sequences of AsEXPA8 and EXPA from other plants
2.4 亚细胞定位、信号肽和跨膜结构域预测
用Plant-mPLoc server对AsEXPA8进行亚细胞定位预测,结果发现,AsEXPA8主要存在于细胞壁中。用SignalP 5.0检测到第1到第30个氨基酸的一段信号肽,序列为M T N S S T A P S S K N T L F L F L F S L Y Y L T T S I FA(图5)。进一步通过ExPASy中的在线工具TMHMM 2.0对AsEXPA8进行跨膜结构域预测,结果表明,在AsEXPA8氨基酸中存在1个跨膜结构域,在第13和第35个氨基酸之间(图6)。

图5 大蒜AsEXPA8信号肽预测分析Fig.5 Signal peptide prediction of garlic AsEXPA8
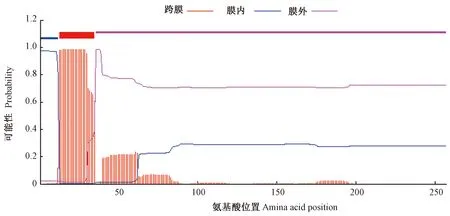
图6 大蒜AsEXPA8氨基酸序列的跨膜结构域预测Fig.6 Transmembrane domain prediction of amino acid sequences of the garlic AsEXPA8
2.5 大蒜AsEXPA8的蛋白相互作用网络
通过STRING在线网站,以拟南芥AtEXPA8为模板构建了AsEXPA8的蛋白相互作用网络(图7)。结果发现,EXPA8可与细胞壁重构相关的木葡聚糖内转糖苷酶/水解酶15(xyloglucan endotransglucosylase/hydrolase protein 15,XTH15)和果胶裂解酶超家族蛋白(pectin lyase-like superfamily protein,AT3G07010/AT5G63180)作用。激素响应蛋白如赤霉素调节蛋白6(gibberellin-regulated protein,GASA6)、小生长素上调RNA(small auxin up RNA,SAUR)SAUR26和SAUR15也与EXPA8作用密切。螺旋-转角-螺旋(helix-loop-helix,HLH)转录因子多效唑抗性(paclobutrazol resistance,PRE)蛋白PRE1和PRE5也参与了EXPA8的蛋白作用网络(图7)。

图7 大蒜AsEXPA8的蛋白相互作用网络预测Fig.7 Prediction of protein-protein interaction network of garlic AsEXPA8
2.6 大蒜AsEXPA8基因在渗透胁迫条件下的表达分析
采用实时荧光定量PCR技术检测大蒜AsEXPA8基因在模拟干旱胁迫和盐胁迫条件下的表达特性(图8)。AsEXPA8在各组织中均可以表达,且盐胁迫和干旱胁迫均显著诱导了AsEXPA8转录水平的变化。
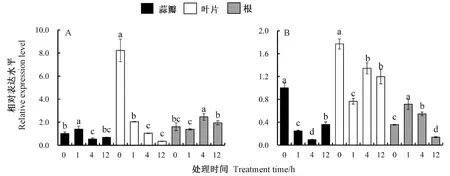
注:A:15% PEG6000; B:200 mmol·L-1 NaCl。相同组织内不同字母表示在P<0.05水平差异显著。Note: A: 15% PEG6000. B: 200 mmol·L-1 NaCl. Different lowercase letters in the same tissue represent significant differences at 0.05 level.图8 大蒜AsEXPA8基因在模拟干旱胁迫(A)和盐胁迫(B)下的表达Fig.8 Expression profiles of garlic AsEXPA8 gene under simulated drought stress(A) and salt stress(B)
由图8-A可知,干旱胁迫处理1 h后,AsEXPA8在蒜瓣中的表达水平升至最高,之后随着胁迫时间的延长,转录水平下降;叶片中的AsEXPA8基因表达水平在PEG6000诱导后呈持续下降的趋势,至处理12 h时较对照降低了95.79%;根中的AsEXPA8转录水平在干旱胁迫处理呈先升高后下降的趋势,并在处理4 h时达到最高。由图8-B可知,盐胁迫处理后,AsEXPA8基因在蒜瓣中的表达水平呈现先下降后升高的趋势,在处理4 h时最低;在叶片中,AsEXPA8基因在盐胁迫诱导后迅速下降,之后立即升高,且显著低于对照;盐胁迫后根中的AsEXPA8基因表达水平在处理1 h时迅速升至最高,为对照的1.97倍。
3 讨论
渗透胁迫指由于环境因素导致植物不能充分吸水甚至失水的一种现象,会对作物的产量和品质造成重大威胁,严重时可导致植株死亡。常见的渗透胁迫因素有干旱、盐害及冻害等[19-20]。细胞壁是细胞抵御外界环境变化的第一层屏障。研究逆境条件下细胞壁及其重构关键基因的响应特征对于作物抗逆育种和栽培实践具有重要意义[21-22]。本研究从大蒜中克隆了1个编码细胞壁关键组分扩展蛋白的基因AsEXPA8,对其序列特征和在渗透胁迫条件下的表达进行了分析,研究结果为大蒜等作物抗逆育种提供了理论依据。
植物中的扩展蛋白一般分为4类,而在大蒜中尚鲜见关于扩展蛋白结构及其功能的报道。本研究中分离的扩展蛋白属于EXPA类,含有1个组氨酸功能域HFD基序,8个保守的半胱氨酸(Cys)残基和4个保守的色氨酸(Trp)残基,具备扩展蛋白的典型特征。另外,本研究鉴定的AsEXPA8含有一段信号肽,并具有跨膜结构域,这可能与其功能行使具有重要关系[1-2]。蛋白互作网络结果显示,本研究鉴定的AsEXPA8可能与其他细胞壁组分共同参与细胞壁重构,同时其可能受到赤霉素、生长素和油菜素内酯等激素信号的调控[23-25],说明激素可通过调节植物细胞壁的重构,参与植物响应逆境的过程,这为改造植物细胞壁结构和特性以及诱导植物抗逆性提供了新的方向。
前人研究表明,扩展蛋白基因在植物体内不同组织中具有特异的表达模式。拟南芥中AtEXPA1在保卫细胞中特异表达,其可通过控制保卫细胞结构调节气孔开度[26]。在向日葵(Helianthusannuus)中的研究发现,子房、种皮和胚中扩展蛋白基因的特异表达可能与其产量形成密切相关[27]。本研究中AsEXPA8基因在叶片中表达较高,说明其可能参与大蒜叶片发育的过程。越来越多的研究表明,扩展蛋白基因可能在植物应对外界环境变化的过程中发挥重要作用。拟南芥中过表达月季(Rosahybrida)RhEXPA4基因改变了叶片表皮结构、叶绿素含量和侧根生长,继而提高了植株在逆境环境条件下的抗性[28]。水稻(Oryzasativa)中的Osexpa7基因可以通过钠离子转运、活性氧清除以及细胞壁松弛等过程调控植株在盐胁迫下的生长[29]。这些研究结果表明,扩展蛋白可能通过改变细胞壁结构,调节植株对外界环境变化的适应性。本研究鉴定的AsEXPA8能够同时响应干旱和盐胁迫,说明其可能参与大蒜植株抵御或适应干旱和盐胁迫的过程。后续研究可以聚焦于明确该基因的具体功能和作用机制,并挖掘其在大蒜等作物抗逆育种中的潜力。
4 结论
大蒜AsEXPA8基因开放阅读框全长774 bp,编码的蛋白含有257个氨基酸,具有扩展蛋白典型的HFD基序,N端和C端分别含有8个保守的半胱氨酸残基和4个保守的色氨酸残基。干旱和盐胁迫在不同组织内均诱导了AsEXPA8基因的表达,说明其可能参与了大蒜植株应对渗透胁迫的过程,具体的作用机制仍需进一步鉴定。
