莓茶多酚、黄酮、黄酮醇类组分含量及抑菌分析
2022-10-18冯湘沅杨琦谢纯良成莉凤郑科刘志远段盛文彭源德
冯湘沅,杨琦,谢纯良,成莉凤,郑科,刘志远,段盛文,彭源德
(中国农业科学院麻类研究所,湖南 长沙 410205)
金黄色葡萄球菌、大肠杆菌和痢疾杆菌等细菌广泛存在于自然环境中,是最常见的致病和腐败微生物,食物一旦被这些细菌污染产生毒素,人类食用后将会引发中毒,所以在食品加工、储藏过程中经常要用到防腐剂[1-2],防腐剂是一种用来抑制微生物生长和繁殖的物质。目前,常用的防腐剂有苯甲酸、山梨酸、对羟基苯甲酸酯等,过量使用也会导致损害人类的身体健康。随着我国科学技术水平的不断提高,以安全性、绿色环保的植物提取物作为天然防腐剂得到许多研究与应用[3-4]。据文献资料显示,植物存在抑菌活性且促进健康作用的主要成分有多酚、黄酮、黄酮醇类物质[5-7]。因此,寻找高含量抑菌有效成分植物具有重要意义。
莓茶为葡萄科蛇葡萄属落叶藤本植物,叶片表面分布有零星白色类似“霉”点,口感先苦、回味甘甜,药理学研究表明其具有抗氧化、抗菌、降血糖、降血压、护肝等作用[8]。近年来,辛敏等[9]开展了对绿茶、黄茶、白茶、青茶、红茶、黑茶中多酚含量测定及其抑菌活性的研究,陈然等[10]分析了乌龙茶、普洱生茶、普洱熟茶等不同种类茶叶多酚及生物碱含量特点,张甜甜等[11]进行了对茅岩莓茶中黄酮类化合物提取工艺的分析,但针对莓茶相关化合物及抑菌活性研究鲜见报道。
目前常见的多酚、黄酮、黄酮醇类物质提取工艺有溶剂提取法、超声辅助萃取法和高效液相色谱法等[12-14],故本文对莓茶采用加入70%乙醇,超声波辅助提取,再依次经石油醚、乙酸乙酯萃取制成的醇提萃取液以及醇提剩余后的残渣水解液进行多酚、黄酮、黄酮醇类组分总含量测定,同时对醇提萃取液开展抑菌活性分析,旨在以莓茶开发为防腐剂及资源利用提供一定的基础依据。
1 材料与方法
1.1 材料与试剂
莓茶:湖南省张家界农科所提供;金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、痢疾杆菌(Shigella dysenteroae):北京北纳创联生物技术研究所;没食子酸:美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Dionex Ultimate 3000液相色谱仪、1510型全波长酶标仪:赛默飞世尔科技公司;FZ102型粉碎机:天津泰斯特仪器有限公司;FE28型pH计:梅特勒-托利多仪器(上海)有限公司;KQ-500DB型数控超声波仪:昆山超声仪器有限公司;SW-CJ-2FD型超净工作台:苏州净化设备有限公司;ZQZY-A8型恒温振荡培养器:上海知楚仪器有限公司;3K15型高速冷冻离心机:德国Sigma公司;R1001-VN型旋转蒸发仪:郑州长城科工贸有限公司;SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 样品制备
1.3.1.1 醇提萃取液
莓茶经50℃烘干、粉碎后,过20目筛;准确称取莓茶粉末5.0 g,加入150 mL 70%乙醇溶液[料液比为1 ∶30(g/mL)],60℃恒温超声90min,冷却至室温(25℃);之后移入离心管于9 000 r/min离心10 min,收集上清液,再经蒸发浓缩,依次用石油醚、乙酸乙酯萃取、干燥(40℃)后获得萃取物,准确称取一定量的萃取物用40%丙酮溶液溶解,用于多酚、黄酮、黄酮醇类组分含量测定;同时将醇提萃取液分别稀释成质量浓度为2、4、6、8、10、20 mg/mL 溶液,用于抑菌性能测定。
1.3.1.2 残渣水解液
参照程安玮等[15]的方法并略作修改,取醇提后剩余的残渣干燥,精确称重,按1∶10(g/mL)料液比加入甲醇-硫酸(体积比9∶1)混合溶液,85℃回流水解4 h,3 000 r/min离心10 min,除去沉淀,收集上清液,用于多酚、黄酮、黄酮醇类组分含量测定。
1.3.2 多酚含量的测定
参照谢倩等[16]Folin-Ciocalteu法测定。
标准品的配制:精确称取没食子酸2.0 mg,溶解定容于10 mL容量瓶中,配成0.2 mg/mL没食子酸标准品溶液。并分别稀释成 0.02、0.04、0.06、0.08、0.10、0.12 mg/mL标准品溶液用于标准曲线测定。
标准品溶液的测定:取2 mL超纯水加入0.5 mL福林酚试剂,再加入0.1 mL标准品溶液混匀,静置3 min后加入0.9 mL 20%Na2CO3溶液,避光2 h,765 nm处测吸光度。
样品多酚含量测定方法同标准品溶液的测定。
多酚质量浓度ρ1(mg/mL)按没食子酸标准曲线所得的线性回归方程进行计算;按公式(1)计算多酚含量(w1),以质量分数(mg/g)计。

式中:ρ1为多酚质量浓度,mg/mL;n为样品稀释倍数;v 为总体积,mL;ρ1为粉末质量,g。
1.3.3 黄酮含量的测定
参照Xu等[17]的方法并略作修改。
标准品的配制:精确称取芦丁10.0 mg,用甲醇溶液溶解定容于10 mL容量瓶中,配成1mg/mL芦丁标准品溶液。并分别稀释成 0.2、0.4、0.6、0.8、1.0 mg/mL 用于标准曲线测定。
标准品溶液的测定:取1 mL标准品溶液加入1 mL 5%NaNO2溶液混匀反应6 min,再加入1 mL 10%Al(NO3)3溶液混匀,反应6min,最后加入3mL4%NaOH溶液混匀,静置12 min,在510 nm处测吸光度。
样品黄酮含量测定方法同标准品溶液的测定。
黄酮质量浓度ρ2(mg/mL)按芦丁标准曲线所得的线性回归方程进行计算;按公式(2)计算黄酮含量(w2),以质量分数(mg/g)计。

式中:ρ2为黄酮质量浓度,mg/mL;n为样品稀释倍数;v为总体积,mL;m表示粉末质量,g。
1.3.4 黄酮醇类组分含量的测定
混合标准液配制:准确称取异槲皮素2.5 mg、杨梅素 96 mg、槲皮素 1.68 mg、山奈酚 1.4 mg、异鼠李素1.2 mg,混合、甲醇溶液超声溶解,定容至100 mL,同时将溶液浓度进行梯度稀释,0.45 μm滤膜过滤,用于高效液相色谱检测,并绘制标准曲线建立线性回归方程。
取2 mL样品用0.45 μm滤膜过滤,用于高效液相色谱检测。
组分质量浓度ρ3(mg/mL)按组分标准曲线所得的线性回归方程进行计算;按公式(3)计算组分含量(w3),以质量分数(mg/g)计。

式中:ρ3为组分质量浓度,mg/mL;v 为总体积,mL;m为粉末质量,g。
1.3.5 高效液相色谱法检测条件
色谱柱为Thermo Hypersil BDS C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇 ∶0.4%磷酸=55 ∶45(体积比);紫外检测波长为360 nm;流速为0.8 mL/min;柱温为 25℃;进样量为20 μL。
1.3.6 抑菌试验
1.3.6.1 培养基配制
液态培养基:蛋白胨10.0 g/L、酵母提取物5.0 g/L、氯化钠10.0g/L混合,分装,121℃高压蒸汽灭菌20min;固态培养基:在液态培养基配方中加入琼脂20.0 g/L,121℃灭菌20 min后,取适当体积倒入无菌平皿,冷却,备用。
1.3.6.2 菌种活化
将金黄色葡萄球菌、大肠杆菌、痢疾杆菌分别接入装有5 mL液体培养基试管中,于37℃恒温振荡培养器培养20 h后,再取培养液稀释涂布于固态培养基平皿,然后将平皿倒置于37℃生化培养箱培养,直至出现菌落。
1.3.6.3 菌液制备
取1个菌落接入盛有5 mL液体培养基的试管中,摇匀,置于37℃、150 r/min恒温振荡培养器培养6 h后,全部倒入至盛有100 mL液体培养基的三角瓶中,继续培养6 h后,再取6 mL接入300 mL液体培养基的三角瓶中培养12 h。采用稀释分离法,将菌液浓度调节约为107CFU/mL。
1.3.6.4 纸片制备
将普通定性滤纸用打孔机制成直径为6 mm圆形纸片,经121℃高压灭菌20 min后,干燥(60℃)备用。
1.3.6.5 纸片扩散法测定抑菌透明圈直径
在无菌条件下,取0.2 mL菌液,均匀涂布于固态培养基表面,接着用无菌镊子夹取纸片贴于此固态培养基表面,然后取20 μL样品放入纸片上,37℃培养18 h,观察并准确测量透明圈直径。同时设置CK(40%丙酮溶液)阴性、链霉素阳性对照。
透明圈直径>7 mm,判定为有抑菌效果;透明圈直径≤7 mm,判定为无抑菌效果[18],直径越大抑菌效果越强。
1.3.6.6 最小抑菌浓度测定
接种培养法测定最小抑菌浓度:取0.1 mL样品加入到盛有0.8 mL液体培养基的试管中,接入0.1 mL菌悬液,摇匀,37℃培养18 h后,观察试管中液体培养基菌生长情况,以样品能抑制细菌生长的最低浓度作为最小抑菌浓度,同时设置空白阴性、链霉素阳性对照。
1.3.7 抑菌稳定性检测
1.3.7.1 紫外线照射时间对醇提萃取液的抑菌稳定性影响
参照罗晓东等[19]的方法进行测定。将醇提萃取液(质量浓度为20 mg/mL)于紫外灯(波长为253.7 nm)下分别照射10、20、30、60 min后,采用纸片扩散法测定其抑菌透明圈直径。
1.3.7.2 pH值对醇提萃取液的抑菌稳定性影响
参照任先伟等[20]的方法,略作修改。用0.1 mol/L NaOH和0.1 mol/L HCl将醇提萃取液(质量浓度为20 mg/mL)的 pH 值分别调节为 3、5、7、9、11,采用纸片扩散法测定其抑菌透明圈直径。
1.3.7.3 温度对醇提萃取液的抑菌稳定性影响
参照陈佳佳等[21]的方法,略作修改。将醇提萃取液(质量浓度为 20 mg/mL)分别于 40、60、80、100、120℃条件下处理30 min后,采用纸片扩散法测定其抑菌透明圈直径。
1.3.7.4 金属离子对醇提萃取液的抑菌稳定性影响
参照张媛媛[22]的方法,略作修改。以醇提萃取液(质量浓度为20 mg/mL)为溶剂分别配制成0.05 mol/L的 NaCl、KCl、CaCl2、FeCl3、MgSO4溶液,静置 3 h,采用纸片扩散法测定其抑菌透明圈直径,并以CK(未经处理的醇提萃取液)作对照。
1.4 数据处理
试验数据均取平均值±标准差表示,同时采用Excel 2016、Origin 2020b和SPSS 19.0软件进行数据处理并分析。
2 结果与分析
2.1 多酚含量测定
采用Folin-Ciocalteu法对各浓度没食子酸标准品溶液测定得到的标准曲线见图1。
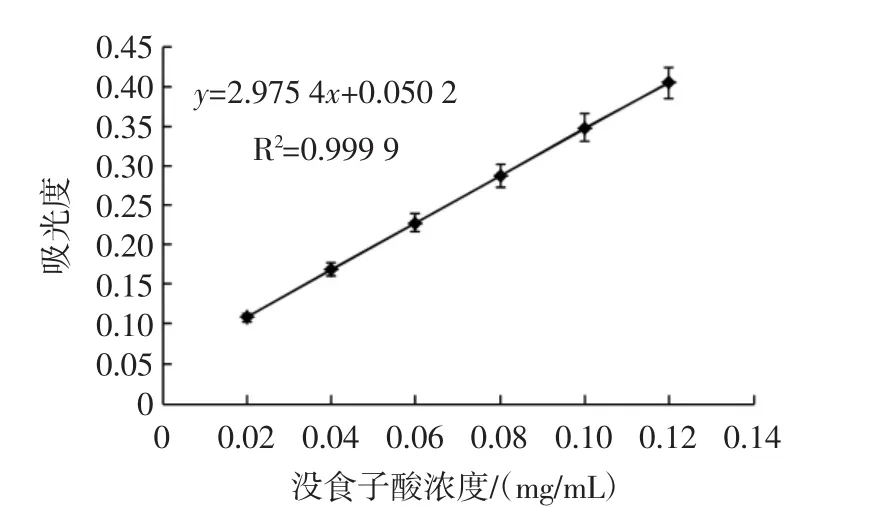
图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
由图1可知,没食子酸标准曲线线性回归方程为y=2.975 4x+0.050 2(R2=0.999 9),其中:y为吸光度;x为没食子酸标准品溶液浓度(mg/mL)。根据没食子酸线性回归方程和公式(1)计算得出表1莓茶中多酚含量。

表1 莓茶中多酚含量测定Table 1 Content of polyphenols in Mei-tea(Ampelopsis grossedentata)
由表1可知,莓茶醇提萃取液、残渣水解液中多酚含量分别为293.38、174.84 mg/g,多酚总含量达到468.22 mg/g。
2.2 黄酮含量测定
利用Al(NO3)3显色法对各浓度芦丁标准品溶液测定得到的标准曲线见图2。
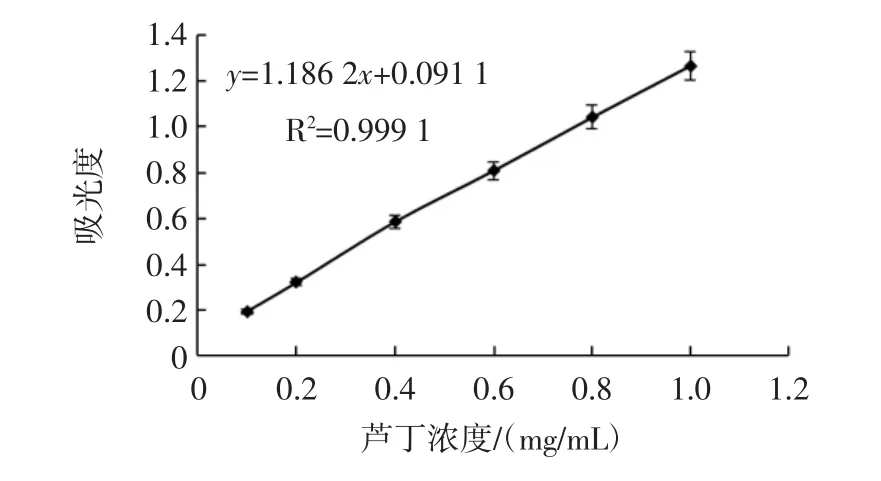
图2 芦丁标准曲线Fig.2 Standard curve of rutin
由图2可知,芦丁标准曲线线性回归方程为y=1.186 2x+0.091 1(R2=0.999 1),其中:y为吸光度;x为芦丁标准品溶液浓度(mg/mL)。根据芦丁线性回归方程和公式(2)计算得出表2莓茶中黄酮含量。

表2 莓茶中黄酮含量测定Table 2 Content of flavonoids in Mei-tea(Ampelopsis grossedentata)
由表2可知,莓茶醇提萃取液、残渣水解液中黄酮含量分别为154.13、112.05 mg/g,黄酮总含量达到266.18 mg/g。
2.3 黄酮醇类组分及含量测定
采用高效液相色谱检测分析标准品溶液,以浓度(x,mg/mL)与检测得到的峰面积(y)所制作的线性回归方程分别为异槲皮素y=691.28x+0.711,R2=0.998 3;杨梅素 y=651.99x+14.635,R2=0.999 3;槲皮素 y=1 221.7x-4.216 8,R2=0.997 0;山奈酚 y=1 155.5x-3.037 9,R2=0.996 3。
通过高效液相色谱仪检测得出的莓茶中黄酮醇类组分色谱图见图3,含量测定见表3。
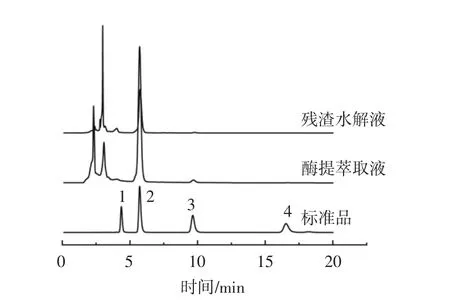
图3 莓茶中黄酮醇类组分色谱图Fig.3 Chromatograms of flavonols in residue hydrolysates of Meitea(Ampelopsis grossedentata)
根据各组分线性回归方程及公式(3)计算,对照黄酮醇类组分标准品色谱图(图3)分析可知,莓茶醇提萃取液、残渣水解液中均含有异槲皮素、杨梅素、槲皮素、山奈酚等黄酮醇类组分,各组分总含量分别为异槲皮素 0.34 mg/g、杨梅素 45.14 mg/g、槲皮素 1.86 mg/g、山奈酚0.21 mg/g,两者提取液组分含量均以杨梅素最高,其次为槲皮素,结果表明,莓茶均含有黄酮醇类物质,且各组分的含量差异明显。
2.4 抑菌测定
通过纸片扩散法测得抑菌透明圈直径统计结果见表4。
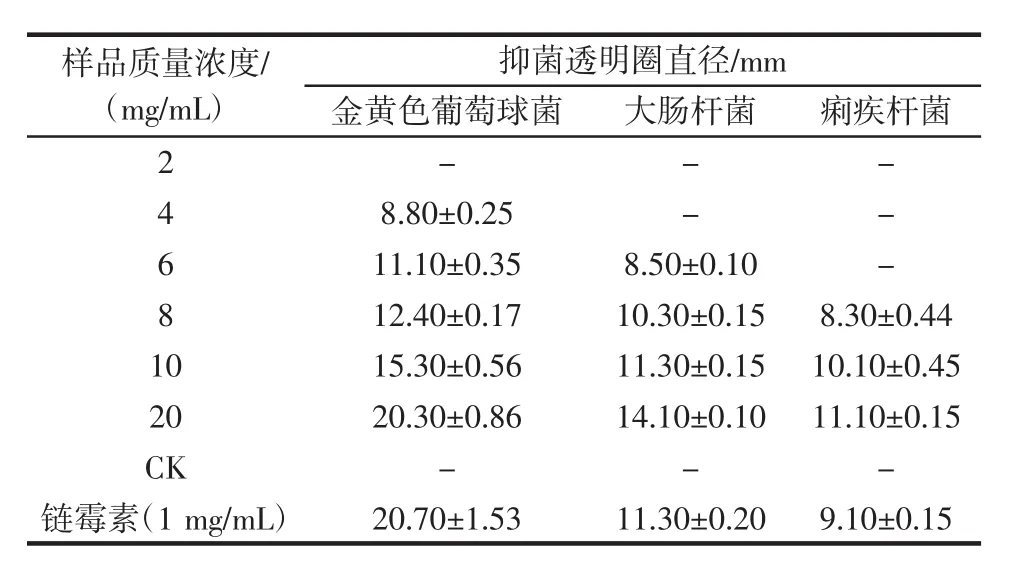
表4 莓茶醇提萃取液抑菌活性测定Table 4 Antibacterial effect of alcohol extract of Mei-tea(Ampelopsis grossedentata)
由表4可知,随着莓茶醇提萃取液质量浓度的升高,对3个菌株的抑菌透明圈直径逐渐变大。当莓茶醇提萃取液质量浓度为20 mg/mL时,对金黄色葡萄球菌、大肠杆菌、痢疾杆菌的抑菌透明圈直径分别达到20.30、14.10、11.10 mm,与对照相比,莓茶醇提萃取液对3个菌株能发挥抑制作用,其中对金黄色葡萄球菌的抑制能力最强。
2.5 最小抑菌浓度测定
由接种培养法观察得到莓茶醇提萃取液能抑制细菌生长,统计结果见表5。

表5 莓茶醇提萃取液最小抑菌浓度测定Table 5 Minimum inhibitory concentration of alcohol extract of Mei-tea(Ampelopsis grossedentata)
由表5可知,莓茶醇提萃取液对金黄色葡萄球菌、大肠杆菌、痢疾杆菌的最小抑制浓度分别为6、8、10 mg/mL。
2.6 抑菌稳定性检测
2.6.1 紫外线照射时间对醇提萃取液的抑菌稳定性影响
经不同时间紫外线照射的抑菌透明圈直径统计结果见图4。
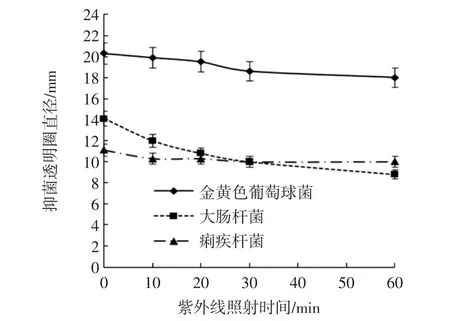
图4 紫外线对莓茶醇提萃取液抑菌稳定性影响Fig.4 Influence of UV on antibacterial stability of alcohol extract of Mei-tea(Ampelopsis grossedentata)
由图4可知,莓茶醇提萃取液(质量浓度为20mg/mL)紫外线照射0~60 min,对金黄色葡萄球菌的抑菌透明圈直径由20.30 mm下降到18 mm;对大肠杆菌的抑菌透明圈直径由14.10 mm下降到8.80 mm;对痢疾杆菌的抑菌透明圈直径由11.10 mm下降到10 mm。结果表明,莓茶醇提萃取液随着紫外线照射时间的延长,对金黄色葡萄球菌、大肠杆菌的抑菌透明圈直径呈现持续减小的趋势,而对痢疾杆菌抑菌透明圈直径影响不明显。说明莓茶醇提萃取液经紫外线照射下对3个菌株均有抑制作用,特别对痢疾杆菌的抑制稳定性较强。
2.6.2 pH值对醇提萃取液的抑菌稳定性影响
不同pH值处理对醇提萃取液的抑菌透明圈直径统计结果见图5。

图5 pH值对莓茶醇提萃取液抑菌稳定性影响Fig.5 Influence of pH on antibacterial stability of alcohol extract of Mei-tea(Ampelopsis grossedentata)
由图5可知,莓茶醇提萃取液(质量浓度为20 mg/mL)对金黄色葡萄球菌、大肠杆菌、痢疾杆菌抑制效果较强的pH值分别为5、9、7,抑菌透明圈直径分别为19.9、13.1、10.7 mm。当pH值为11时,其对3个菌株的抑制效果均已出现减弱现象,但抑菌透明圈直径均保持在7 mm以上。表明pH值处理对莓茶醇提萃取液有一定的影响,但不会使抑菌活性消失。
2.6.3 温度对醇提萃取液的抑菌稳定性影响
不同温度处理对醇提萃取液的抑菌透明圈直径统计结果见图6。

图6 温度对莓茶醇提萃取液抑菌稳定性影响Fig.6 Influence of temperature on antibacterial stability of alcohol extract of Mei-tea(Ampelopsis grossedentata)
由图6可知,莓茶醇提萃取液(质量浓度为20 mg/mL)对金黄色葡萄球菌、大肠杆菌、痢疾杆菌的抑制效果变化规律均为处于40℃~80℃时抑菌效果平稳,之后随着温度的升高,抑制效果持续减弱。当经温度40、120℃分别处理后,莓茶醇提萃取液分别对金黄色葡萄球菌抑菌透明圈直径由19.0 mm(40℃)减小到15.0 mm(120℃);对大肠杆菌抑菌透明圈直径由11.1mm(40℃)下降到8.0 mm(120℃);而对痢疾杆菌抑菌透明圈直径由10.7 mm(40℃)减小到 9.5 mm(120℃),变化幅度较小。通过结果发现,在温度低于80℃时,莓茶醇提萃取液对3个菌株的抑制效果均较强,之后随着温度的升高,抑菌透明圈直径逐渐变小,但直径均大于7 mm,表示莓茶醇提萃取液在高温处理下仍能保持一定的抑菌效果。
2.6.4 金属离子对醇提萃取液的抑菌稳定性影响
不同金属离子处理对醇提萃取液的抑菌透明圈直径统计结果见图7。

图7 金属离子对莓茶醇提萃取液抑菌稳定性影响Fig.7 Influence of metal ions on antibacterial stability of alcohol extract of Mei-tea(Ampelopsis grossedentata)
由图7可知,莓茶醇提萃取液(质量浓度为20 mg/mL)在一定浓度金属离子处理下,对金黄色葡萄球菌抑菌透明圈直径大小表现为 Ca2+>Mg2+>K+>Na+>Fe3+,对大肠杆菌抑菌透明圈直径大小表现为 Ca2+>K+>Mg2+>Na+>Fe3+,对痢疾杆菌抑菌透明圈直径大小表现为Ca2+>K+>Mg2+>Na+>Fe3+。通过对金属离子处理与 CK(未作处理样品)的抑菌透明圈直径相比,发现经金属离子处理的莓茶醇提萃取液抑菌活性均有所下降,其中受Fe3+影响最为明显,但抑菌透明圈直径均在7 mm以上。结果表明,在 Na+、Ca2+、K+、Fe3+、Mg2+金属离子处理下莓茶醇提萃取液均能对此3个菌株发挥不同程度抑制作用。
3 讨论与结论
本研究是对莓茶采用加入70%乙醇溶液、60℃恒温超声90 min条件下收集上清液,再经旋转蒸发浓缩,然后依次经石油醚、乙酸乙酯萃取制成的醇提萃取液以及残渣干燥的水解液通过Folin-Ciocalteu法、Al(NO3)3显色法测得莓茶中多酚、黄酮总含量分别为468.22、266.18 mg/g;高效液相色谱检测出黄酮醇类组分——异槲皮素、杨梅素、槲皮素、山奈酚,相应总含量分别为 0.34、45.14、1.86、0.21 mg/g。
据文献报道,多酚、黄酮、黄酮醇类物质具有广谱的抑菌活性,如辛敏等[9]研究了黄茶、绿茶、青茶、红茶、黑茶、白茶6种茶叶提取物多酚对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、蜡样芽孢杆菌的抑制效果,当粗提物浓度为25 mg/mL时,6种茶叶提取物多酚对金黄色葡萄球菌、大肠杆菌的抑制效果最优的均为绿茶,其对相应菌种抑制透明圈直径分别为16.7、13.3mm。而本研究结果显示,莓茶醇提萃取液质量浓度20 mg/mL时对金黄色葡萄球菌、大肠杆菌、痢疾杆菌的抑制透明圈直径分别能达到20.30、14.10、11.10 mm,与辛敏等[9]的研究相比,莓茶醇提萃取液多酚对金黄色葡萄球菌、大肠杆菌的抑制效果要强于6种茶叶多酚;张子龙等[23]、范三红等[3]分别研究指出了茉莉花茶、藜麦糠黄酮具有抑菌性;张杨等[24]、Sharma等[25]分别评价了黄酮醇类组分——杨梅素、槲皮素存在体内抗菌、抗炎作用。
莓茶含有较丰富的抑菌有效成分——多酚、黄酮和黄酮醇类物质,其中黄酮醇类是以杨梅素为主要组分;抑菌活性大小排序为抑制金黄色葡萄球菌效果>抑制大肠杆菌效果>抑制痢疾杆菌效果;对金黄色葡萄球菌、大肠杆菌、痢疾杆菌的最小抑菌浓度分别为6、8、10 mg/mL;经不同的温度、紫外线照射时间、pH 值和金属离子处理下对3个菌株所产生的抑制透明圈直径均大于7 mm,仍表现出较好的抑菌活性和稳定性。这一结论与上述文献研究中的多酚、黄酮和黄酮醇类物质具有一定的抑菌作用相吻合。因此,莓茶是天然防腐剂开发利用的潜在资源。
