橙黄硬皮马勃菌种的分离纯化及其菌根的人工合成
2022-09-26张珊珊杨文忠
张珊珊,杨文忠
(云南省林业和草原科学院 a.国家林业和草原局云南珍稀濒特森林植物保护和繁育重点实验室;b.云南省森林植物培育与开发利用重点实验室,云南 昆明 650201)
菌根(Mycorrhiza)是真菌与植物根系形成的具有特殊结构和功能的共生体[1-4],形成菌根的真菌称为菌根菌,其中具有食用价值的菌根菌统称为菌根食用菌(edible mycorrhizal fungi,EMF)[5]。为实现EMF 的驯化栽培,人工促进菌根合成的关键在于合成高质量的菌根苗[6]。为了保证目的菌根的成功“合成”,菌种的分离纯化和栽培基质的筛选显得尤为重要[7]。
橙黄硬皮马勃Scleroderma citrinum,隶属硬皮马勃科Sclerodermataceae 硬皮马勃属Scleroderma[8-9]。该属共25 种,为外生菌根担子菌,常形成网状到棘状球状孢子,被称为“土球”。硬皮马勃属分布于世界各地的热带、温带和亚热带生态系统[10],在亚洲[11-16]、欧洲[17-19]、北美洲[20]和南美洲[21]均有报道,其中在中国有11 个种。作为国内广泛分布的一种菌根食用菌,通常以腐生物的形式出现在土壤或带有苔藓的腐殖质上,有时也出现在腐烂的木头上,常见于针叶林和混交林内,与云南松等多种乔木形成外生菌根,建立互惠共生关系。该菌常出现在云南的一些集贸市场上,深受人们的喜爱。研究发现,该菌具有微毒,孢粉有消炎和抗氧化作用[22],子实体总浸膏提取物对3 龄黏虫及家蝇成虫具有较强触杀活性,同时对细菌和病原真菌均有不同程度的抑制作用[23-24]。目前关于该菌的管理、保护以及仿生栽培方面的研究都少有涉及,尤其是菌种分离培养和菌根合成研究方面未见报道。
为实现橙黄硬皮马勃的栽培与可持续利用,本研究从橙黄硬皮马勃菌种的分离纯化及其菌根的人工合成着手,以橙黄硬皮马勃子实体作为组织分离纯化对象,经ITS 序列验证研究对象是否为橙黄硬皮马勃;然后使用分离得到的菌种接种云南松无菌苗,检测不同栽培基质条件下的菌根合成情况,确定适宜云南松菌根合成的栽培基质,为定向培育云南松的菌根化苗木提供理论依据。
1 材料与方法
1.1 供试材料
橙黄硬皮马勃子实体于2020年8月购买自本地的农贸市场,选择完整、无虫蛀腐烂的新鲜子实体,备用。云南松种子采自昆明树木园内的云南松一代种子园。
1.2 培养基
综合PDA 培养基:马铃薯200 g,葡萄糖20 g,磷酸二氢钾3 g,硫酸镁1.5 g,维生素B110 mg,琼脂18 g,1 000 mL 去离子水,pH 值自然。

图1 橙黄硬皮马勃子实体Fig.1 Fruiting bodies of S.citrinum
1.3 菌种分离
采用食用菌菌种组织分离法[25]。轻拭子实体表面杂物,用75%酒精浸泡过的棉球对其表面进行擦拭消毒,然后在无菌操作台上将子实体一分为二,用无菌解剖刀在无感染处切出5 mm×5 mm的组织块,接种到综合PDA 培养基上,于25℃人工培养箱内暗培养,期间观察菌丝生长情况,将纯化的菌丝转接到二级培养基再次培养。
1.4 无菌苗的培育
将种子用蒸馏水浸泡24 h,在无菌操作台上用30%的H2O2浸泡30 min 表面消毒,再用无菌水冲洗5 次以去除表面残留的H2O2,然后取出放入直径12 cm 的垫有1 层滤纸的无菌培养皿上培养。培养环境为温度(25±1)℃,每天光照14 h,黑暗10 h。培养21 d 后,待其胚根长至1~2 cm 时,转入不同栽培基质组培(组培瓶和基质于121℃下灭菌60 min),其中基质配方设置为珍珠岩和泥炭土(质量比1∶10)、蛭石和珍珠岩和泥炭土(质量比10∶1∶5),及蛭石和泥炭土(质量比10∶5)共3 种处理,培养3 个月左右,备用。
1.5 菌根合成
将之前培养好的菌块打孔(直径为5 mm),每盆3 块接种到生长3 个月的云南松无菌苗的根系周围。接种时用无菌镊子在基质内挖洞,轻轻地将菌块放入根系周围,最后加入20 mL 综合PDA 液体培养基,置于室温为25℃左右的人工气候室内培养,每天光照16 h,黑暗8 h,对照不接种菌丝块,每个处理10 个重复。整个实验期限为6 个月,每隔15 d 浇1 次灭菌的综合PDA 液体培养基。
1.6 分子鉴定
1.6.1 总DNA 的提取
采用CTAB 法提取总DNA[26]。
1.6.2 ITS 扩增及产物检测
ITS 扩增引物为真菌通用引物ITS4(5′-TCC TCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTA AAAGTCGTAACAAGG-3′)(上海生物工程有限公司合成)。PCR 反应体系(25 μL):2×PCR Taq MasterMix with Dye 12.5 μL,引物ITS 4 为1 μL,引物ITS 5 为1 μL,模板DNA 为1.0 μL,ddH2O 为9.5 μL。
PCR 反应条件:94℃预变性300 s,94℃变性40 s,50℃退火40 s,72℃延伸60 s,共35 个循环;72℃延伸420 s。所得产物经1%琼脂糖凝胶电泳检测,后送至北京擎科新业生物技术有限公司进行序列测定。
1.6.3 ITS 序列分析与鉴定
子实体、分离菌株的菌丝及合成的菌根均进行DNA 鉴定:首先通过BioEdit Sequence Alignment Editor 软件去除两端不可靠峰、钝化现象等引起的杂峰,得到序列的可信区;接着通过CExpress软件进行序列拼接和编辑,将结果进行GenBank(http://www.ncbi.nlm.nih.ov/),运用BLAST 在DNA 序列数据库中寻找同源DNA 序列进行比较分析,根据搜索结果,判断菌株物种或近缘物种,序列相似系数99%以上菌株在分类上被确定为同一种。所测菌株与DNA 序列数据库中登录序列比较得到所测菌株序列的具体各部分序列组成;最后,使用MEGA 7.0 中的Neighbor-joining 建系统发育树。
1.7 测定项目与方法
1.7.1 菌根外部形态观察
取出形成外生菌根的云南松幼苗细根,仔细洗去根表泥土,在Leica 体式显微镜下观察外生菌根的外部形态,拍照记录。
1.7.2 菌根侵染率统计
采用划线交叉法统计[27]。对于抽取的每株幼苗,从其第一侧根处剪下根系,用流水缓慢冲洗干净后,随机剪取50 条新鲜须根,于带方格的培养皿内均匀铺开,置于光学显微镜下观察统计其ECMF 侵染情况,计算菌根侵染率。根据测定的生物量计算云南松幼苗在每种基质的菌根依赖性和菌根贡献率。涉及到的计算公式如下[28]:
菌根侵染率=(菌根侵染的根段数/检测的根段总数)×100%;
菌根依赖性=(接种植株平均干质量/对照植株平均干质量)×100%;
菌根贡献率=(接种植株平均干质量-不接种植株平均干质量)/接种植株平均干质量×100%。
1.8 数据统计分析
试验采用多因素方差分析方法比较不同基质和是否接种及其交互作用对云南松幼苗生长指标的影响。方差分析时,不满足方差齐性检验的数据通过[arcsin]或[log(x+1)]转换以满足方差分析的要求。通常采用Post-hoc Tukey 方法检验变量的显著性,如果数据不满足参数检验的条件,采用Kruskall-Wallis 方法检验。5%为显著水平,1%为极显著水平。
不同栽培基质中的云南松幼苗菌根侵染率、菌根依赖性和菌根贡献率用SPSS 16.0 软件进行单因素方差分析(ANOVA)。
2 结果与分析
2.1 橙黄硬皮马勃菌种的分离纯化
采用食用菌组织分离法培养15 d 左右可以看见菌丝,获得的菌丝在综合PDA 培养基上生长致密,初期呈白色,后期呈黄褐色,放射状平铺,菌丝间有交叉,气生菌丝发达。由图2可知,菌株ZhangSC18 的生长速度较快,菌丝致密,生长均匀,因此选用此菌株进行菌种培养,为后面的菌根合成做准备。
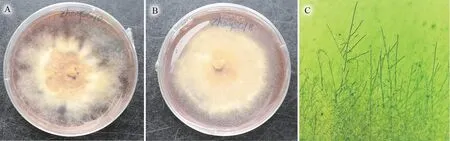
图2 组织分离纯化获得的菌株及菌丝(A.ZhangSC10;B.ZhangSC18;C.菌丝)Fig.2 Strains and hyphae of S.citrinum obtained by tissue isolation and purification(A.Strain ZhangSC10; B.Strain ZhangSC18; C.hyphae)
2.2 ITS 序列比对和系统发育树的构建
子实体(SCZISHITI)、菌株(ZhangSC10 和ZhangSC18)及菌根(ZhangSC20)的ITS 序列总长度平均值为635 bp。利用Blast 软件与NCBI 上的物种基因序列进行ITS 区域比对,序列相似性99%以上的均为Sclerodema citrinum,即橙黄硬皮马勃。
将试验获得的拼接ITS 序列与NCBI 的GeneBank 进行Blast 比对后,得到相似度较高菌株的ITS 序列,下载并最终筛选了16 个菌株的序列,经ITS 序列进行序列比对后,构建系统发育树,结果见图3。从NJ 法构建的系统发育树上可以看出,硬皮马勃属的种间、种内距离在宽度和重叠排列上有所不同,橙黄硬皮马勃聚为一支,具有99%高置信度聚类,结合形态学特征,橙黄硬皮马勃子实体(SCZISHITI)与分离获得的2 个菌株(ZhangSC20 和ZhangSC10),及1 个菌根(ZhangSC20)均为橙黄硬皮马勃S.citrinum[29]。

图3 基于橙黄硬皮马勃子实体、菌丝与菌根的ITS 构建的系统发育树Fig.3 Phylogenetic tree of S.citrinum fruiting bodies,mycelium and mycorrhizae based on ITS sequence
2.3 菌根合成
人工接种橙黄硬皮马勃后,云南松幼苗的根系多形成棒状的外生菌根,菌根颜色为浅黄色(图4)。从图5可以看出,接种橙黄硬皮马勃6个月的云南松幼苗根量显著增多,叶色较深,植株的形态特别是根构型有明显差异。

图4 云南松幼苗的菌根Fig.4 Mycorrhizae of P.yunnanensis seedlings

图5 云南松非菌根苗和菌根苗Fig.5 Non-mycorrhizal and mycorrhizal seedlings of P.yunnanensis
由表1可知,不同基质处理对云南松幼苗的根分支和干质量产生了显著影响(P<0.05)。接种处理对云南松幼苗4 个生长指标的影响均极显著(P<0.01),但是其交互作用仅对根分支的影响是显著的(P<0.05)。无论何种基质,在未接种处理条件下,云南松幼苗生长指标在3 种不同基质处理间的差异不显著(P>0.05,表2),但是接种处理后的云南松幼苗在不同基质处理间差异显著(P<0.05),其中在蛭石和珍珠岩和泥炭土(质量比10∶1∶5)的混合基质中均表现最优(图6)。

图6 不同基质条件下接种处理对云南松幼苗生长的影响Fig.6 Effects of inoculation treatment on the growth of Pinus yunnanensis seedlings under different substrate conditions
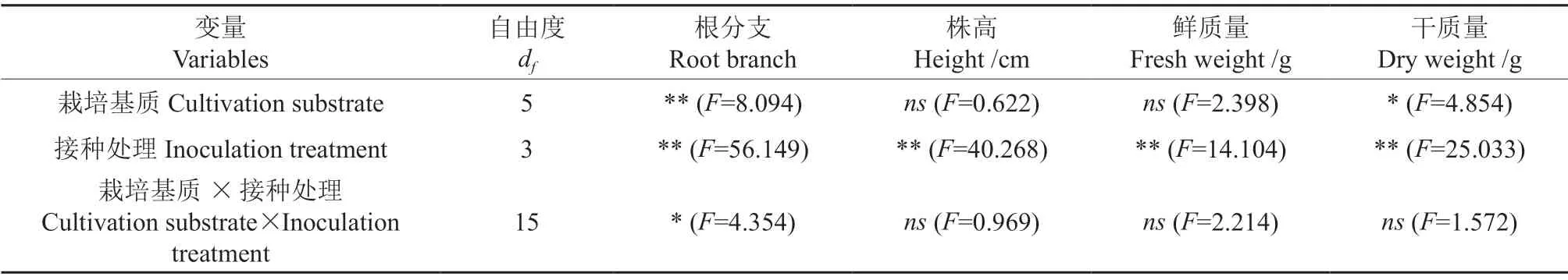
表1 测量指标的方差分析†Table 1 Significant levels of effects of factors and factor interactions on variables based on two-way ANOVA
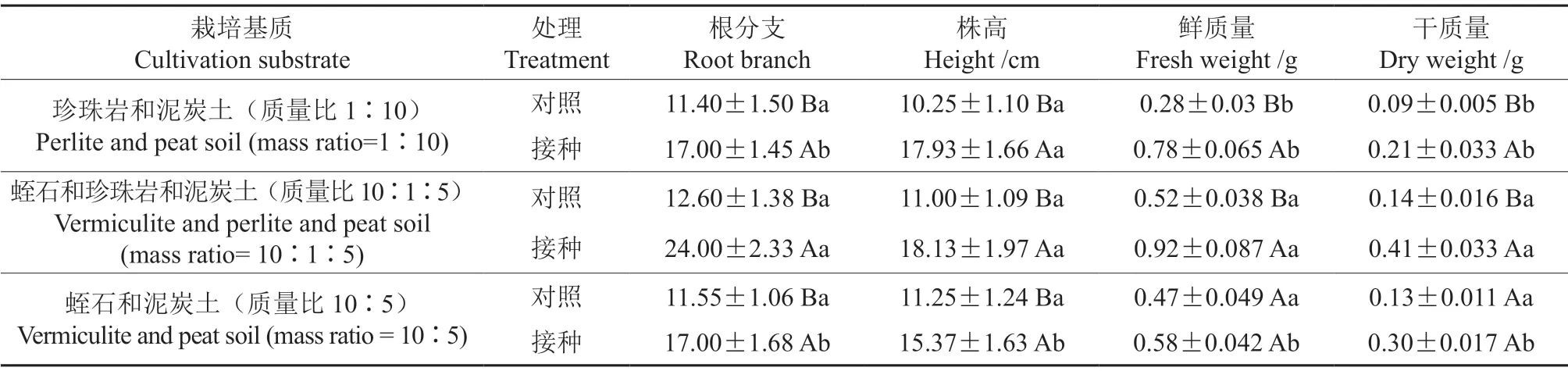
表2 不同栽培基质条件下的接种处理对云南松幼苗生长指标的影响†Table 2 Effects of inoculation treatment on the growth indexes of Pinus yunnanensis seedlings with different cultivation substrates
橙黄硬皮马勃在不同基质间的接种效应差异也是显著的(P<0.05,表3)。其中,蛭石和珍珠岩和泥炭土(质量比10∶1∶5)混合基质中的云南松幼苗菌根侵染率、菌根依赖性和菌根贡献率均最高,分别为92.66%、292.86% 和65.85%,显著高于其他两种基质处理,这与其在不同基质处理间的生长情况是一致的。这有可能是接种的橙黄硬皮马勃更适宜生长在该基质,对菌根合成的贡献较高,从而间接促进了云南松幼苗的生长。
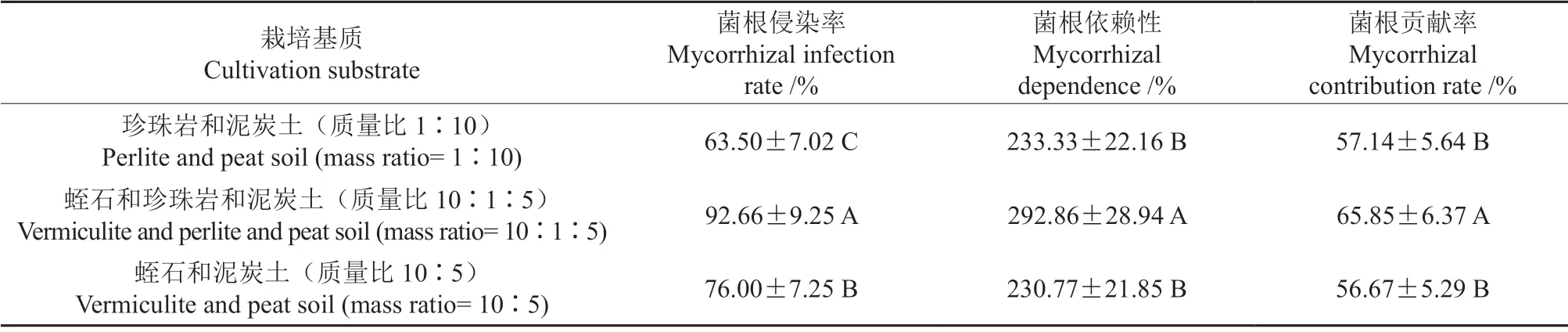
表3 橙黄硬皮马勃的接种效应Table 3 Inoculation effects of Sclerodema citrinum
3 结论与讨论
由于菌根食用菌与宿主植物的共生关系,菌丝的质量是影响菌根生长和食用菌出菇的重要因素[30]。菌种的分离纯化可以保证菌根合成的单一性,提高其竞争力,增加对宿主根系的侵染率。橙黄硬皮马勃和大多数食用菌根菌一样不能进行人工栽培,也无法通过子实体的形态学鉴定方法对分离的菌株进行鉴定[31],这时候分子鉴定就显得尤为重要[32]。Landeweer 等[33]学者表示可通过比较ITS 序列来推断待测物种与已知物种之间的关系,即相似度高于99%,两者同种;相似度在95%~99%之间,两者同属;相似度低于95%,同科。目前对菌根真菌的分类鉴定广泛应用的基因序列是中度保守的ITS 片段,ITS 常用于属内及种间的系统发育研究,是核糖体DNA 中的非编码内转录间隔区序列,被广泛应用于不同物种的系统发育、进化和分类研究及菌种鉴定等方面[34-35],在外生菌根真菌分离物的鉴定中也得到广泛运用。本研究通过Blast 软件与NCBI 上的物种基因序列进行ITS 区域比对,发现序列相似度达到99%以上的均为橙黄硬皮马勃。熊涛等和李海波等利用ITS 序列鉴定了食用菌组织分离菌株的真伪[36-37]。本研究同样利用核糖体核糖体转录间隔区(ITS)序列对子实体、分离菌株和菌根进行比对验证后,建立系统发育树,进一步证实市场上购买的子实体、分离获得的菌株及人工合成的菌根菌确实为橙黄硬皮马勃。
菌根的合成决定了接种后的菌根食用菌是否有能力与土壤中的其他菌根真菌竞争,并适应环境形成人工菌根,最后形成子实体[38-39]。菌根合成基质的筛选可以保证目的菌种的正常繁殖,促进菌丝对宿主植物根系的侵染。另外,实验室条件下的外生菌根合成必须保证无菌条件[40]。本研究通过将分离获得的橙黄硬皮马勃优良菌株接种不同栽培基质条件下的云南松无菌苗,均可形成外生菌根,尤其是在蛭石和珍珠岩和泥炭土(质量比10∶1∶5)基质上,菌根侵染率、菌根依赖性和菌根贡献率均最高,并显著促进了云南松幼苗的生长。这是首次在实验室里通过人工接种的方式实现橙黄硬皮马勃对云南松幼苗的侵染,有一定的科研价值。下一步我们会试验更多的菌根合成方法,例如筛选宿主苗龄、接种方式、接种菌剂剂型、活力、培育温度、湿度、pH 值和光照等,并适时将菌根苗移栽至野外,模拟其生长的自然环境,为橙黄硬皮马勃的人工栽培提供科学依据。
综上所述,外生菌根菌的分离纯化是保证菌根合成的必要条件,而菌根的成功合成是定向培育菌根化苗木的基础。本试验表明,橙黄硬皮马勃可以通过组织分离获得纯菌,综合PDA 培养基可以用来成功分离其菌种,最适宜云南松无菌苗菌根合成的栽培基质是为蛭石和珍珠岩和泥炭土(质量比10∶1∶5)。研究结果可为云南松菌根化苗木的培育及菌根技术的开发和利用提供技术支撑。本研究仅开展了橙黄硬皮马勃的菌种分离纯化研究,但自然界的环境较为复杂,摸清该菌的生理学特性对菌根的研究具有至关重要的作用。因此,综合考虑温度、pH、碳氮源和生长调节剂等对其菌丝生长的影响是下一步要做的工作,进而突破外界环境因素的限制,实现外生菌根真菌的纯培养,为菌根真菌的其他研究奠定基础。
