杏鲍菇液体菌种的细胞固定化技术及其保藏条件研究
2022-05-27周婷婷周荣翔陈文才李霁虹马桂珍
周婷婷,周荣翔,张 瑶,陈文才,李霁虹,马桂珍
(1. 江苏海洋大学,江苏 连云港222005;2. 南京医科大学 康达学院,江苏 连云港 222000;3. 河北永清县农业农村局种植业技术推广站,河北 永清 065600)
杏鲍菇(Pleurotus eryngii)属侧耳科侧耳属(Pleurotus)食用菌,营养丰富,蛋白质和脂肪含量高,富含多种植物维生素、矿物质以及微量元素和寡糖,具有抗氧化、抗菌、免疫调节、降血脂、抗肿瘤[1-6]等方面的作用,深受消费者青睐。随着杏鲍菇工厂化生产规模的不断扩大[7],生产上应用液体菌种已成为一种趋势[8],液体菌种相较于传统固体菌种,具有制作周期短、染菌风险低、萌发出菇快等优势,应用越来越广泛[9-11]。液体菌种优势明显,但也存在不足,生产出来的液体菌种保藏时间短,如马立芝[12]研究认为,杏鲍菇液体菌种室温(16~20 ℃)条件下仅可保藏10 d。目前,有关杏鲍菇液体菌种的研究主要集中于液体菌种制备的培养基和培养条件优化[8,13-15]。有关延长液体菌种保藏时间的研究也有报道,马世玉等[16]和刘映淼等[17]通过将杏鲍菇液体菌种与固化基质按不同比例混合,实现液体菌种的再固化,再固化后菌种的保藏时间分别达35 d 和30 d,这种再固化方法虽然延长了液体菌种的保藏时间,但再固化菌种制备过程中菌丝球分散困难,菌丝球在基质中分散不均,影响接种效果。液体菌种的固定化是将液体菌种包埋于固定化载体内,此技术既可以延长菌种保藏时间,也可以弥补再固化的不足。本试验通过筛选适合杏鲍菇液体菌种细胞固定化的载体种类,优化固定化条件,建立液体菌种的细胞固定化技术,延长液体菌种的保藏时间,为杏鲍菇液体菌种的普及和规模化生产提供参考。
1 材料和方法
1.1 供试菌种及培养基
杏鲍菇菌种由江苏中翰食用菌有限公司提供。
杏鲍菇菌种活化培养基(PDA 培养基):马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L。
杏鲍菇母种培养基[13]:马铃薯100 g,麦麸30 g,蔗糖27 g,蛋白胨1.40 g,KH2PO40.85 g,MgSO41 g,蒸馏水1 L(固体培养基添加20 g琼脂)。
栽培培养基[18]:棉籽壳86 g,麦麸10 g,葡萄糖1 g,CaSO41 g,CaCO32 g,纯水110 mL。
1.2 杏鲍菇液体菌种制备
取直径为0.5 cm 活化的杏鲍菇菌种菌苔7 块,接入含有80 mL 母种培养基的250 mL 三角瓶中,25 ℃、180 r/min 培养6 d,以菌丝球达到4.5×105个/L为发酵终点,制得液体菌种。
1.3 杏鲍菇液体菌种固定化初始条件
制备质量浓度为80 g/L 的固定化载体,灭菌后与等体积的杏鲍菇液体菌种混合,用无菌注射器缓慢滴入到20 g/L 的CaCl2溶液中,静置4 h,弃去CaCl2溶液,用无菌水清洗3遍,得到固定化菌种。
1.4 杏鲍菇液体菌种固定化条件的优化
1.4.1 处理设置 对杏鲍菇液体菌种固定化初始条件中固定化载体种类、2种载体混合配比、混合载体的质量浓度、混合载体与液体菌种的体积比、CaCl2质量浓度、交联时间进行优化,分别设定不同梯度,每个优化条件均在前一个优化条件基础上进行,每条件优化重复3 次,每次制备约700 个固定化小球,通过观察不同条件制备的固定化小球的成球状态,测定机械强度、传质性和菌丝增长率,选取最适的制备条件。
载体种类分别设置为80 g/L 海藻酸钠(SA)、40 g/L SA+40 g/L 聚乙烯醇(PVA)、40 g/L SA+40 g/L CaCO3、40 g/L SA+40 g/L 硅藻土(DE)、40 g/L SA+40 g/L 活性炭(AC);2 种载体混合配比设置为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1;混合载体质量浓度设置为40、60、80、100、120 g/L,杏鲍菇液体菌种与混合载体体积比设置为3∶7、4∶6、5∶5、6∶4、7∶3;CaCl2溶液质量浓度设置为10、20、30、40、50 g/L,交联时间设置为2、4、6、8、10 h。以上条件下分别制备固定化小球。
1.4.2 测定指标及方法
1.4.2.1 形态观察及其划分标准 能够成球,且球体大小一致,形态规则,记为“+++”;可成球但形态不规则,记为“++”;可成球,形态不规则,且稍有拖尾现象,记为“+”;不成球,记为“-”。
1.4.2.2 机械强度的测定 随机取4 颗粒径大小一致的固定化菌种小球,在桌面上呈正方形摆放,小球上面放一个塑料平皿,缓慢加入粉末状物质,观察固定化菌种小球的形态变化,至开始变形停止加入,记录固定化菌种所能承受的最大质量,以此表示固定化菌种的机械强度大小。
1.4.2.3 传质性的测定 选取不同条件下制备的大小均匀的固定化菌种小球20 颗,浸入20 mL 体积分数为10%的惰性红墨水溶液中,每隔5 min 取出固定化菌种进行切片,在解剖镜下观察固定化菌种小球内部颜色,记录固定化菌种完全变红色的时间,以此表示固定化菌种的传质性,时间越短说明传质性越快。
1.4.2.4 菌丝增长率的测定 取不同条件下制备的固定化菌种小球30 颗,加入到装有60 mL 母种培养基的250 mL 三角瓶中,25 ℃、180 r/min 振荡培养6 d,测量每个固定化菌种小球的直径,每个固定化条件为1个处理,每处理接种3瓶,为3次重复,计算培养前后小球直径比值,即菌丝增长率。

1.5 杏鲍菇固定化菌种保藏稳定性测定
将制备好的固定化菌种小球分装于含有15 mL无菌水的离心管中,每管约600个固定化菌种小球,以加入等量的液体菌种为对照(CK),密封,分别置于20、4 ℃条件下保藏。另外,在装有固定化小球的离心管中加入无菌液体石蜡15 mL,于-20 ℃保藏,分别在0、10、20、30 d 取样,测定菌种成活率、菌丝萌发时间、菌丝生长速度、呼吸强度和纤维素酶活性。
1.5.1 菌种成活率、菌丝萌发时间和菌丝生长速度的测定 将保藏不同时间的固定化菌种及液体菌种接到PDA 平板上,接种20 个平板为20 个重复,25 ℃恒温培养,每隔1 h 观察菌球是否萌发,有1 个平板萌发后,改为每0.5 h 观测一次,记录不同保藏条件下固定化菌种的萌发时间,培养7~10 d,观察菌落状态,计算成活率。观察记录菌丝体在平板上的直线生长距离,计算菌丝生长速度。
1.5.2 呼吸强度的测定 分别称取保藏不同时间的固定化菌种10 g,采用小篮子法[19]测定固定化菌种的呼吸强度,每个保藏时间为1个处理,每处理重复3次。
1.5.3 纤维素酶活性的测定 取保藏不同时间的固定化菌种10 g,分别接种于装有50 g 栽培培养基的250 mL 三角烧瓶中,每个保藏时间为1 个处理,每个处理接种3 瓶,为3 次重复。25 ℃培养10 d,取培养物10 g,用5 倍水浸泡、捣碎,30 ℃浸提1 h,用4层纱布过滤后于3 000 r/min 离心10 min,取上清液,依据QB2583—2003 的方法分别测定固定化菌种的羧甲基纤维素酶(CMC)和滤纸酶(FPA)活性。
2 结果与分析
2.1 杏鲍菇液体菌种固定化条件的优化
2.1.1 固定化载体种类 由表1 可知,不同载体以及不同组合对杏鲍菇液体菌种的固定化性能有不同影响。40 g/L SA+40 g/L PVA 的菌丝增长率最高,达185.3%;40 g/L SA+40 g/L CaCO3的成球状态较好,机械强度较强,菌丝增长率为138.4%;再者是80 g/L SA 和40 g/L SA+40 g/L DE,而40 g/L SA+40 g/L AC 不能形成小球。综合成球状态、机械强度、传质性、菌丝增长率等不同指标,选择SA+PVA作为杏鲍菇液体菌种固定化的载体。

表1 不同固定化载体种类对杏鲍菇液体菌种固定化性能的影响Tab.1 Effects of different kinds of immobilized carriers on the performance of immobilized strain
2.1.2 固定化载体组合配比 由表2 可知,SA 与PVA 质量比在1∶9~5∶5,随着SA 比例的增加,固定化菌种成球状态越来越好,质量比为3∶7、4∶6、5∶5的成球状态均为最佳状态,传质性越来越慢,机械强度越来越大。菌丝增长率随着SA 比例的增加逐渐提高,比例为3∶7 时最高,达197.3%,随着SA 比例继续增加,菌丝增长率开始下降。质量比高于5∶5时不能形成小球。SA 浓度影响固定化菌种孔径的大小,浓度过低导致颗粒内的菌丝容易流失,而浓度过高则颗粒孔径太小,菌丝增长受到限制[20]。综合分析成球状态、机械强度、传质性及菌丝增长率等不同指标,选择SA与PVA质量比为3∶7作为杏鲍菇液体菌种固定化的载体组合配比。

表2 不同SA与PVA质量比对杏鲍菇液体菌种固定化性能的影响Tab.2 Effects of different mass ratio of SA and PVA on the performance of immobilized strain
2.1.3 固定化载体质量浓度 由表3 可知,固定化载体质量浓度在40~100 g/L,随着质量浓度的增加,固定化菌种成球状态越来越好,质量浓度为80、100 g/L 成球状态最佳;传质性越来越慢,机械强度越来越大。质量浓度高于100 g/L时不能形成小球。菌丝增长率随着载体质量浓度的增加逐渐提高,质量浓度为80 g/L 时最高,达194.7%,质量浓度继续增加则菌丝增长率逐渐下降。综合分析成球状态、机械强度、传质性及菌丝增长率等不同指标,选择80 g/L作为杏鲍菇液体菌种固定化载体质量浓度。

表3 不同固定化载体质量浓度对杏鲍菇液体菌种固定化性能的影响Tab.3 Effects of different mass concentration of immobilized carrier on the performance of immobilized strain
2.1.4 液体菌种与固定化载体体积比 由表4 可见,杏鲍菇液体菌种与固定化载体体积比在3∶7、4∶6、5∶5时,固定化菌种均可形成形态规则的小球,传质性相同,随着液体菌种比例增加,机械强度逐渐减弱,而菌丝增长率逐渐增加,当二者比例为5∶5时,菌丝增长率最高,达196.1%。当液体菌种所占比例大于50%时,固定化菌种结构过于疏松,无法成球。这可能是因为液体菌种含量过高,阻碍了海藻酸钠与Ca2+的交联作用[21]。综合分析成球状态、机械强度、传质性及菌丝增长率等不同指标,选择杏鲍菇液体菌种与固定化载体体积化为5∶5。

表4 不同液体菌种与固定化载体比例对杏鲍菇液体菌种固定化性能的影响Tab.4 Effects of different ratio of liquid strain and immobilized carrier on the performance of immobilized strain
2.1.5 CaCl2质量浓度 由表5可见,CaCl2质量浓度为20、30、40 g/L时,固定化菌种成球状态最好,质量浓度大于40 g/L 或小于20 g/L,固定化菌种的小球略有拖尾,成球状态变差。随着CaCl2质量浓度的增加,固定化菌种传质性越来越慢,机械强度越来越强;CaCl2质量浓度为20 g/L 时菌丝增长率最高,达199.8%,CaCl2质量浓度高于或低于20 g/L 菌丝增长率下降。这可能是因为CaCl2质量浓度低于20 g/L时,交联程度不够,固定化菌种机械强度太小,菌丝容易从其中溢漏出来,CaCl2质量浓度高于20 g/L时,固定化菌种交联程度变强,导致其空隙减少,影响菌丝的传质[22]。综合分析成球状态、机械强度、传质性及菌丝增长率等不同指标,确定杏鲍菇液体菌种固定化时CaCl2质量浓度为20 g/L。

表5 不同CaCl2质量浓度对杏鲍菇液体菌种固定化性能的影响Tab.5 Effects of different mass concentration of CaCl2 on the performance of immobilized strain
2.1.6 交联时间 不同交联时间对固定化菌种的成球状态无影响,对其他指标有明显的影响。随着交联时间的增加,传质性逐渐变慢,机械强度逐渐增强;菌丝增长率呈先升后降趋势,交联时间6 h时,菌丝增长率最高,达200.1%,交联时间高于6 h菌丝增长率下降。结果见表6。综合分析成球状态、机械强度、传质性及菌丝增长率等不同指标,选择6 h作为杏鲍菇液体菌种固定化的交联时间。

表6 不同交联时间对杏鲍菇液体菌种固定化性能的影响Tab.6 Effects of different cross-linking time on the performance of immobilized strain
2.2 固定化菌种保藏稳定性测定结果
2.2.1 固定化菌种活力
2.2.1.1 成活率 随着保藏时间的延长,对照液体菌种的成活率逐渐下降,20 ℃保藏10 d 仅下降2 个百分点,保藏20 d 迅速下降至55%,至30 d 成活率仅为10%;4 ℃保藏至10 d 时,成活率未发生改变,20 d时成活率开始下降,为97%,保藏至30 d成活率降至88%。相同温度下固定化菌种保藏30 d,成活率保持稳定,仍为100%,结果见图1a—b。-20 ℃保藏10 d,液体菌种对照和固定化菌种的成活率分别降至40%和50%,保藏至20 d,成活率均降至0,结果见图1c。说明液体菌种固定化后保藏时间由10 d延长到了30 d以上。

图1 不同保藏温度和时间对液体菌种与固定化菌种成活率的影响Fig.1 Effects of different storage temperature and time on the survival rate of liquid strain and immobilized strain
2.2.1.2 萌发时间 对照液体菌种保藏0 d 菌丝萌发时间均为15.0 h,随着保藏时间的延长,萌发时间均逐渐延长。20 ℃保藏10、20、30 d,萌发时间分别为17.0、18.0、23.5 h,比保藏0 d分别延长了2.0、3.0、8.5 h。4 ℃保藏相同时间,萌发时间分别为16.5、18.5、20.0 h,比保藏0 d 分别延长了1.5、3.5、5.0 h。固定化菌种萌发时间稳定,20 ℃保藏10 d,菌丝萌发时间仍为15.0 h,保藏30 d为16.0 h,比0 d仅延长了1.0 h;4 ℃保藏10、20 d 菌丝萌发时间均为16.0 h,延长0.5 h,保藏30 d延长了1.0 h。说明液体菌种固定化后在4 ℃和20 ℃条件下保藏30 d 菌种的萌发时间变化较小。-20 ℃保藏10 d,对照液体菌种与固定化菌种菌丝萌发时间分别延长了5.0 h和7.0 h,说明-20 ℃保藏对菌种的萌发时间影响较大,不利于菌种保藏,结果见图2。

图2 不同保藏温度和时间对液体菌种与固定化菌种菌丝萌发时间的影响Fig.2 Effects of different storage temperature and time on the hyphae germination time of liquid strain and immobilized strain
2.2.1.3 生长速度 随着保藏时间的延长,对照液体菌种的菌丝生长速度逐渐变慢。20 ℃保藏10 d,菌丝生长速度开始减少,为6.0 mm/d;保藏20 d,降低最快,为4.6 mm/d;保藏30 d,菌丝生长速度降至3.6 mm/d。4 ℃保藏液体菌种10、20、30 d,菌丝生长速度分别为6.0、5.6、4.8 mm/d。固定化菌种4、20 ℃保藏,菌丝生长速度较稳定,保藏30 d 与保藏0 d 的固定化菌种菌丝生长速度无显著性差异(P<0.05)。结果见图3a—b。-20 ℃保藏的液体菌种与固定化菌种的菌丝生长速度迅速下降,保藏10 d,菌丝生长速度分别降低了70.15%、72.73%,说明杏鲍菇菌种不能在-20 ℃条件下保藏。20、4 ℃温度下,液体菌种固定化后保藏30 d 菌种的成活率、菌丝萌发时间及菌丝生长速度等具有很好的稳定性。
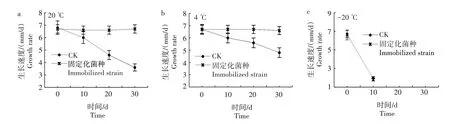
图3 不同保藏温度和时间对液体菌种与固定化菌种菌丝生长速度的影响Fig.3 Effects of different storage temperature and time on the growth rate of liquid strain and immobilized strain
2.2.2 固定化菌种生理稳定性
2.2.2.1 呼吸强度 如图4 所示,固定化菌种的呼吸强度随着保藏时间的延长,逐渐减弱。4 ℃保藏10 d,固定化菌种呼吸强度迅速降低,从0 d 的0.088 mg/(g·h)降 至0.028 mg/(g·h);保 藏20 d,20 ℃保藏的固定化菌种呼吸强度降低较快,从10 d的0.079 mg/(g·h)降至0.021 mg/(g·h);保藏30 d时,20 ℃和4 ℃保藏固定化菌种的呼吸强度分别比保藏0 d 时降低78.65%和88.76%。-20 ℃保藏10 d的固定化菌种,呼吸强度比0 d时降低85.39%,仅为0.013 mg/(g·h)。结合2.2.1 可知,4、20 ℃温度下保藏的固定化菌种具有稳定的菌种活力,-20 ℃保藏的固定化菌种活力低。综上所述,4 ℃和20 ℃保藏的固定化菌种呼吸强度降低,说明保藏期间菌丝生长缓慢,有利于保持菌种活力,延长菌种保藏时间[18]。

图4 不同保藏温度和时间对固定化菌种呼吸强度的影响Fig.4 Effects of different storage temperature and time on the respiration intensity of immobilized strain
2.2.2.2 FPA 活性 如图5 所示,随着保藏时间的延长,20、4 ℃保藏固定化菌种的FPA 活性逐渐增高,20、4 ℃保藏30 d的固定化菌种FPA 活性比保藏0 d 分别高出8.10、8.86 U。这可能与固定化菌种从相对休眠状态转入富含纤维素成分的栽培培养基中FPA 被诱导形成有关。-20 ℃保藏10 d,FPA 活性由开始的28.01 U降至16.81 U。
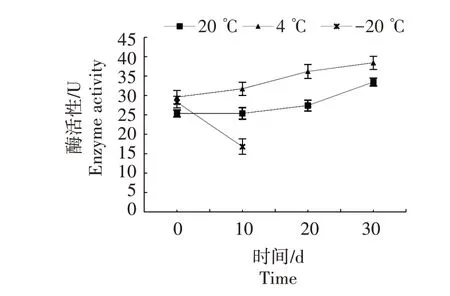
图5 不同保藏温度和时间对固定化菌种FPA活性的影响Fig.5 Effects of different storage temperature and time on FPA activity of immobilized strain
食用菌分泌酶的量与食用菌生长速度及子实体的形成和发育密切相关[23],较高的纤维素酶活性有利于杏鲍菇分解基质中的纤维素,促进菌丝生长。综上所述,4、20 ℃保藏的固定化菌种有利于维持杏鲍菇FPA活性。
2.2.2.3 CMC 活性 如图6 所示,随着保藏时间的延长,20、4 ℃保藏的杏鲍菇固定化菌种CMC 活性先增强后衰弱,呈抛物线变化,在保藏10 d 时,两者酶活性最高,分别为11.60、12.37 U。固定化菌种保藏30 d,20 ℃温度下CMC 活性比保藏0 d 时高11.24%;4 ℃温度下CMC 活性与保藏0 d 相比无显著性差异(P>0.05)。-20 ℃保藏的固定化菌种CMC活性显著降低,从0 d 的9.01 U 降至10 d 的5.23 U。说明4、20 ℃保藏的固定化菌种有利于维持杏鲍菇CMC活性。
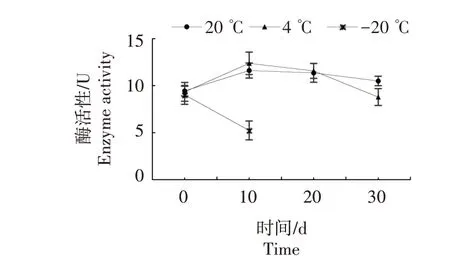
图6 不同保藏温度和时间对固定化菌种CMC活性的影响Fig.6 Effects of different storage temperature and time on CMC activity of immobilized strain
3 结论与讨论
本试验结果表明,杏鲍菇液体菌种的固定化最佳条件:海藻酸钠与聚乙烯醇质量比3∶7,固定化载体质量浓度80 g/L,液体菌种与固定化载体溶液体积比5∶5,CaCl2质量浓度20 g/L,交联时间6 h。杏鲍菇液体固定化菌种在20 ℃和4 ℃环境下,保藏30 d,菌种的生长特性和生理特性稳定,液体菌种固定化能有效延长杏鲍菇液体菌种的保藏期。杏鲍菇液体菌种固定化后在室温(20 ℃)和4 ℃条件下保藏30 d,成活率均为100%,菌丝生长速度不变,菌丝萌发时间分别为16.0、17.0 h,低于相应对照液体菌种的23.5、20.0 h,明显低于李凤美等[24]用海藻酸钙包埋法制备的固定化菌种的萌发时间72.0 h。优化的固定化菌种的呼吸强度低于低温保藏液体菌种和基质固化的液体菌种[18],其原因可能是固定化载体中营养缺乏,菌丝生长缓慢[12]。固定化菌种20 ℃条件下保藏30 d,FPA 与CMC 活性都高于保藏0 d的固定化菌种;4 ℃保藏30 d,FPA活性高于保藏0 d 的固定化菌种,CMC 活性与保藏0 d 的固定化菌种无显著性差异,该结果与香菇斜面保藏菌种CMC活性趋势相同[25]。说明20 ℃及4 ℃环境下,固定化菌种的纤维素酶活性保持相对稳定。-20 ℃保藏的固定化菌种,至20 d时成活率已降到0,这可能与低温下形成的冰晶结构破坏了杏鲍菇菌丝,影响菌丝生长和繁殖等有关[12]。
本研究结果有效延长了杏鲍菇液体菌种的保藏时间,今后将进一步系统研究杏鲍菇液体固定化菌种在生产上的应用效果,开展出菇试验,为液体菌种的推广普及提供技术支撑。
