樟子松根部深色有隔内生真菌的生防菌筛选
2022-09-26赫俊阳宋小双宋瑞清
赫俊阳,宋小双,宋瑞清,邓 勋
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林保护研究所,黑龙江 哈尔滨 150040)
陆生植物中的内生菌含量很高[1]。深色有隔内生菌(DSE)作为构成内生菌的主要类别之一,其特征是存在深色菌丝体和明显的隔膜。它们定殖在健康植物根部周围的表皮、皮层及维管组织的细胞质,从而成为真菌-植物共生体,起到保护植物免受疾病侵害的作用[2-3]。DSE 真菌的寄主广泛,涵盖114 个科、320 属,超过600 种植物。DSE 已在菌根植物以及莎草科、十字花科和藜科等传统非菌根植物的根中被发现[4]。针叶树中的DSE 真菌主要由子囊菌中的(Pialocephala fortiniis.l.-Acephala applanata)(PAC)类群集合体组成[5]。PACs 作为针叶树根系的主体,主要分布在北半球极地到热带地区[6]。前人研究表明,DSEs 有利于植物生长[7-10],它们既可以增强土壤不溶性磷的矿化作用[11-12],也可促进氮(N)和磷(P)等养分的吸收[13],且可提高寄主植物的胁迫耐受性[14-17]。同时,DSE 真菌对有助于抑制土传病害的传播。根系定植的Heteroconium chaetospira可诱导对大白菜的系统抗性,并减少细菌性叶斑和链格孢菌引起的叶斑。根系定植的钩端螺旋体可诱导对大白菜的系统抗性,并减少细菌性叶斑和链格孢菌引起的叶斑[18]。H.chaetospira还通过定植根皮层诱导寄主植物提高抗病性[19]。例如,Narisawa[20-21]通过一种诱导植物筛选了两种生物防治真菌,分别为P.fortinii和H.chaetospira,该诱导植物能有效控制由Plasmodiophora brassicae和黄萎病菌引起的大白菜根肿胀。PAC 成员被证明可有效阻止病原体的侵入[22]。此外,P.sphaeroides通过调动丰富的生物活性物质,在挪威云杉中显示出优异的特性,可防止Heterobasidion parviporum污染,从而降低挪威云杉死亡率和发病率[23]。接种测试结果揭示了PAC 菌株的轻微毒性,可以采取措施通过阻止小生境竞争产生高毒性PAC 病原体[24]。
樟子松Pinus sylvestrisvar.mongolica,属松科Pinaceae 松属Pinus,为苏格兰松Pinus sylvestris的变种,在中国的大兴安岭地区、俄罗斯及蒙古地区均有分布[25],因其树高和绿化特性,通常被认为是观赏树种。此外,该品种因其强大的抗寒、抗旱性、适应性及生长周期较短而广受欢迎[26],在东北地区常被用作主要速生用材、防护绿化、水土保持优良树种,其同时也被列为中国政府实施的“防沙工程的主要树种”,为生态建设和环境保护做出了巨大贡献[27]。
立枯丝核菌(Rhizoctonia solani)作为一种土壤传播的致病真菌,常见于植物中。实际上,真菌在植物方面有多种选择,并且是引起植物病害(例如根瘤菌和根腐病)的罪魁祸首[28-29]。土壤传播的病原体作为抗性繁殖体在土壤中具有很高的生存能力,其中包括衣原体、菌核、厚壁分生孢子及菌丝。这些病原体也可能寄生在农作物和植物的根或残骸上,在适当的条件下,以根瘤菌、疫霉菌、菌核菌、腐霉菌、轮枝菌及镰刀菌为代表的土壤传播的病原体很可能对多种作物和木本植物产生有害影响,尤其是在植物的繁殖阶段[30]。目前,苗圃中的土壤病害一般通过化学防治来控制,而滥用和过量使用化学药品和杀虫剂可能导致一系列无法控制的后果,例如产生具有抗药性的病原体,破坏土壤基质及造成幼苗营养不良。为了避免这一不利影响,可使用微生物及其代谢产物作为植物化学农药的环保替代品,例如:徐睿等[31]发现枯草芽孢杆菌Bacillus subtilis和球孢链霉菌球孢亚种Streptomyces globisporussubsp.可以对油茶炭疽病多种病原菌产生抑制作用。微生物及其代谢物因具有无污染、无残留、专一性、无耐药性等优势,可避免对人和动物,以及环境产生危害[32]。
深色有隔内生真菌作为菌剂,具有环境友好性,且其是针叶树根部的主要微生物类群,在促进生长、提高抗逆性方面具有重要作用。本研究主要以樟子松根部深色有隔内生真菌的分离鉴定和抗病促生菌株的筛选为目标,验证其对于樟子松的抗病性及生长发育的影响,为进一步研究深色有隔内生真菌-樟子松互作抗病机制打下基础。
1 材料与方法
1.1 供试材料
樟子松苗期立枯病病原菌: 立枯丝核菌(Rhizoctonia solani),分离自黑龙江省苇河实验林场苗圃。
供试樟子松种子(购自辽宁省彰武县章古台实验林场,-20℃冰箱保存)。种子处理及播种参考尹大川[33]方法,将经催芽的樟子松种子播入营养钵中,每钵30 粒,上覆无菌土,浇透水后放入大棚中培养,待幼苗出土后,定苗至每钵20 株,常规管护。
1.2 试验方法
1.2.1 樟子松根部深色有隔内生真菌的分离纯化
分别将黑龙江省加格达奇樟子松母树林(J)、大兴安岭呼中自然保护区樟子松针阔混交林(H)和哈尔滨市帽儿山实验林场樟子松人工林(A)采集的樟子松新鲜根段用自来水冲洗,去除根部泥沙,在超净工作台上将每个样本的根随机切下几个1 cm 的小段;先用无菌水漂洗3 次后用75%的乙醇处理5 min(根据根的老、嫩程度的不同适当延长或减少消毒时间),无菌水漂洗2 次,再用10%的次氯酸钠中消毒10 min,无菌水漂洗3 次,用滤纸将漂洗后的根段吸干;随后将消毒后的根段切取中间0.3~0.5 cm 的部分接种于(含50 mg/L Amp 和50 mg/L Streptomycin sulfate)马铃薯蔗糖培养基 (PDA)平板上,每个培养皿接3 个根段,10 个重复,置于28℃的恒温培养箱中暗培养;当培养基表面长出棕色或黑色菌丝时,挑取菌丝转至新的PDA 平板上,于28℃下黑暗培养72 h,重复培养4 次达到纯化菌株的目的。
1.2.2 樟子松根部深色有隔内生真菌的形态特征鉴定
根据《真菌鉴定手册》[34],对DSE 菌株的菌落形态、大小、颜色、生长速度、表面纹饰、质地、生长培养基颜色变化等特征进行鉴定,并观察和记录菌丝有无隔膜,有无细胞核,分生孢子分枝情况等形态特征。
1.2.3 菌株的分子生物学鉴定
培养3 周的菌株采用CTAB 法提取真菌总DNA[35]。扩增测序引物序列为ITS1 5′-TCCGTAGGTGAACCTGCGG-3′,ITS4 5′-TCCTCC GCTTATTGATATGC-3′。PCR 反应体 系(50 μL):Taq 酶,1 μL;DNA 模板,2 μL;dNTP (2.5 mmol·L-1),2 μL;ITSl (10 μmol·L-1),2 μL;ITS4 (10 μmol·L-1)2 μL;10×PCR buffer,5 μL;Mg2+(25 mm·L-1),7 μL;ddH2O,29 μL。PCR 反应参数:94℃预变性5 min;94℃变性1 min,53℃退火1 min,72℃延伸1 min,35 个循环;最后72℃延伸10 min。PCR 扩增产物测序由上海生工完成。序列经BioEdit 软件分析和手工校正后,用NCBI 的BLAST 程序将测得序列与GenBank 中已有菌株的ITS 序列进行同源性比对。
1.3 高效生防菌株的筛选
1.3.1 对峙实验(平板对峙培养)
用直径为5 mm 的无菌打孔器切取已培养生长优良的深色有隔真菌和立枯丝核菌,相距50 mm接种于PDA 培养基上,同时以单独接种立枯丝核菌和深色有隔真菌的平板作为对照,每组3 个重复,25℃生化培养箱中培养,每8 h 测量一次菌株半径。计算48 h 后各菌株生长被抑制率和相对抑制效果。
被抑制率(%)=[(对照菌落半径-对峙培养菌落半径)/对照菌落半径]×100%。
相对抑制效果=病原菌株被抑制率/拮抗菌株被抑制率。
1.3.2 深色有隔内生真菌发酵液对立枯丝核菌菌丝生长的影响
在PDA 培养基上活化24 株深色有隔内生真菌,采用马铃薯葡萄糖液体培养基发酵,发酵产物用4 层纱布过滤,发酵滤液在4 000 r/min 下离心15 min 后用0.221 μm 的微孔过滤器过滤,放入4℃冰箱中保存备用[36-37]。将发酵液混入培养基中,使发酵液浓度为50%,将直径5 mm 的菌饼接种到培养基中,25℃恒温培养箱中培养,每8 h 测定菌直径,以含50%无菌水的PDA 作为对照,每组3个重复。根据测量结果分析不同DSE 对病原菌菌丝生长起到的抑制作用,并计算深色有隔内生真菌对病原菌的抑制率。
抑制率(%)=(对照菌落直径-抑制培养的菌落直径)/对照菌落直径×100%。
1.4 深色有隔内生真菌对樟子松幼苗的影响
1.4.1 菌剂制备
深色有隔内生真菌在PDA 培养基上培养20 d后,接种到棉籽壳培养基(棉籽壳 200 g,葡萄糖2 g,MgSO4·7H2O 3 g,KH2PO43 g,(NH4)2HPO43 g,碳酸钙2 g,维生素B1 0.001 g,含水量60%,121℃、0.1 MPa 蒸汽灭菌1 h,冷却后接种)中,25℃黑暗培养30 d 后作为菌剂待用。
1.4.2 试验设计
实验组:每盆15 株樟子松幼苗接种菌剂200 g,5 个重复。对照组:只接种200 g 灭菌的棉籽壳培养基。接种90 d 后,对樟子松苗取样。每个处理随机取20 株,用无菌水清洗根际,滤纸吸干后用于生长指标包括苗高、地径、地上部分及地下部分鲜重。
1.5 数据处理
采用Excel 2019 软件进行初步处理,数据由平均值±标准误(mean±SE)表示;每个指标设置3 个重复,使用SPSS 19.0 软件进行单因素方差分析,使用Origin 2019 软件处理数据并绘图。
2 结果与分析
2.1 深色有隔内生真菌系统发育树及分子鉴定
通过分离纯化,在加格达奇樟子松母树林(J)、大兴安岭呼中自然保护区樟子松针阔混交林(H)和哈尔滨市帽儿山实验林场樟子松人工林(A)3个取样点共分离得到24 株深色有隔内生真菌,其中加格达奇(J)分离得到10 株,分别是J002、J016、J018、J021、J033、J041、J046、J054、J071、J073,在大兴安岭呼中(H)分离得到7 株,分 别 是H003、H030、H033、H034、H046、H051、H088,在哈尔滨市帽儿山(A)分离得到7 株,分别是A002、A003、A024、A028、A041、A072、A083,菌落形态见图1,菌株编号见表1。

图1 DSE 菌株菌落形态Fig.1 The morphology of the colony of the DSE strain

表1 菌株编号Table 1 Strain number
通过对ITS 序列的测序和BLAST 比对,在GenBank 中下载同源性高的序列,使用MEGA X中的Neighbour-Joining 算法,构建具有P.bamuru、P.fortinii、A.tamaricis、P.chrysanthemicola、P.radicina、Phomasp.、Cadophorasp.和24 个DSE 菌株ITS 的系统发育进化树(图2),进而研究P.bamuru、P.fortinii、A.tamaricis、P.chrysanthemicola、P.radicina、Phomasp.、Cadophorasp.和24 个DSE 菌株的进化关系。DSE 基因的登录号列于图2中,通过对系统发育树的分析,DSE 中的A003、H030、H033、H034、H046、H051、J021、J033、J041、J046、J054 和P.fortinii聚为一支,A002、A024、A083与P.bamuru聚为一支,J018 和Cadophora sp.聚为一支,J002、J071、J073 和Phoma sp.聚为一支,A028 和A.tamaricis聚为一支,A041、A072 和P.chrysanthemicola聚为一支,H003、H088、J016和P.radicina聚为一支,且基因同源关系较近。

图2 DSE 菌株系统进化树Fig.2 Phylogenetic tree of DSE strains
2.2 深色有隔内生真菌对病原菌的拮抗作用
本实验通过平板对峙法,分别测定24 株DSE真菌被抑制率、立枯丝核菌被抑制率和相对抑制效果。结果见表2和图3,菌株编号见表3,不同DSE 菌株对立枯丝核菌的抑制效果存在显著性差异(P<0.05),其中A024、A002 对立枯丝核菌抑制效果最好,分别为74.69%和71.20%,其次为A028、J041、A041 和H003,抑制效果分别为67.88%、65.97%、65.96% 和65.11%。DSE 被抑制率A024、H046、J016 和A041 分别为3.03%、3.73%、4.45%和5.63%,相对抑制效果最高的为A024,为22.47%,在抑制立枯丝核菌生长的同时,自身菌落生长未受到限制。
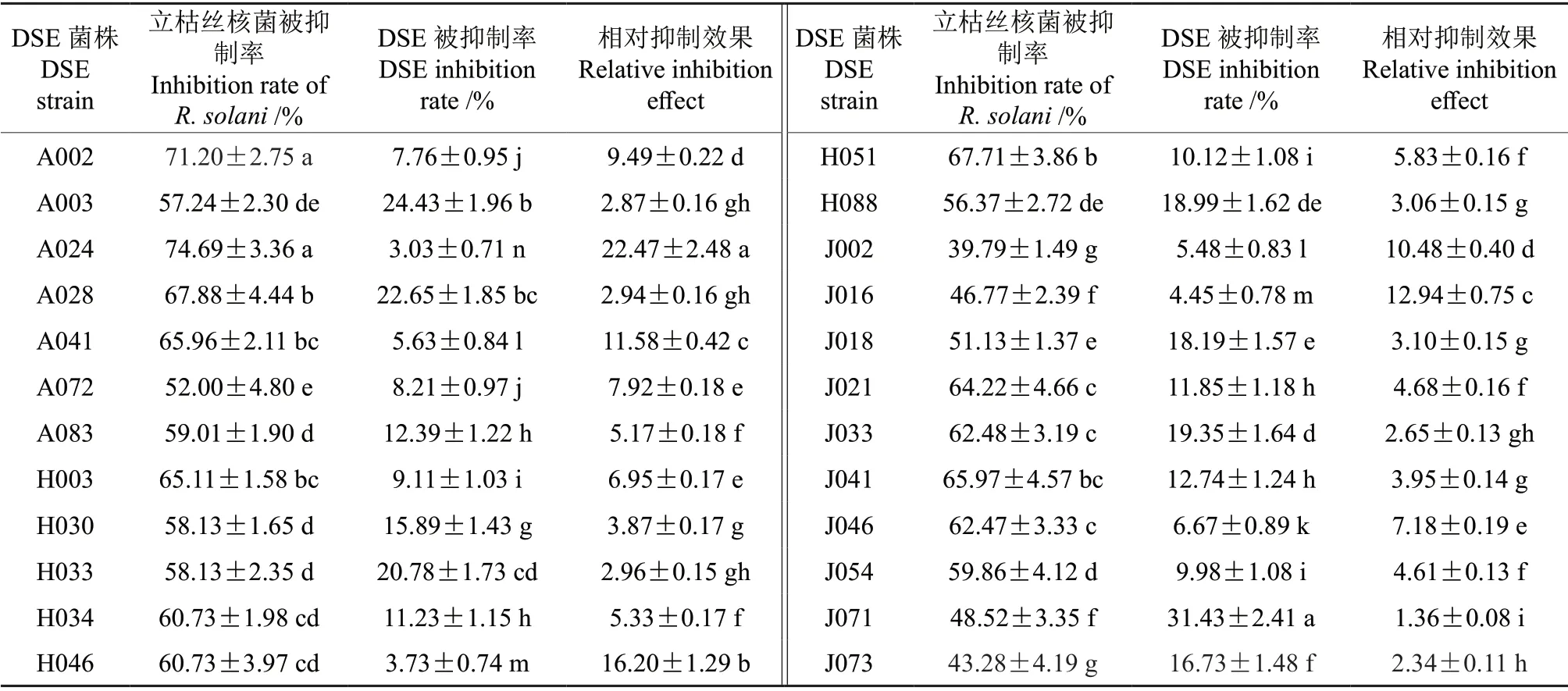
表2 深色有隔内生真菌对立枯丝核菌的抑制率Table 2 Inhibition rate of dark-colored endophytic fungi against R.solani

图3 DSE 与立枯丝核菌对峙培养Fig.3 DSE and R.solani face-to-face culture
表3 菌株编号Table 3 Strain number
综合以上的实验结果,通过采用平板对峙法得出菌株A024 对立枯丝核菌有显著的抑制效果,且DSE 对立枯丝核菌有较强的抗性,满足作为抑制立枯丝核菌高效生防菌株的条件。
2.3 深色有隔内生真菌发酵液对立枯丝核菌菌丝生长的影响
本实验通过发酵液抑菌实验,分别测定24 株DSE 真菌非挥发性代谢产物对立枯丝核菌的抑制作用,结果见图4~5,菌株编号见表4。结果表明,不同DSE 菌株对立枯丝核菌的抑制效果存在显著性差异(P<0.05),部分菌株发酵液对立枯丝核菌的生长具有较强的抑制作用,抑制效果最好的包括A024、A083 和A002,抑制率分别为69.41%、64.11%和54.11%。部分菌株如A003 和H034 发酵液对立枯丝核菌菌丝生长同对照相比,抑制率较低,只有1.29%,对立枯丝核菌生长几乎无影响。

表4 菌株编号Table 4 Strain number
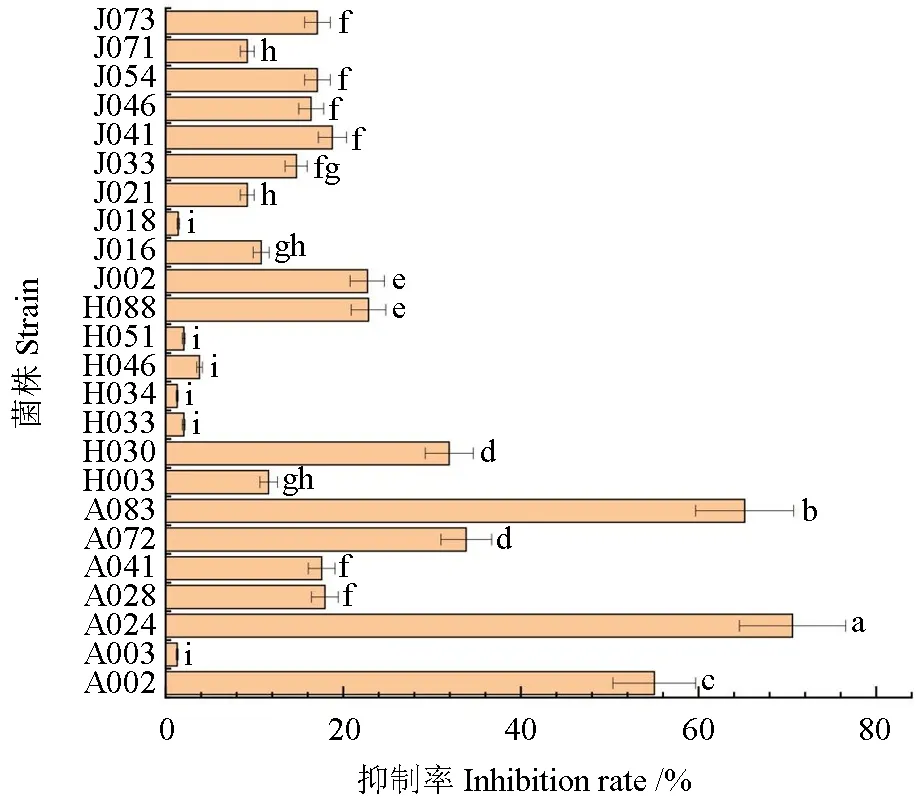
图4 深色有隔内生真菌发酵液对立枯丝核菌生长的抑制Fig.4 Inhibition of the growth of R.solani by the fermentation broth of dark-colored endophytic fungi

图5 DSE 菌株发酵液对立枯丝核菌的抑制作用Fig.5 Inhibition of fermentation broth of DSE strain on R.solani
2.4 DSE 接种对樟子松苗生长的影响
通过接种实验测定24 株DSE 真菌对樟子松1年生苗生长的影响,结果见图6~8,不同接种处理之间存在显著性差异(P<0.05)。

图6 DSE 接种对樟子松苗高的影响Fig.6 The effect of DSE inoculation on seedling height of Pinus sylvestris var.mongolica

图7 DSE 接种对樟子松地径的影响Fig.7 The effect of DSE inoculation on the ground diameter of Pinus sylvestris var.mongolica

图8 DSE 接种对樟子松生物量的影响Fig.8 The effect of DSE inoculation on the biomass of Pinus sylvestris var.mongolica
1)苗高。同对照相比,菌株A003、A024、J033、J041、J021、A002、J018、H051 接种樟子松1年生苗,苗高分别提高21.34%、15.40%、9.41%、7.02%、6.61%、5.68%、5.49%和5.00%。其中菌株A003 和A024 接种对樟子松苗高提高最显著。
2)地径。同对照相比,菌株A003、A024、A028、H051、J033、J073、J016、A083 接种樟子松1年生苗,地径分别提高34.14%、30.67%、24.77%、24.65%、11.46%、9.26%、8.80%和8.45%。其中菌株A003 和A024 接种对樟子松地径提高最显著。
3)生物量。同对照相比,菌株A003、A028、H051、A024、A083、J041、H003 接种樟子松1年生苗,生物量分别提高70.52%、47.20%、39.68%、35.85%、35.49%、14.88% 和11.29%。其中菌株A003 和A028 接种对樟子松生物量提高最显著。
3 结论与讨论
3.1 结 论
对峙试验和发酵液抑菌试验表明DSE 菌株A024 能够显著抑制立枯丝核菌,且DSE 菌株A003 和A024 能够显著提高樟子松的生长发育,高效菌株的获得为进一步研究DSE 对立枯丝核菌的抑制作用机制打下良好基础。
3.2 讨 论
DSE 在不良胁迫下能够改善植物的抗逆性,且DSE 定殖还可提高植物抵抗病害的能力[38]。此外,DSE 还具有促生作用,表现为其可促进植物的营养吸收,进而提高植物的生物量。本研究对DSE 菌株进行了分离与鉴定,共得到24 株DSE 菌株,主要包括P.bamuru、P.fortinii、A.tamaricis、P.chrysanthemicola、P.radicina等。进一步对峙培养和发酵液抑菌实验得出:对峙培养条件下A024、A002 对立枯丝核菌抑制效果最显著,且A024 的相对抑制效果更高;在发酵液抑菌实验中,A024、A083 和A002 对立枯丝核菌的抑制效果最显著。为进一步验证DSE 对樟子松的生长发育是否有不利影响,本试验通过对樟子松根部接种菌株A003 和A024 的方法,发现其可显著提高樟子松的生长发育指标,表现为接种A003和A024 的樟子松幼苗的苗高、地径和生物量显著增加,说明DSE 可通过与植物之间的互作提高植物的生长指标。在促生方面这与孙佳琦[39]等的研究相类似,其实验结果发现接种外生菌根真菌增强了槲树幼苗对营养元素的吸收,提升了光合能力,最终能促进了槲树幼苗的生长。
深色有隔内生真菌可以利用其强大的寄生能力和竞争能力抑制其他病原菌,导致病原菌生长缓慢甚至停止生长[40-41]。本实验结果表明部分DSE 显著抑制了樟子松立枯丝核菌的生长情况,与前人研究一致,例如:胡丽杰[42]在对峙实验中发现深色有隔内生真菌能够显著抑制胶孢炭疽菌(Colletotrichum gloeosporioides),其中菌株NQ8G114 对病原菌的抑制率高达93.43%,同时菌株NQ7G114 在发酵液抑菌率达70.75%。农倩等[43]研究发现,通过平板对峙和盆栽实验均筛选出1 株DSE L-14,能够显著抑制香蕉枯萎病,抑制率分别达72.4%和56.5%。宋小双等[44]同样在对峙实验中发现深色有隔内生真菌D202 能够显著抑制立枯丝核菌,抑菌率达67.25%。本研究与前人研究进一步证明深色有隔内生真菌具有显著的抗病效果。此外,本文发现的DSE 能够提高植物抗病性的原因可能为以下两点:1)通过自身代谢产生抑菌物质,例如:Tellenbach 等[45]研究筛选出DSE产生的次生代谢物 Sclerin、Sclerolide、Sclerotinin A 和Sclerotinin B 对疫霉菌具有显著抑制作用;2)诱导植物产生防御反应,主要体现在诱导植物根系提高次生代谢物质含量和防御蛋白活性。
DSE 可以改善植物的生长发育进而提高植物抗病性[46]。例如:褚洪龙[47]通过对油松幼苗接种DSE 发现能够显著提高其根部生物量。邓勋等[48]研究发现樟子松接种DSE 能够显著提高樟子松幼苗的株高、地径和生物量。在本研究中同样发现DSE A003 和A024 菌株能够显著提高樟子松生长发育,增强树势,间接增强植物的抗病性,而其余菌株均未显著提高植物的生物量,可能与菌株的种类存在一定关系。值得注意的是,DSE 在植物根系能够形成菌根圈(Mycorrhizosphere),可促进植物生长激素(吲哚乙酸IAA)的分泌导致促生作用的产生。本研究存在一定的局限性,例如实验均在实验室条件下和苗圃内进行,未在樟子松林地及其他野外条件下对实验结果进行验证,研究成果是否可以运用到实际中尚未可知。综上,本实验下一步将计划在樟子松林地条件下,验证DSE菌株能否能够促进植物生长并提高其抗病性,并通过转录组学和代谢组学揭示DSE 真菌诱导植物产生抗病性的机理。
