青海湖高寒湿地土壤细菌群落对氮添加的响应
2022-08-10朱锦福黄瑞灵董志强毛晓宁周华坤
朱锦福,黄瑞灵, ,董志强,毛晓宁,周华坤
1.青海师范大学,青海 西宁 810008;2.开封市祥符区农业农村局,河南 开封 475199;3.中国科学院西北高原生物研究所/青海省寒区恢复生态学重点实验室,青海 西宁 810008
湿地作为一种特殊的生态系统,兼具水体和陆地两者的特征,在维持生态平衡、保持生物多样性、气候调节和水源涵养等方面具有不可替代的作用(李甜甜等,2016)。土壤微生物作为湿地生态系统的重要组成部分(Zhang et al.,2012),扮演着调节生态系统物质循环和能量流动的角色(Faulwetter et al.,2009;陈泓硕等,2020),是生物地球化学循环的“引擎”尤其在调节土壤肥力、植物生长和气候变化等方面起着关键作用(邵颖等,2017;葛怡情等,2019)。
土壤微生物中对维持生态系统的稳定发挥着特殊作用(林春英等,2021)。湿地生态系统中土壤微生物多样性,决定着土壤环境质量和生态特征,能更灵敏和全面地反映湿地土壤微生物群落组成和结构的变化(吴松芹等,2017;陈伟等,2019;杨阳等,2022),其区系组成及多样性受土壤环境、植被类型、土壤水分等因素的影响。诸多研究表明,氮沉降影响土壤细菌的生长繁殖与活动能力,从而改变了土壤细菌多样性,进而其群落组成和结构随之发生改变(闫钟清等,2017;韩其飞等,2021;徐润宏等,2021;张世虎等,2022)。
氮素的添加会导致土壤有机质增加,这将为土壤微生物提供生长和发育所需的营养物质,导致土壤中微生物群落丰富度的改变,最终会使土壤中微生物群落结构和物种丰富度发生变化,此结果已被研究所证实(张海芳等,2018)。大气中的氮沉降也是影响土壤微生物群落多样性的因素之一(Kuypers et al.,2018)。氮沉降会改变植物的生长环境和有机碳的输入量和分解速率(刘永万等,2020;李梓萌等,2021;杨阳等,2021)。氮沉降对土壤微生物的影响还存在一些不确定因素,对土壤微生物产生积极作用还是产生负效应还存在争论。Zeng et al.(2016)认为氮沉降对土壤细菌多样性和群落组成也有明显的控制作用。杨山等(2015)则认为随着氮添加梯度的增加,土壤细菌丰度和多样性指数没有发生明显改变。也有研究表明,氮添加量与土壤微生物丰富度和多样性相关,微生物多样性对氮添加存在阈值限制性(李成一等,2020)。
青海湖位于青藏高原东北部,在维持青藏高原以及中国西北部生态安全平衡等方面具有重要作用(Ma et al.,2016)。青藏高原独特的地理环境,对于外界环境变化很敏感,诸多学者围绕青海湖湿地生态环境演变、生物多样性评价、生态功能等方面开展了大量研究(张明等,2017;张中华等,2018;王天慈等,2020),对青海湖湿地的生态价值方面有了更深入的了解(杨阳等,2021),但氮沉降对湿地土壤细菌群落结构和功能产生何种影响,我们的了解仍然有限。因此,通过研究青海湖高寒湿地土壤细菌群落对氮添加的响应,探讨气候变化背景下青海高寒湿地的保育策略,继而为高寒湿地生态系统保护和修复提供数据支撑。通过分析土壤细菌群落对氮浓度梯度的响应特征、土壤细菌群落结构与土壤理化性质之间的关系,为青藏高原高寒湿地生态系统管理提供理论依据。
1 材料与方法
1.1 研究区概况
试验样地位于青海湖湖东 36°41′—36°42′N,100°45′—100°47′E,海拔 3200 m,属典型的高原大陆性气候,光照充足,雨量较少,降水主要集中于6—9月,年平均降水量370 mm、年蒸发量1454.4 mm(刘文玲等,2017)。土壤类型主要为水成性阴育性土壤,以沼泽土和草甸土为主(王记明等,2014),优势植物类型有华扁穗草(Blysmussinocompressus)、禾叶嵩草(Kobresiagraminifolia)、藏嵩草(Kobresiatibetica)、小嵩草(Kobresiahumilis)和苔草(Carexspp.)等(杨英等,2016)。
1.2 试验设计
根据青藏高原大气氮沉降动态变化特征的数据(张静等,2019),年平均氮沉降量 8 kg·hm-2·a-1,在青海湖东岸设置12个2 m×1 m样地,样地间隔25 m,防止相互干扰。设置4个氮梯度处理,施氮水平分别为 0、2、5、10 g·m-2,分别用 N0、N2、N5、N10表示。样方采用随机区组设计,每个处理设置 3次重复。氮肥形态为 NH4NO3,于 2019年5—9月,每月月初按照处理水平进行氮添加处理,将NH4NO3溶解于1000 mL水中,人工均匀喷施于湿地土壤表面,对照则喷施等量的水。2020年 10月初用直径10 cm螺旋取土钻按五点采样法采集表层土壤(0—15 cm)和深层土壤(15—30 cm)土壤样品,去除细根和石块,放入无菌自封袋中,一部分保存在-80 ℃冰箱,用于提取土壤DNA和高通量测序,分析土壤微生物群落功能多样性,另一部分土样放在室内自然风干,磨碎后过100目筛,用于测定土壤理化性质。
1.3 样品测定
样品DNA的提取、扩增和高通量测序等工作均由北京百迈客生物科技有限公司(https://international.biocloud.net/zh/dashboard)完成。采用MN NucleoSpin 96 Soi试剂盒进行DNA提取,具体提取方式参照说明书进行。对细菌16S rRNA 区域进行扩增,扩增引物为:338F:5′-ACTCCTACGGGAGGCAGCA-3′和 806R:5′GGAC TACHVGGGTWTCTAAT-3′;PCR 扩增程序为:95 ℃预变性5 min,接着95 ℃变性30 s,50 ℃变性30 s,72 ℃变性60 s,进行20+10 cycles;循环结束后进行72 ℃延伸5 min,4 ℃最终延伸∞。目标区域PCR产物根据电泳定量(ImageJ 软件)结果,按照质量比1∶1进行混样,混样后,采用OMEGA DNA纯化柱进行过柱纯化,1.8%的琼脂糖凝胶,120 V 40 min电泳后,切目的片段,并回收,采用Illumina HiSeq 2500测序仪完成序列分析。
土壤酸碱度用土壤酸碱度计测量;土壤含水量采用烘干法测定;土壤全碳、全氮采用意大利 NC Technologies公司Costech ESC 4024元素分析仪测定;土壤有机碳采用总有机碳分析仪(Elementa,Germany)测定;土壤氨态氮、硝态氮的测定采用全自动间断化学分析仪(CleverChem)测定。
1.4 数据处理
基于高通量测序技术、生物信息分析技术和生物云计算技术(https://international.biocloud.net/zh/dashboard),对原始数据进行拼接(FLASH,version 1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic,version 0.33),并去除嵌合体(UCHIME,version 8.1),到高质量的Tags序列。在相似性 97%的水平上对序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005%作为阈值过滤OTU。对样品进行97.0%的相似度水平下进行物种聚类分析,获得 OTU数,进行Alpha、Beta多样性分析和RDA分析,判断氮添加对土壤不同深度细菌多样性的影响。此外,用IBM SPSS Statistics 19.0软件对不同氮添加下土壤理化性质和细菌门水平多样性之间的相关性进行分析。数据以平均值±标准偏差的形式列出。
2 结果与分析
2.1 不同氮添加土壤基本理化性质
由表1可知,土壤pH值在7.3—7.57之间,研究区湿地土壤环境呈弱碱性,N10添加后,虽pH值提高,但各处理间差异不显著(P>0.05),氮沉降对土壤pH没有显著影响。不同处理间土壤水分存在差异,随施氮量的增加土壤水分逐渐增加,且表层土壤水分显著高于深层土壤水分(P<0.05)。总碳含量随施氮量增加而增加,总体上表层土壤高于深层土壤,N5处理下表层和深层含量高于其他处理,但各处理间差异不显著;在深层土壤中,N2处理下总碳含量最低为 9.73,与其他处理差异显著(P<0.05)。在表层土壤中有机碳含量随施氮量增加而增加,除N2外,其余处理均高于对照,在N10处理下含量最高,显著高于其他处理(P<0.05);深层土壤有机碳含量与N0对比均有所降低,各处理间差异不显著,表层土壤有机碳较深层土壤对外源性扰动响应更加敏感。氮素是植物生长的重要元素之一。不同土壤层全氮的含量均不相同。表层土壤全氮含量呈现递减趋势,深层土壤全氮含量呈先上升后下降趋势,且N5、N10与N0、N2差异均显著。土壤层氨态氮含量,N2处理显著低于对照和其它处理,在表层土壤中氨态氮含量表现为减少,在深层土壤中表现为增多。土壤硝态氮含量均表现为表层高于深层,N2和N5处理均高于对照,深层土壤之间差异均不显著。

表1 不同氮添加处理对土壤理化性质的影响Table 1 Effects of different nitrogen addition treatments on soil physical and chemical properties
2.2 土壤样本测序结果
测序结果经低质量序列过滤后,表层土壤中,氮添加变化下平均有效序列分别为72926、75666、75691和76087;深层土壤中,平均有效序列分别为76835、76945、77097和76618(结果见表2)。根据97%的相似度水平,对所有序列进行OTU划分,表层土壤样品共获得1714个OTU,深层土壤共获得1704个OTU。利用测序获得序列构建稀释性曲线(见图 1),表层土壤和深层稀释性曲线均趋于平缓,表层土壤细菌覆盖率为99.61%,深层土壤细菌覆盖率为99.71%,当前测序样本量足以反映土壤不同深度细菌群落的实际情况,测序结果合理。

图1 土壤稀释性曲线Figure 1 Dilution curve of soil
2.3 不同氮浓度处理下土壤细菌数量
细菌是土壤微生物中数量最多的一个类群。由表 2可见,表层土壤中细菌数量在 6.68×106—108.81×106cfu·g-1之间,变化趋势呈“N”形,在 N2处理下达到最低值,在N5处理下达到最高值,且N5和N10处理下显著高于N0和N2处理。深层土壤中细菌的数量在 3.13×106—104.65×106cfu·g-1之间,变化趋势与表层土壤一致,均在N2处理下达到最低值,在N5处理下达到最高值,且N5和N10处理下细菌数量显著增加,氮添加提高了高寒湿地土壤细菌数量。
2.4 不同氮浓度土壤细菌丰度及多样性
不同氮添加处理对土壤细菌丰度和多样性指数的影响存在差异(表2)。ACE和Chao1指数衡量细菌丰度即细菌数量的多少,Shannon与Simpson指数均用于衡量物种多样性,指数越大,细菌多样性越高。在表层土壤,随着氮添加浓度的增加,土壤细菌ACE和Chao1指数均表现为降低趋势;而在深层土壤,土壤细菌ACE和Chao1指数与其表层的变化不一致,与N0相比,ACE和Chao1指数均有所上升,且在 N10处理中丰度指数最高,为1458.71、1496.97。不同氮添加湿地之间Simpson指数有所变化,与N0对比,表层土壤呈递增趋势,深层土壤均有所下降,但差异不大。Shannon指数在表层土壤中表现为逐渐增加,在 N10中最大,为8.81,深层土壤的Shannon指数较N0降低,氮添加增加了表层土壤细菌多样性,降低了深层土壤细菌多样性,氮添加对深层土壤细菌多样性具有负影响。

表2 不同氮添加处理中土壤细菌丰度及多样性指数Table 2 Soil bacterial abundance and diversity index under different nitrogen addition treatments
2.5 不同氮添加下土壤细菌群落组成分析
基于微生物多样性分析平台,检测到湿地土壤细菌为26门71纲156目267科428属452种,绝大多数为单属单种。在青海湖高寒湿地土壤细菌门分类水平上,占表层土壤细菌群落主导的细菌门有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、己科河菌门(Rokubacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)等,占整个湿地细菌群落组成的96.7%以上,见图2a。在表层土壤中,氮添加增加了放线菌门(Actinobacteria)的丰度,降低了己科河菌门(Rokubacteria)和芽单胞菌门(Gemmatimonadetes)菌门的丰度,变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)丰度变化幅度较小,在 42.56%—44.42%和 25.28%—25.26%间波动。
深层土壤细菌群落在门水平上占主导细菌门的有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、己科河菌门(Rokubacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae),占整个细菌群落组成的97.6%以上,见图2b。在深层土壤中,氮添加增加了变形菌门(Proteobacteria)和放线菌门(Actinobacteria)的丰度,降低了己科河菌门(Rokubacteria)和芽单胞菌门(Gemmatimonadetes)的丰度。湿地主要优势菌门随氮添加增加,其含量虽发生变化,但处于相似生境下,门水平分类下土壤细菌群落组成基本一致。另外,在表层土壤细菌中,放线菌门和厚壁菌门对氮添加响应较大,N10显著增加放线菌菌门丰度,而N5显著增加厚壁菌门丰度。
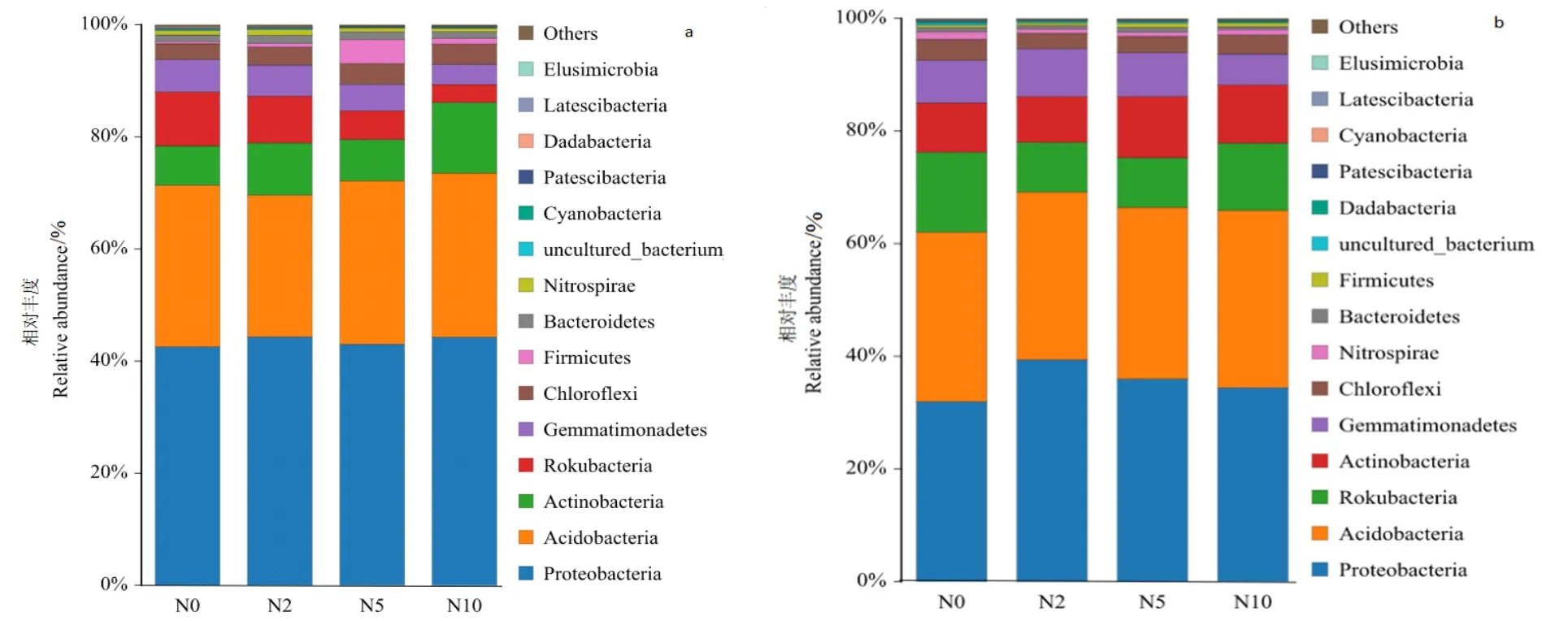
图2 门水平上土壤细菌群落组成Figure 2 Composition of soil bacterial community at phylum level
2.6 土壤理化性质与细菌丰度及α多样性指数相关分析
从表3可以看出,土壤理化因子与细菌多样性指数的相关性。表层土壤中,全碳与ACE丰度指数呈显著负相关(P<0.05);硝态氮与Chao1指数呈极显著正相关(P<0.01);氨态氮与Simpson多样性指数呈极显著负相关(P<0.01),与Shannon多样性指数呈显著负相关(P<0.05)。在深层土壤中,土壤酸碱度与Simpson和Shannon多样性指数呈显著正相关(P<0.05);水分、有机碳和全氮与细菌ACE和Chao1丰度指数呈显著正相关(P<0.05),且水分贡献最大,影响极显著(P<0.01);全碳与Simpson多样性指数呈显著负相关(P<0.01);而硝态氮与 Shannon多样性指数呈显著负相关(P<0.05)。

表3 土壤细菌多样性与土壤理化性质Pearson相关性分析Table 3 Pearson correlation analysis between soil bacterial diversity and soil physical and chemical properties
2.7 土壤理化性质对细菌群落结构的RDA分析
基于门水平下土壤细菌群落分布与理化性质的RDA分析(见图3),从图3a可以看出,有机碳、硝态氮、全氮、氨态氮射线较长,表明其对在表层土壤中细菌群落分布影响较大,反之则较小。同时还可以看出,N0土壤中硝化螺旋菌门(Nitrospirae)、己科河菌门(Rokubacteria)和芽单胞菌门(Gemmatimonadetes)分布主要受硝态氮、全氮和水分的影响,且有正相关;N2土壤中拟杆菌门(Bacteroidetes)分布主要受pH影响,其它影响因子贡献不大;N5土壤中酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)分布主要受pH和氨态氮影响,其中氨态氮贡献最大且有正相关;N10土壤中放线菌门(Actinobacteria)分布主要受有机碳影响,且有正相关。图3b可以看出,在深层土壤,N0细菌中绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)和己科河菌门(Rokubacteria)基本不受土壤理化性质的影响;N2土壤中细菌的达达菌门(Dadabacteria)和变形菌门(Proteobacteria)分布主要受全碳和硝态氮的影响,且呈正相关;N5土壤中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)分布受全碳、水分、有机碳、全氮以及pH影响,其中全氮对几个菌门分布影响最大;N10的变形菌门(Proteobacteria)分布受全碳因素影响,呈正相关,而绿弯菌门(Chloroflexi)则与全碳因素呈负相关。在深层土壤中,环境因子主要对达达菌门(Dadabacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)分布产生影响,且呈正相关;而绿弯菌门(Chloroflexi)则与全碳因素呈负相关,硝化螺旋菌门(Nitrospirae)和己科河菌门(Rokubacteria)对土壤理化性质的变化反应迟钝。

图3 土壤细菌与理化因子的RDA分析Figure 3 RDA analysis of bacteria and physicochemical properties
3 讨论
3.1 氮添加对土壤理化性质的影响
本研究发现不同氮添加处理下的青海湖湿地土壤基本理化性质存在差异显著。表层土壤和深层土壤pH虽有波动性变化,但各处理间差异并不显著(P>0.05);表层土壤水分随着N添加而增加,在N10处达到最大值,深层土壤水分在N5处达到最大值,当水分条件良好时,氮的添加会对土壤微生物量有着正向促进作用。高氮的输入导致深层水分下降,这是因为高氮的添加导致土壤有效氮含量增加,有效氮被植物吸收后,促进了植物的根系生长和自身发育。表层土壤随着氮浓度的不断增加,有机碳的含量也在增加,在N10处达到最大;深层土壤有机碳的含量最大值在 N5。外加氮素满足了土壤微生物对氮素的需求,从而促进了凋落物的分解。氮沉降增加使土壤中可溶性酚类物质逐渐积累,从而增加了土壤有机碳的含量,但由于深层土壤微生物活性低,使表层土壤有机碳含量较深层土壤高。也有研究发现,氮的添加会通过降低矿化速率,抑制稳定性碳的分解,减少土壤碳输出来增加有机碳的积累(刘银银等,2013)。氮素是构成一切生命体的重要营养元素,全氮在一定程度上能反映土壤氮素的供应状况。本研究中,表层土壤全氮含量呈递减趋势,深层土壤中的全氮含量较对照均有提高,且在N5达到显著水平,二者所表现出来的响应完全不同。这可能是氮沉降输入到湿地中的氮大部分保留在表层土壤,当湿地生态系统达到“饱和”时,进一步的氮输入将导致生态系统负氮,过剩的NH4+可能发生硝化作用,进而造成氮的淋溶损失,使得氮素含量下降。这与前人的研究不尽相同(叶彦辉等,2017),原因可能是本研究开展氮沉降时间较短。
3.2 氮添加对土壤微生物群落结构的影响
湿地土壤中的微生物在“能量平衡”特别是碳氮平衡中扮演重要角色,在元素循环、特别是N、C元素循环、能量流动等过程中有着重要作用(裴希超等,2009)。其生物量约占土壤总有机碳的1%—5%,尽管其库容小,但周转速度快,是土壤有机质中最活跃的部分(聂秀青等,2021)。微生物中的固氮菌和根瘤菌都是可以把氮气转化为氮或者铵盐,从而把氮素输入到生态系统的循环中。氮添加可以迅速改变土壤基底营养状况,引起土壤理化指标发生变化,对土壤微生物产生影响(郭萍萍,2015),继而改变微生物群落组成和多样性(陈谦等,2010)。湿地是碳氮循环得重要发生场所,相关研究表明湿地土壤细菌群落组成在门分类水平上主要有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、己科河菌门(Rokubacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)、硝化螺旋菌门(Nitrospirae)(Hollister et al.,2010;Xu et al.,2019)。其中,丰度超过10%的菌门有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria),放线菌门(Actinobacteria)、己科河菌门(Rokubacteria),为高寒湿地土壤细菌主要优势菌门,这与本文研究结果基本一致,说明虽然取样地点不同,对于生活在相似生境的细菌群落组成比较接近。但是,氮添加改变了土壤细菌菌门丰度和多样性。在表层土壤中,氮添加增加了变形菌门(Proteobacteria)物种分布,但对氮添加响应不显著,增幅不明显;放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)随氮添加增加呈递增趋势,放线菌门(Actinobacteria)在N10增幅最高,为79.62%、绿弯菌门(Chloroflexi)在 N5增幅最高,为 30.61%;己科河菌门(Rokubacteria)和芽单胞菌门(Gemmatimonadetes)随氮添加增加呈递减趋势,均在 N10降幅最为明显,分别降低了 33.40%和 62.24%;酸杆菌门(Acidobacteria)随氮添加增加呈先下降后上升趋势,增幅较小;厚壁菌门(Firmicutes)常参与有机质的分解和微生物固氮过程,其分布情况则与酸杆菌门(Acidobacteria)相反,随氮添加增加呈先上升后下降趋势,N5增幅最高,是N0的11.16倍,对氮添加响应极显著。在深层土壤中,氮添加对酸杆菌门(Acidobacteria)分布影响不大;己科河菌门(Rokubacteria)和绿弯菌门(Chloroflexi)随氮添加增加呈下降趋势,均在N2、N5降幅较大,己科河菌门(Rokubacteria)分布分别降低了 60.98%和62.21%、绿弯菌门(Chloroflexi)分布分别降低了35.69%和29.68;变形菌门(Proteobacteria)和芽单胞菌门(Gemmatimonadetes)随氮添加增加呈先上升后下降趋势,均在N2增幅最高分布最广,增幅分别为23.26%和12.24%;放线菌门(Actinobacteria)随氮添加增加呈递增趋势,且在N5增幅最高,为24.56%;硝化螺旋菌门(Nitrospirae)则与放线菌门(Actinobacteria)相反,氮添加降低了硝化螺旋菌门分布情况。由此可以看出,氮添加提高了放线菌门(Actinobacteria)分布,却降低了己科河菌门(Rokubacteria)分布,这一研究结果与Fierer et al.(2007)不一致,可能与高寒湿地生态系统的脆弱性和敏感性相关。土壤细菌门水平Simpson和Shannon多样性随氮添加增加而升高,在N5、N10浓度处理下细菌多样性均有所增加,Simpson最大值出现在N10表层土壤中、为0.9935,Shannon最大值出现在N5表层土壤中,为8.75,Simpson和Shannon指数越大,说明样品的细菌多样性越高。由此可以看出,氮添加影响湿地土壤细菌的多样性,在门水平上表层土壤中细菌多样性高于深层土壤。在本研究中,添加不同浓度的氮素,改变土壤微生物细菌群落的 OTU丰富度以及土壤细菌群落组成,导致这一结果的原因可能是因为氮素可以提高速效氮的累计,改变土壤理化性状,引起土壤中微生物的生境发生改变,也改变了土壤地上和地下部分的微生境,从而导致土壤微生物多样性增加。
3.3 氮添加背景下微生物量与土壤环境因子的关系
氮添加引起土壤微生物数量的改变已是不争的事实。随着氮浓度的增加,土壤微生物数量也在增加,湿地土壤微生物数量受土壤营养限制较大,本试验的施氮量可能还没有达到土壤的氮限制水平,从而促进了土壤细菌的生长,并在较高水平的N5和N10处理下达到显著水平。也有研究认为氮沉降给土壤微生物生物量带来的是消极影响(王庆贵等,2021),本研究与此结果不相同,表明我们还需从沉降强度、生境类型等方面开展持续、深入的研究,才能使我们更好地了解氮沉降对生态系统中微生物的影响。氮添加对细菌群落结构的影响,在门水平上,N的添加显著降低了己科河菌门、芽单胞菌门、绿弯菌门和硝化螺旋菌门的相对丰度,显著增加了厚壁菌门的相对丰度,而酸杆菌门相对丰度变化不明显。酸杆菌门丰度变化不大,主要受土壤pH值影响,酸杆菌门适应低pH条件,本研究结果中土壤呈弱碱性。据报道,厚壁菌门受土壤C、N的影响(Karimi et al.,2018),本研究中,N添加导致全N和全C含量升高,厚壁菌门的相对丰度显著提高,说明N添加对厚壁菌门活性有显著促进作用。硝化螺旋菌门的相对丰度非常低,N添加下其菌门降低,表明硝化活性下降,N添加对硝化螺旋菌门有抑制作用。土壤细菌群落结构的差异主要受土壤理化因子对土壤细菌多样性有显著影响。氮添加可以通过改变土壤理化因子直接影响土壤细菌丰度及多样性,N添加对深层土壤的 ACE和Chao1指数的影响为正效应,对Simpson和Shannon的影响为负效应,说明N沉降增加了土壤细菌群落的相对丰度,而降低了土壤细菌多样性。本研究中,有机碳和全氮对深层土壤细菌的相对丰度影响极显著,氨态氮对表层土壤的多样性影响极显著。施加氮肥,提高土壤的含氮量,提高了地上植物的生产力,从而使植物凋落物含量增加,最终导致土壤有机碳的累计,有机碳含量高的土壤可以提高有效碳源,为土壤微生物提供生长发育所需要的能量来源,促使土壤中的微生物保持较高的活性。
4 结论
通过高通量测序技术研究青海湖高寒湿地土壤细菌群落丰度和结构,揭示了环境因子与湿地土壤中细菌群落结构组成的内在联系。氮添加后,高寒湿地表层土壤全碳、有机碳含量明显增加,而土壤pH的变化对N素添加响应不明显。氮添加影响土壤细菌丰度及多样性,有机碳和全氮对深层土壤细菌的相对丰度影响极显著,氨态氮对表层土壤的多样性影响极显著。本研究结果不仅使我们增加了对青海湖高寒湿地土壤微生物群落组成及其主要影响因素的了解,从而更好地进行湿地生态系统管理,也为研究全球气候变化下微生物介导的元素循环提供了理论参考。
