122,635例赣南地区新生儿耳聋基因筛查及确诊者结果回溯分析
2022-06-15邱小兵黄俊高陈俊坤李良玉
邱小兵黄俊高陈俊坤李良玉
1赣州市妇幼保健院(赣州 341000)
2解放军总医院第六医学中心耳鼻咽喉头颈外科医学部(北京 100853)
先天性耳聋是影响婴幼儿健康和造成残疾的常见原因,同时也是中国高发的出生缺陷之一,在每年新增的先天性听力障碍患儿中,约50%-60%属于遗传性耳聋[1,2]。为尽早发现听障个体或高危幼儿,及时给予干预和治疗,我国已在临床逐步推广新生儿听力与基因联合筛查,通过对新生儿中耳聋基因突变携带者的早期发现与预警,有效预防和减缓耳聋的发生发展。
耳聋基因突变的分布存在一定地区和人群的差异[3],目前江西地区尚未见有大人群的筛查报道,本研究通过高通量测序技术对赣州市122,635例新生儿进行了大规模自然人群的耳聋基因热点突变检测,有效检出了先天性耳聋的基因高风险患儿并对迟发性聋及药物性聋进行了风险提示,基于大数据明确了赣南地区的耳聋基因热点突变和分子流行病学频谱,为后续制定耳聋等相关出生缺陷的防控策略提供了重要参考和依据。
1 对象与方法
1.1 研究对象
2019年4月到2020年9月间,对赣州市及下辖县区内122,635例新生儿进行耳聋基因检测,其中85,932例新生儿同时接受了听力初筛,后续发现有听力异常或基因提示高风险的幼儿临床建议统一在赣州市妇幼保健院进行听力诊断与评估。本研究经赣州市妇幼保健院伦理委员会批准开展,进行筛查的新生儿监护人均签署知情同意。
1.2 检测方法
1.2.1 听力筛查
新生儿出生三天后采用耳声发射(OAE)进行初次听力筛查,初筛未通过及漏筛者在出生后29-42天内采用OAE联合自动听性脑干反应(AABR)检测进行复筛,仍未通过者将结果告知新生儿监护人,并要求于3月龄时返院进行听力诊断。
1.2.2 耳聋基因检测
新生儿出生3天内采集足跟或脐带血三个血斑,制成干血片封存送往深圳华大基因临床检验中心进行检测。根据我国遗传性耳聋基因热点突变位点序列信息,设计特异性扩增引物,利用多重PCR技术扩增富集人基因组DNA中靶序列并同时引入用于样本识别的样本标签序列。96个样本的PCR产物将按比例混合成为一个文库样本,经文库制备,每个文库样本中的DNA序列都加上了用于测序及文库识别的接头序列。文库样本按等物质的量比例混合为一个测序样本,应用华大智造MGIseq500测序仪进行上机测序,下机数据经过文库接头序列及样本标签序列比对拆分后将被精确定位到每一个样本中,测序结果与人类基因组比对,并对20个热点突变位点进行变异检测,这些位点包括GJB2基因上的c.35delG、c.176_191del16、c.167delT、c.299_300delAT和c.235delC、GJB3基因上的c.538C>T和c.547G>A,SLC26A4基因上的c.281C>T、c.589G>A、c.1174A>T、c.1226G>A、c.919-2A>G、c.1229C>T、c.1975G>C、c.2162C>T、c.2027T>A、IVS15+5G>A和c.2168A>G和线粒体12SrRNA基因上的m.1555A>G、m.1494C>T位点。
1.2.3 听力诊断及评估
听力筛查未通过或基因检测提示高风险或后续自行发现听觉异常的幼儿均建议在赣州市妇幼保健院进行听力诊断。建立患儿病历,询问并收集耳聋家族病史。采用听性脑干反应(ABR)、耳声发射(OAE)、声导抗或多频稳态等检测方法对患儿进行针对性或联合检测。听力损失分级标准依据WHO1997年(日内瓦)推荐的听力减退分级标准。
1.3 统计学方法
相关数据统一录入EXCEL表进行处理统计,计数资料以百分比表示。
2 结果
2.1 122,635例新生儿耳聋基因筛查结果分析
共完成122,635例新生儿耳聋基因筛查,检出突变携带者5066例,阳性率为4.13%(5066/12,2635)。GJB2基因突变新生儿2497例(49.29%,2497/5066),其中杂合突变2485例,纯合突变9例(c.235delC),复合杂合突变3例;GJB3基因突变新生儿304例(6.00%,304/5066),全部为杂合突变;SLC26A4基因突变1862例(36.75%,1862/5066),其中杂合突变1837例,纯合突变3例(c.919-2A>G),复合杂合突变22例;线粒体12SrRNA基因突变332例(6.55%,332/5066),同质性突变259例,异质性突变73例。此外,本次筛查还检出双基因突变70例,其中69例为双基因杂合突变,还有一例同时携带有GJB2基因纯合突变(c.235delC)和SLC26A4基因杂合突变(c.919-2A>G)。具体突变位点、例数及携带率见表1及表2。
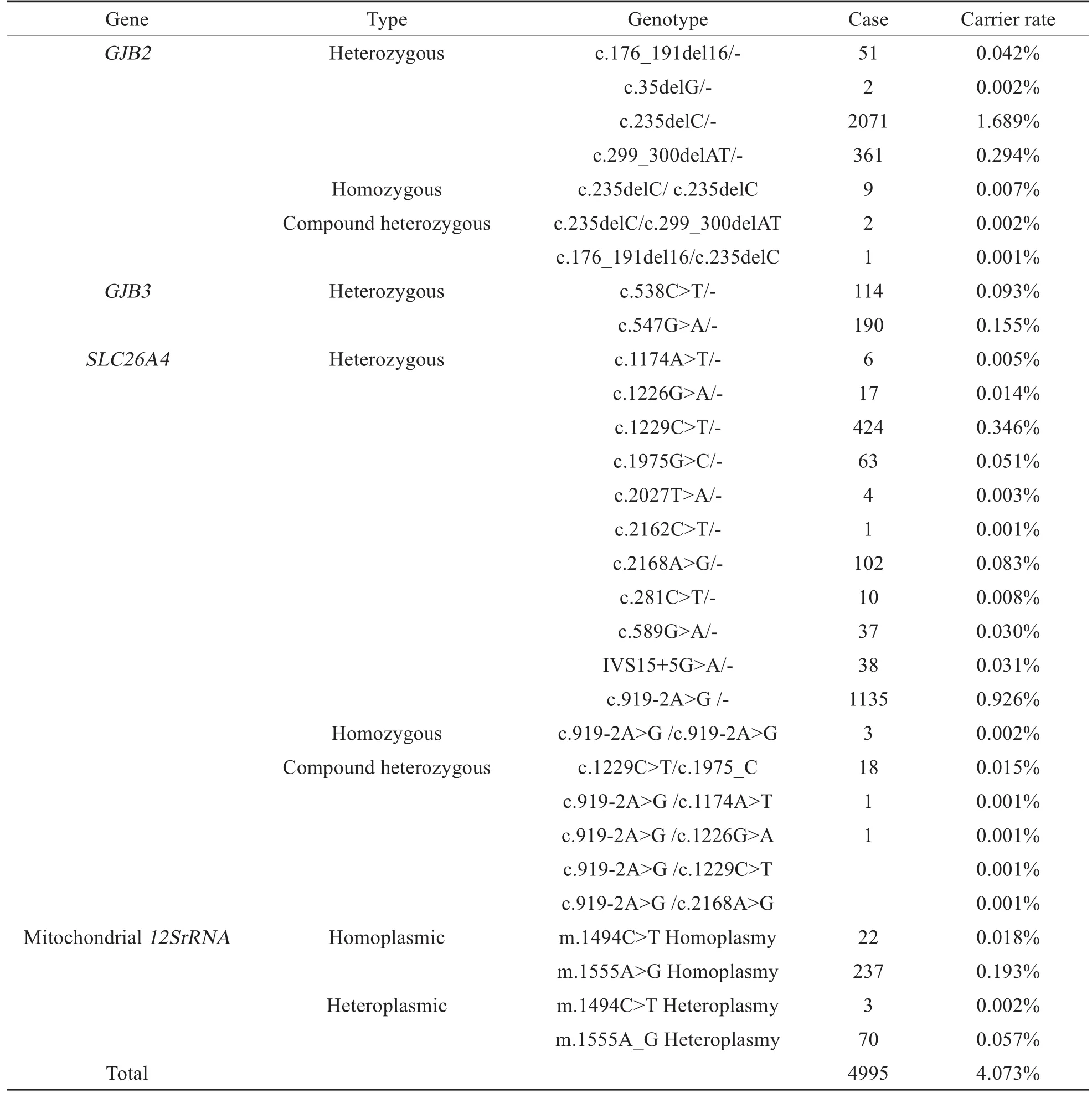
表1 5066例阳性检出者中单基因突变结果Table 1 The mutations of 5066 positively detected newborns within single gene

表2 5066例阳性检出者中多基因突变结果Table 2 The mutations of 5066 positively detected newborns within multiple genes
2.2 新生儿听力初筛联合基因检测结果
在122,635例接受耳聋基因检测的新生儿中,共有85,932例可获得听力初筛结果,其中80,184例新生儿通过了听力初筛,初筛通过率为93.31%(80184/85932)。在通过听力初筛的新生儿中,发现耳聋基因纯合突变儿6例(4例c.235delC/c.235delC,2例c.919-2A>G/c.919-2A>G),复合杂合突变儿15例(12例c.1229C>T/c.1975G>C;1例c.176_191del16/c.235delC;1例 c.919-2A>G/c.1226G>A;1例c.919-2A>G/1229C>T),线粒体基因12SrRNA突变349例。
2.3 确诊听力损失患儿的耳聋基因检测及听力初筛结果
项目开展及后续随访期间,在赣州市妇幼保健院进行听力学诊断的幼儿中,共有44例确诊听障患儿(35例为单耳或双耳感音神经性听力损失)可追溯到基因检测结果,共检出15例突变携带者(13例确诊单耳或双耳感音神经性听力损失),阳性率为34.1%(15/44),其中GJB2基因纯合突变3例,GJB2基因复合杂合突变2例,SLC26A4基因复合杂合突变2例,其他单基因杂合突变携带者8例。在这44例确诊听力损失的患儿中,共有25例同时追溯到了耳聋基因检测及听力初筛结果,其中有8例患儿通过了听力初筛,在这8例患儿中有1例中/重度(SLC26A4复合杂合突变)和1例极重度(GJB2纯合突变)听力损失患儿,均为双耳感音神经性听力损失。此外,在19例未作听力筛查的确诊患儿中检出2例GJB2基因纯合突变,1例SLC26A4基因复合杂合突变,5例单基因杂合突变。具体耳聋基因检测和诊断结果见表3。
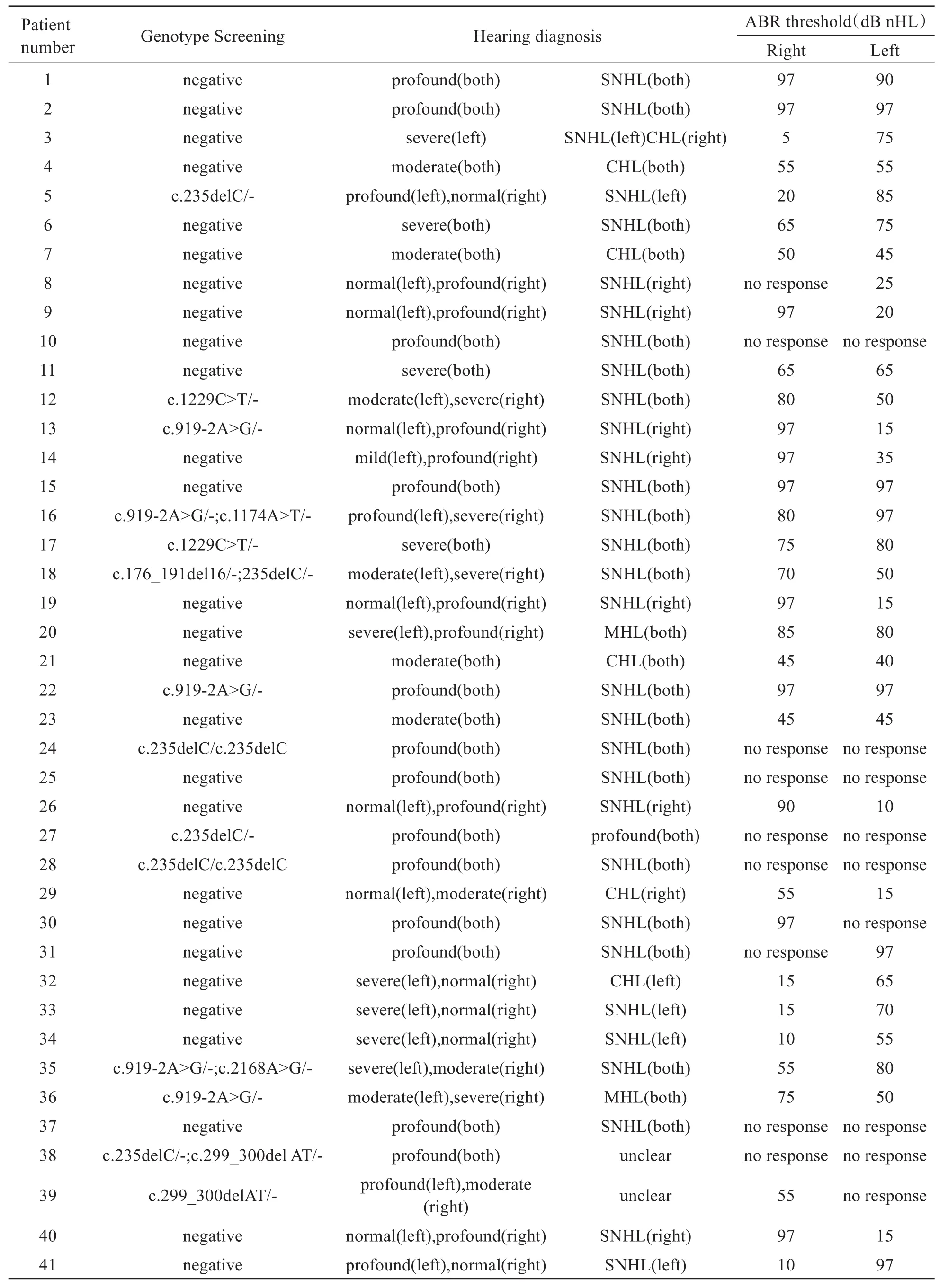
表3 确诊听力损失患儿的耳聋基因检测及听力诊断结果Table 3 The genotype and hearing diagnosis of patients

上接表3
3 讨论
我国每年约有3万名耳聋患儿出生,其中由先天性基因缺陷导致的不在少数,同时很多迟发性听力下降患者或后天用药致聋个体也都被认为与基因多态性或易感性有关,现有研究显示,有50-65%的耳聋发病与遗传因素相关,其中约70%为非综合征型耳聋,不伴有其他临床表型[2,3]。新生儿听力筛查联合基因检测在耳聋出生缺陷防控中具有重要意义,不仅可以提示迟发性及药物性耳聋的基因高风险患儿,还可以补充检出或预警听力筛查中漏检的部分先天性耳聋患儿[4]。王秋菊等人[5]在2007年即提出了新生儿听力与基因联合筛查的理念,目前联合筛查已在国内广泛开展。
基于本文中大规模的人群普筛结果看,赣南地区新生儿耳聋基因携带率为4.13%,总体携带率与此前南昌地区所报数据基本一致(4.05%)[6],并接近于其他文献报道的4.17-5.15%[7-14]。听力筛查中,共可采集到85,932例初筛结果数据,与耳聋基因筛查人数相比,有3万余例新生儿的听力初筛结果未获得,复筛结果均为手写记录于相关医疗机构中,难以电子化进行数据的快速整理与统计,这些在一定程度上表明听力筛查工作在我国基层地区的开展需要进一步推广落实,并需加强医疗卫生数据的电子化和可追溯性。在已有的8万余例听力初筛结果中,初筛阳性率为6.69%,与其他研究相比数据接近[6,8,10,14]。
本研究中检测到的耳聋基因突变主要发生在GJB2和SLC26A4基因上,携带率分别为2.04%和1.52%,与南昌地区所报数据略有差异(分别为2.63%和1.01%)[6]。其中GJB2基因在本研究中检测到的前二热点突变为235delC:杂合突变和299_300delAT:杂合突变,合计占到了该基因阳性结果中的97.4%,此外还检测出了9例纯合突变和3例复合杂合突变。其中最热点的突变为235delC突变,在听力正常人群中携带率为1%~2%[15,16]。GJB2基因纯合突变或复合杂合突变有较大概率导致先天性重度耳聋[16]。结合后期的耳聋患儿听力诊断结果,共有3例235delC纯合突变和2例GJB2基因复合杂合突变个体被确诊为耳聋患儿,其中2例纯合突变均为双耳极重度听力损失,1例纯合突变和2例复合杂合突变为中/重度听力损失。
SLC26A4基因在本研究中检测到的前二热点突变为c.919-2A>G杂合突变和1229C>T杂合突变,合计占到该基因阳性结果中的83.7%,此外还检测出了3例纯合突变和22例复合杂合突变。SLC26A4基因突变是引起感音神经性聋的主要遗传学病因之一,一般表现为常染色体隐性遗传。该类基因突变致聋的患儿在成长过程中,可能因头部运动、外力作用、巨大声音等物理因素而诱发耳聋[17]。结合同期的耳聋患儿听力诊断结果,共有2例SLC26A4基因复合杂合突变个体被确诊为耳聋患儿,分别为重度/极重度听力损失和中/重度听力损失。
线粒体12SrRNA基因与氨基糖苷类药物引起的药物耳聋密切相关。本研究共检测出线粒体基因突变共332例,突变携带率为0.27%,落于国内外相关研究中报道的0.224%~0.345%的区间内,与此前有关研究中发现的江西地区线粒体突变携带率较高的结果(0.38%)不一致[6],这可能与检测的群体规模以及更细微的地区差异性有关。GJB3基因最初被发现在中国患者中导致常染色体显性遗传非综合征型聋,被认为与迟发性耳聋相关[9]。在本次同期确诊耳聋的幼儿中,未发现线粒体基因及GJB3基因的突变案例。
综上,GJB2和SLC26A4基因的纯合致病突变发生率虽然较低,但是一旦发生很大可能引起新生儿的语前聋,且多为感音性耳聋,听力损失程度常为重度甚至极重度。因此在地区/城市级别的大人群耳聋基因筛查中,一旦发现这两个基因的纯合突变,相关医院、检测机构及有关政府部门一定要给予足够重视,建立起完善的转诊干预机制,对这类患儿及时进行干预治疗。另外本研究结果显示,SLC26A4基因上的复合杂合突变相比于纯合突变更高发,也需引起临床及监管机构的重视,不过该类突变的致病表型存在更高的异质性,遗传解读相对复杂,相关筛查及诊断医院应与检测机构保持密切合作,为耳聋基因复合杂合突变儿提供更详尽的后续随访及遗传咨询[18]。
值得注意的是,项目开展期间在我院进行听力学诊断的幼儿中,共有25例确诊听力损失的患儿可同时追溯到听力初筛和耳聋基因检测结果,其中有8例患儿通过了听力初筛。在这8例患儿中有2例中/重度和极重度听力损失患儿在此前的耳聋基因检测中已被发现分别为GJB2基因的复合杂合突变和纯合突变,并以此为指征进行了听力诊断。另外本项目中还发现了3例未做听力筛查但经耳聋基因检测提示为高风险的个体,在最后的听力诊断中被确诊为中度到极重度的听力损失。这些案例充分说明了耳聋基因检测对于新生儿听力筛查的必要性和互补性,在成为一线筛查手段后能发现部分因为各种因素在听力筛查中漏检的先天性耳聋患儿,使其早发现、早干预、早治疗成为可能,对提升人口素质、减少社会负担具有重要意义。
