氧化石墨烯-海藻酸钠-壳聚糖复合支架对颅骨缺损的修复作用
2022-06-07许彤彤李美慧刘志辉张惠利
张 骁 许彤彤 隋 欣 李美慧 刘志辉 张惠利
骨骼是人体中一种具有有限再生能力的组织,当骨缺损面积超过再生临界值时,骨组织就丧失了再生的能力[1]。当外伤、肿瘤或先天性发育畸形等原因造成的骨缺损超过临界骨缺损时,骨骼畸形将伴随患者终生,对患者的身心健康造成极大的损害[2]。作为临床中修复骨缺损的金标准,自体骨移植不仅会造成供骨区出现新的继发骨缺损,还可能出现疼痛感染等并发症[3~5]。通过骨组织工程技术,制备出具有适当机械性能和生物相容性的支架材料,为成骨细胞提供粘附、生长和分化的临时支架,对大面积骨缺损具有较大的修复潜力[6,7]。
海藻酸钠(sodium alginate,SA) 和壳聚糖(chitosan,CS)常被用于制备骨组织工程的支架材料,其中表面带有负电荷的SA 能够与阳离子性质的多糖CS 在水溶液中形成聚电解质复合物[8]。将SA 与CS 简单混合后采用冷冻干燥法就能够制备出孔隙均匀且促进细胞增殖的复合支架[9]。然而CS与SA 的强度不足且降解速度与骨形成不匹配限制了其在组织工程中的应用[10]。
氧化石墨烯(graphene oxide,GO)是骨组织工程中一种新型的纳米材料,其边缘有羟基、羧基和环氧基等大量含氧基团存在[11],这些含氧基团赋予了GO 较好的亲水性[12],同时也提供了大量蛋白质吸附位点[13]。在成骨活跃的区域,这些位点既能够吸附、凝集有利于成骨的相关因子,又能够作为支架为成骨细胞提供粘附位点,有助于其粘附、增殖及分化。
此外GO 能够通过范德华力、静电作用、氢键和π-π 堆积等方式与其他材料紧密结合形成骨组织工程支架,以提高原有支架的理化和生物性能。在成骨分化方面,GO 的表面特性决定了其能够诱导细胞的增殖、迁移和分化[14],在2D 培养中GO 能够促进间充质干细胞向成骨细胞系分化,对干细胞的增殖和分化具有重要的影响[15]。鉴于GO 表现出的优秀性能,本课题组王博蔚[16]等将不同浓度的GO添加进CS 和SA 中制备了GO-SA-CS 复合支架并对其表征和理化性质进行了相关检测,结果显示与SA-CS 支架相比,加入GO 后的复合支架材料其溶胀比、降解速率和机械性能都得到了明显改善,其中含有0.3%(w/v)GO 的GO-SA-CS 复合支架机械性能最佳,细胞存活率最高,生物相容性最好。本实验将进一步检测GO-SA-CS 复合支架的体内成骨性能,为临床修复骨缺损提供重要的理论基础。
材料和方法
1.实验动物、主要试剂和仪器:36 只6 周龄雄性ICR 小鼠由吉林大学实验动物中心提供,实验动物许可证号:SCXK(吉)2016-0001。海藻酸钠(黏度4~12mPa·s,美国Sigma 公司),壳聚糖(脱乙酰度80.0%~95.0%,黏度50~800 mPa·s,国药化学集团化学试剂有限公司),氧化石墨烯(南京先丰纳米材料有限公司),无水氯化钙和冰醋酸(北京化工厂),磷酸盐缓冲液(武汉博士德生物工程有限公司),苏木精-伊红(HE)染色剂(吉林大学口腔医学院免疫组织化学实验室配制),Runx2 抗体(上海艾博威斯生物科技有限公司,CY5395),ColⅠ抗体(美国Proteintech 公司,66761-1-Ig),即用型免疫组化超敏UltraSensitiveTMSP 试剂盒、抗原修复液(胃酶法)和DAB 显色试剂盒(福州迈新生物技术开发有限公司),Hifair ® Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR 和Hieff® qPCR SYBR Green Master Mix(上海翌圣生物科技股份有限公司)。RM2245 石蜡切片机(德国徕卡公司),IX71 倒置荧光显微镜(日本奥林巴斯公司),实时荧光定量PCR仪(美国伯乐公司),ALPHA1-2LD 型冷冻干燥机(德国Marin Christ 公司)。
2.SA-CS 支架和GO-SA-CS 复合支架的制备:称取2 g CS 溶于100ml 0.5mol/L 冰醋酸溶液中,称取2 g SA 溶于100ml 去离子水中,磁力搅拌机搅拌2 h,制备CS 与SA 溶液。取0.1 g GO 粉末置于100 ml 去离子水中,超声震荡分散2 h 制备成GO 分散液。按照m(SA):m(CS)=1:1 将CS 溶液加入SA 溶液中连续搅拌4h,制备SA-CS 凝胶。然后将GO 分散液分次加入SA-CS 凝胶中搅拌24 h 得到含有0.3%(w/v)GO 的GO-SA-CS 凝胶。将SACS 凝胶与GO-SA-CS 凝胶分别注入24 孔板中冷冻干燥,将冷冻干燥后得到的支架置于质量分数2%的氯化钙溶液中交联1 h 后再次冷冻干燥。得到SA-CS 支架及GO-SA-CS 复合支架,使用打孔器制备直径4.5 mm、厚度1 mm 的圆形支架材料,紫外光照射2 h 灭菌,-20℃密封储存备用。
3.实验动物模型的建立及分组:36 只SPF 级健康雄性ICR 小鼠,分笼饲养,自由摄食饮水,每12 h昼夜交替,适应性饲养1 周后随机分为3 组:空白对照组、SA-CS 组与GO-SA-CS 组,每组12 只。本研究动物实验经吉林大学实验动物福利伦理委员会批准(实验伦理福利审查编号:SY202105017)。
小鼠经4%水合氯醛(10 mL·kg-1)腹腔注射麻醉,俯卧位固定于操作台,建立小鼠颅骨缺损模型:常规消毒、铺巾、备皮,无菌操作下沿颅顶正中线作长约1.5~2.0 cm 切口,钝性分离皮下组织,剥离骨膜,充分暴露右侧顶骨,在颅顶正中线右侧使用牙科低速环钻制备直径为4 mm 的全层颅骨缺损。将直径为4.5 mm 的支架分别植入SA-CS 组及GO-SACS 组,见图1,检查植入材料稳固后使用3-0 丝线对位缝合创口,空白对照组不植入材料,直接缝合创口,术后3 d 常规肌肉注射庆大霉素(8 万U·kg-1)。

图1 小鼠颅骨缺损模型(左)及支架植入(右)
4.Micro-CT 扫描检测各组小鼠颅骨缺损修复情况:分别于术后4 w 和8 w 时随机选取每组3 只小鼠心脏灌流处死,分离小鼠颅骨,置于新配制的4%中性多聚甲醛固定液中固定48 h,Micro-CT 扫描观察新生骨组织形成情况,使用Image J 1.52 软件测量骨缺损面积,并分析骨矿物质密度、骨小梁数量、骨小梁厚度和骨小梁分离度变化情况。
5.HE 染色观察各组小鼠颅骨组织形态:固定48 h 后的颅骨样本使用15% EDTA 室温下脱钙至颅骨组织可被细针轻易穿透为止,常规梯度乙醇脱水,石蜡包埋,制备厚度为5 μm 的连续石蜡切片,HE 染色后使用显微镜观察颅骨缺损区域新生骨组织形态。
6.免疫组织化学染色检测各组小鼠颅骨Runx2和ColⅠ蛋白表达:将石蜡切片60℃烤片后经二甲苯脱蜡,梯度乙醇脱水,37℃抗原修复30 min,使用免疫组织化学染色试剂盒进行内源性过氧化物酶活性阻断及血清封闭,一抗Runx2(1:500)和ColⅠ(1:4800)按比例稀释后滴加至组织处4℃过夜孵育,经生物素标记的二抗和链霉菌抗生素-过氧化物酶溶液孵育后DAB 显色,阳性表达信号呈特异性棕黄色。染色结果使用显微摄像系统进行40 倍镜图像采集,使用Image-Pro Plus(version 6.0,media cybernetics)图像分析软件分析Runx2 和ColⅠ蛋白表达的平均光密度值(optical density,OD)。
7.RT-qPCR 检测各组小鼠颅骨Runx2 和ColⅠmRNA 表达水平:分别于术后4 w 和8 w 时每组分别选取3 只小鼠颈椎脱臼处死,分离小鼠颅骨,剥离皮下组织及表面骨膜,迅速投入液氮中冷冻1h 后,剪取以缺损处为中心,5 mm×5 mm 大小的组织块置于研钵中磨碎。使用TRIzol 法提取组织总RNA,NanoDrop 分光光度计测定RNA 浓度,根据Hifair®Ⅲ1st Strand cDNA Synthesis SuperMix for qPCR和Hieff® qPCR SYBR Green Master Mix 说明书进行cDNA 合成及PCR 扩增,通过相对定量2-ΔΔCt法计算目的基因mRNA 表达水平。引物基因序列见表1。

表1 引物序列
8.统计学分析:采用SPSS 23.0 统计软件进行统计学分析。数据以±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t法。以P<0.05 为差异有统计学意义。
结 果
1.复合支架的形貌特征:室温下,支架材料呈现柱状海绵样结构,其形状具备一定的可塑性,可随冷冻干燥模具的形状而改变,结构柔软具备一定的可压缩性。其中SA-CS 支架呈白色,而0.3%(w/v)GOSA-CS 复合支架呈现浅棕色,见图2。

图2 SA-CS 支架(左)与GO-SA-CS 复合支架(右)形貌
2.各组小鼠颅骨缺损面积:术后取材见部分未降解材料覆盖缺损区域,未发生剥离与移位。Micro-CT 三维重建结果显示:术后4 w 和8 w,空白对照组小鼠仅可见少量新生骨组织,SA-CS 组及GO-SACS 组均可见明显新生骨组织,其中点状新生骨组织见于缺损中央,边缘成骨最为活跃。GO-SA-CS 组新生骨组织明显多于SA-CS 组,见图3。Image J 计算骨缺损面积结果显示:随着时间延长各组小鼠颅骨缺损面积逐渐减小,GO-SA-CS 组骨缺损面积明显小于空白对照组及SA-CS 组(P<0.05),见表2。
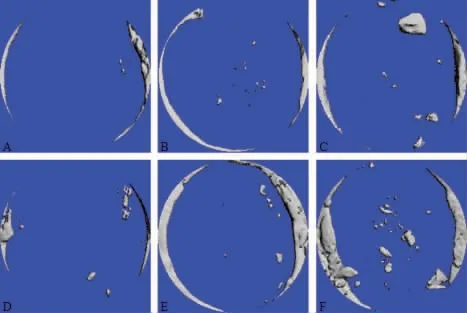
图3 Micro-CT 扫描各组小鼠颅骨缺损部位三维重建图像
表2 各组小鼠颅骨缺损面积(n=3,±s,S/mm2)

表2 各组小鼠颅骨缺损面积(n=3,±s,S/mm2)
*与空白对照组比较P<0.05;#与SA-CS 组比较P<0.05
Group Area of bone defect 4 weeks 8 weeks Blank control SA-CS GO-SA-CS 9.638±0.191 8.907±0.094*7.708±0.252*#9.039±0.016 8.583±0.103*7.189±0.127*#
3.各组小鼠骨矿物质密度、骨小梁数量、骨小梁厚度和骨小梁分离度:Micro-CT 检测结果显示:4 w时,与空白对照组及SA-CS 组相比,GO-SA-CS 组骨矿物质密度升高(P<0.05),与空白对照组相比骨小梁厚度升高(P<0.05),骨小梁分离度降低(P<0.05);8 w 时,与空白对照组及SA-CS 组相比,GOSA-CS 组骨小梁厚度升高(P<0.05),见图4。

图4 各组小鼠骨矿物质密度(A)、骨小梁数量(B)、骨小梁厚度(C)和骨小梁分离度(D)
4.各组小鼠骨组织形态表现:HE 染色结果显示:4 w 和8 w 时,空白对照组骨缺损部位仅以薄层疏松网状纤维组织充填,SA-CS 组和GO-SA-CS 组均可见支架材料残留,且GO-SA-CS 组中未降解支架材料较SA-CS 组少,残留支架的内部有大量成骨细胞长入,并可见新生血管形成,见图5 和图6。

图5 各组小鼠骨组织形态表现(HE ×4,比例尺500μm 如图所示)

图6 各组小鼠骨组织形态表现(HE ×40,比例尺50μm 如图所示)
5.各组小鼠新生骨组织Runx2 mRNA 和蛋白表达水平:RT-qPCR 结果显示:术后4 w 时,与空白对照组相比,SA-CS 组及GO-SA-CS 组Runx2 mRNA 表达明显升高(P<0.05),且GO-SA-CS 组Runx2 mRNA 表达显著高于SA-CS 组(P<0.05);术后8 w 时,与空白对照组及SA-CS 组相比,GOSA-CS 组Runx2 mRNA 表达明显升高(P<0.05),见图7。免疫组化染色结果显示:Runx2 蛋白阳性表达呈棕黄色,术后4 w 时,与空白对照组相比,SACS 组及GO-SA-CS 组Runx2 阳性蛋白表达水平明显升高(P<0.05);术后8 w 时,与空白对照组相比,SA-CS 组及GO-SA-CS 组Runx2 蛋白表达水平明显升高(P<0.05),且GO-SA-CS 组Runx2 蛋白表达水平显著高于SA-CS 组(P<0.05);见图8 和表3。

图7 各组小鼠Runx2 mRNA 表达水平

图8 各组小鼠Runx2 蛋白表达情况(免疫组织化学 ×40,比例尺50μm 如图所示)
表3 各组小鼠Runx2 蛋白表达水平(n=3,±s)

表3 各组小鼠Runx2 蛋白表达水平(n=3,±s)
*与空白对照组比较P<0.05;#与SA-CS 组比较P<0.05
Group Expression level of Runx2 4 weeks 8 weeks Blank control SA-CS GO-SA-CS 0.090±0.043 0.172±0.001*0.269±0.018*#0.179±0.008 0.229±0.022*0.304±0.004*#
6.各组小鼠新生骨组织ColⅠmRNA 和蛋白表达水平:RT-qPCR 结果显示:术后4 w 时,与空白对照组及SA-CS 组相比,GO-SA-CS 组ColⅠmRNA表达明显升高(P<0.05);术后8 w 时,与空白对照组相比,SA-CS 组及GO-SA-CS 组ColⅠmRNA 表达明显升高(P<0.05),且GO-SA-CS 组ColⅠmRNA 表达显著高于SA-CS 组(P<0.05),见图9。免疫组化染色结果显示:ColⅠ蛋白阳性表达呈特异性棕黄色,术后4 w 和8 w,与空白对照组相比,SACS 组及GO-SA-CS 组ColⅠ阳性蛋白表达水平明显升高(P<0.05),且GO-SA-CS 组ColⅠ蛋白表达水平显著高于SA-CS 组(P<0.05);见图10 和表4。

图9 各组小鼠ColⅠmRNA 表达水平

图10 各组小鼠ColⅠ蛋白表达情况(免疫组织化学 ×40,比例尺50μm 如图所示)
表4 各组小鼠ColⅠ蛋白表达水平(n=3,±s)

表4 各组小鼠ColⅠ蛋白表达水平(n=3,±s)
*与空白对照组比较P<0.05;#与SA-CS 组比较P<0.05
Group Expression level of Col I 4 weeks 8 weeks Blank control SA-CS GO-SA-CS 0.064±0.005 0.087±0.003*0.131±0.007*#0.082±0.006 0.116±0.006*0.168±0.012*#
讨 论
支架材料、种子细胞和生长因子是组织工程中重要的三要素。其中制造生物相容性良好、可降解与可吸收的支架是现今研究的热点内容。在现阶段的研究中,应用于修复骨缺损的材料包括生物相容性良好的金属材料[17]、生物陶瓷[18]、天然或人工合成的聚合物[19]等,但这些材料作用常倾向于传导骨应力或与天然骨形成牢固结合[20],并不具备诱导骨再生的作用。
研究表明[20],GO 能够通过π-π 堆积、氢键或静电作用加速骨髓间充质干细胞的成骨分化。Qi[21]等利用GO 优秀的机械性能与甲基丙烯酰化丝胶(sericin methacryloyl,SerMA)制备了SMH/GO 水凝胶,12 w 时,SMH/GO 水凝胶能够通过介导骨髓间充质干细胞的迁移和成骨分化显著促进实验组大鼠颅骨缺损的修复再生。Zhang[22]等将GO 作为生物墨水,使用3D 打印方法制备了GO/藻酸盐/明胶(gelatin,Gn)复合支架,该支架具有优秀的机械性能,能够通过上调ALP 等成骨基因的表达,促进成骨细胞的分化。
Lee[20]等使用GO 作为蛋白的预富集平台同样加速了山羊间充质干细胞的生长和分化。利用这一特点,S.Saravanan[23]等将GO 加入CS 和Gn 中,制备了GO-CS-Gn 复合支架,研究结果显示在CS-Gn中添加0.25%(w/v)的GO 能够增强支架的蛋白吸附能力和生物矿化能力,并促进Runx2 等成骨相关基因的上调,在体内能够促进大鼠胫骨缺损的愈合。以上研究均证实添加较低浓度的GO 能够对支架的性能有较大改善。
本课题组的前期研究[16]使用冷冻干燥技术成功制备了SA-CS 支架及含有不同质量分数GO 的GO-SA-CS 复合支架,结果表明单纯SA-CS 支架弹性模量低,溶胀比高,而低浓度GO 的加入使得GOSA-CS 复合支架孔壁厚度增加,机械强度明显增强,溶胀比降低,降解速率也更匹配新骨形成速率,且含0.3%(w/v)GO 的GO-SA-CS 复合支架具有良好的亲水性,可持续向小鼠前成骨细胞输送营养物质用于细胞生长,促进细胞增殖,对于修复骨缺损具有潜在的价值。
本研究通过建立小鼠颅骨缺损模型,于术后4 w及8 w 进行影像学及组织学检测,探究GO 质量分数为0.3%的GO-SA-CS 复合支架的体内骨修复效果。Micro-CT 扫描结果显示,在各组中不同时间节点上,颅骨缺损的范围内可见不同程度散在的新生骨质,空白对照组仅有少量点状新骨形成,GO-SACS 复合支架组则可于骨缺损边缘及中心处见不规则块状新骨形成,且其骨矿物质密度、骨小梁厚度和骨小梁分离度等骨代谢相关指标均优于空白对照组及SA-CS 组,这说明GO-SA-CS 复合支架具备一定的诱导骨再生作用,可为新骨的形成提供支架,在一定程度上能够修复颅骨缺损。
研究表明在水溶液中,GO 通过化学键断裂自我降解为良性产物腐殖酸[24],而在生物体内,GO 则在过氧化物酶的作用下进行酶促降解[25]。在时间尺度上,相关研究表明GO 在体内完全降解清除可能会持续数月[26]。本研究中在4 w 与8 w 的小鼠颅骨HE 染色切片中均可观察到GO-SA-CS 复合支架在逐步断裂崩解,与空白对照组缺损区域仅有数层细胞相比,在崩解的支架间有大量的组织替代支架结构,这些组织能够为缺损区域的骨再生提供足够的空间支持与物质保障。
在组织工程中,血管能够提供骨缺损修复所必须的营养物质、生长因子、矿物质和氧气,并在缺损内部及周围塑造出便于成骨的微环境[27]。HE 染色组织学观察结果显示,在植入GO-SA-CS 复合支架的小鼠颅骨缺损处可见大部分支架材料已降解,支架材料孔隙内部有大量成骨细胞长入,并可见新生血管生成。目前的研究尚无充足的证据能够证明GO与成骨过程中血管化的关系,血管的长入或与GOSA-CS 复合支架适宜的孔隙率或复合支架的降解相关。
为探讨GO-SA-CS 复合支架促进骨缺损修复的可能机制,本研究进一步检测了小鼠颅骨组织中Runx2 和ColⅠmRNA 及蛋白的表达情况。Runx2 是一种成骨分化特异性转录因子,属于Runx 家族成员,可诱导间充质干细胞分化为成骨细胞,早期研究表明[28],Runx2 缺失可导致小鼠膜内成骨及软骨内成骨中断。成骨细胞分化早期主要依赖Runx2 调控,且Runx2 直接调控Ⅰ型胶原、骨桥蛋白和骨钙素等骨基质蛋白的形成[29]。在前成骨细胞中Runx2表达较高,尤其在未成熟的成骨细胞中达到最高水平,在成骨细胞成熟过程中表达下调[30]。本研究中RT-qPCR 及免疫组化染色结果显示GO-SA-CS 复合支架植入后提高了颅骨缺损部位Runx2 mRNA和蛋白的表达水平,提示颅骨缺损处的新骨形成尚处于早期阶段。Runx2 在支架周围的细胞及间质中表达较高,这种现象或与GO-SA-CS 丰富的含氧官能团相关[16],研究表明羟基、羧基和环氧基等均能够提供蛋白吸附位点[13],在成骨活跃的区域GO 能够成为Runx2 等成骨相关蛋白的预浓缩平台,而局部成骨相关蛋白浓度的提高对于成骨也较为有利。Ⅰ型胶原约占骨基质成分的90%,主要作用是与其他蛋白质结合形成网状基质结构,为羟基磷灰石沉积提供附着点[31]。本研究中RT-qPCR 及免疫组化染色结果显示,4 w 和8 w 时GO-SA-CS 组ColⅠmRNA和蛋白的表达水平均明显高于空白对照组及SACS 组(P<0.05),且8 w 时差异尤为显著,这说明GO-SA-CS 复合支架可通过上调Ⅰ型胶原表达水平促进骨缺损修复中羟基磷灰石的沉积。
本研究使用冷冻干燥技术将GO 掺入SA-CS形成GO-SA-CS 复合支架,并将其植入小鼠颅骨临界骨缺损处,证实GO-SA-CS 复合支架能够在一定程度上促进颅骨缺损的修复,初步阐明GO-SA-CS复合支架可能通过上调Runx2 和ColⅠmRNA 与蛋白的表达水平发挥诱导骨再生作用,但其具体机制尚待深入研究。本研究为GO-SA-CS 复合支架的应用奠定了实验基础,本课题组将在后续实验中使用GO-SA-CS 复合支架构建缓释载药系统,以期对修复骨缺损产生更加积极的影响。
