载瘦素及血管内皮生长因子微球复合水凝胶的制备及表征研究
2022-06-07李凌锋翟建佳王碧舟刘志辉
李凌锋 翟建佳 王碧舟 刘志辉
难愈性皮肤创伤一直是临床创面治疗中的重点问题[1,2]。常规创面愈合主要包括了以下几个步骤:止血期,炎症反应期,肉芽组织形成期,基质重塑期[3]。而其中某一阶段或几个阶段受到影响均会导致创面形成难愈性创口。根据Winter 在1962 年提出的湿性愈合理论,保持创面湿润及良好的水合状态有利于创面愈合[4]。瘦素(leptin,LP)是一种由脂肪组织分泌的生物因子,具有诱导巨噬细胞聚集、分化、增殖的作用,同时可诱导血管内皮细胞分泌血管内皮生长因子,促进创面周围血管组织的形成,是一种已经被证实的具有促进创面愈合作用的生物因子[5~11]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种强效血管生长促进因子,它通过影响血管内皮细胞的迁移、增殖和分化而发挥作用,具有强大的促进创面愈合的作用[12~14],本研究将LP 与VEGF 通过乳化交联法制成海藻酸钠(sodium alginate,SA)微球,负载于具有温敏性质的普朗尼克(Pluronic,P)复合水凝胶中,制备了一种LP/VEGF-SA-P 水凝胶。表征了其微观形态,检测其相变温度、相变时间,并与L929 细胞体外共培养检测其生物相容性,探讨了在LP/VEGF-SA-P 中不同质量分数的普朗尼克对其理化性能和生物性能产生的影响。
资料和方法
1.试剂与仪器
海藻酸钠(10~20cp)购自辽宁新兴试剂有限公司;无水氯化钙(分析纯)购自美国Sigma 公司;液体石蜡(分析纯)购自天津新通精细化工有限公司;柠檬酸钠(分析纯)、吐温80(分析纯)、span 80(分析纯)购自天津市大茂化学试剂厂;无水乙醇购自北京化工厂;LP(生物纯)购自上海阿拉丁生化科技股份有限公司;LP-ELISA 试剂盒购自美国Protein Tech公司;VEGF(生物纯)及ELISA 试剂盒购自美国PeproTech 公司;普朗尼克F68 及F127(生物纯)购自上海源叶生物;L929 细胞系购自我校口腔实验中心;H-DMEM 培养基、胎牛血清、胰蛋白酶购自Gibco 公司;CCK-8 试剂盒购自Biosharp 公司。
恒温磁力搅拌器购自上海尚仪公司;GR60DA型高压蒸汽灭菌锅购自美国Zealway 公司;ALPHA1-2LD 型冷冻干燥机购自德国Marin Christ公司;扫描电子显微镜购自荷兰Phenom 公司(SEM,束流:20 μA,电子加速电压:5.0 kV,放大倍数:100 倍和200 倍);Infinite 200 pro 型酶标仪购自瑞士Tecan 公司(波长为450 nm);超速冷冻离心机购自美国Beckman 公司;MCR702 型旋转流变仪购自奥地利Anton Paar 公司(板间距离1 mm,测试频率1 HZ,应变1%);电热恒温水浴锅购自群安仪器;900 型智能辐照仪购自北京金信诚公司。
2.材料制备
(1)不同浓度普朗尼克水凝胶的制备:将P F127粉末充分溶解于生理盐水中,制备质量分数为10%、12%、14%、16%的P F127 溶液,将P F68 粉末充分溶解于生理盐水中,制备质量分数为2%、4%、6%、8%的P F68 溶液,分别将不同浓度的P F127溶液与质量分数为2%、4%、6%、8%的P F68 溶液按照质量比1:1 充分混匀,制备P F127-P F68 混合溶液;将上述溶液分装于EP 管内并置于水浴锅中,从10℃开始升温直到将EP 管倒置后的1 min 内溶液不发生流动,此时形成普朗尼克水凝胶。
(2)微球复合水凝胶的制备:配制1%(w/v)SA溶液20 ml,配制饱和CaCl2溶液20 ml,向高压灭菌后的SA 中加入25 μg 的LP,充分混匀后逐滴加入到含有5mL Span 80 的80 ml 液体石蜡中,于800 r/min 转速下搅拌10 min 后逐滴加入10 mL Tween80 溶液,继续800 r/min 搅拌5 min;将高压灭菌后的CaCl2溶液逐滴加入到反应体系中,交联形成微球,800 r/min 搅拌10 min 后使用低温超速离心机50000 r/min 离心分离微球,分别用15 mL无水乙醇和去离子水冲洗3 次,将产物冻干后得到载有LP 的微球,同理制得载有VEGF 的微球及空白微球。称取微球各0.1 g,分别加入到10 g 混合水凝胶中,涡旋仪充分混匀,制得载药微球复合水凝胶。
3.性能表征
(1)微球及载药微球水凝胶形貌分析:将3 mL前文制得的复合水凝胶装于西林瓶中,分别于30℃及10℃下拍摄照片; 将微球和冻干后的微球复合水凝胶样品固定、喷金,SEM 下观察微观形态及结构,利用Image J 软件测量统计微球粒径分布。
(2)微球中LP 及VEGF 包封率及载药率的测定:称取冻干后的载药微球m1(g),溶于浓度为0.03 g/ml 的柠檬酸钠溶液中并充分震荡混匀,静置48 h后取上清液。使用ELISA 试剂盒,酶标仪以450 nm测量标准品孔及样品孔OD 值并绘制标准曲线,建立回归方程。根据回归方程计算出单位质量微球中所含药物质量mt(g)。投入药物质量记为m0(g),根据下列公式计算微球中药物的载药率[Drug loading rate,%] 和包封率[Entrapment rate,%]:


(3)微球中LP 及VEGF 的体外累积释放分析:称取冻干后的LP 和VEGF 微球各m2(g),充分分散于溶胶态水凝胶中,置于37℃恒温培养箱中转变为凝胶态后孵育,分别于第0.5 d、2.0 d、4.0 d、6.0 d、8.0 d、10.0 d、12.0 d、14.0 d、16.0 d 降温后转变为溶胶态进行离心,取1 ml 上清液待测,同时重新加入等量溶胶态水凝胶并充分混合继续孵育。使用ELISA 试剂盒,酶标仪测定各样品的OD 值,根据回归方程计算各个时点的累计药物释放量m3,计算药物累计释放率[Cumulative drug release rate,%]并绘制释放率-时间曲线。
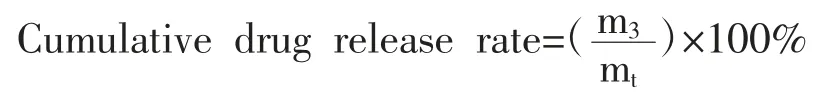
(4)水凝胶相变时间和相变温度的检测:取制备好的不同浓度普朗尼克水凝胶及微球复合水凝胶各1 mL,旋转流变仪设定为恒温20℃,等待达到预设温度(315 s)时,将样品置于测试盘上,测定不同时间点下储能模量(G')和损耗模量(G'')的变化趋势,G'与G''曲线的交点即为水凝胶的相变时间。
取1 mL 样品置于测试盘上,设定温度范围为5~65 ℃,升温速率为1 ℃/min,测定不同温度下储能模量(G')和损耗模量(G'')的关系,G'与G''曲线的交点即为水凝胶的相变温度。
4.细胞相容性评价
(1)细胞培养:使用含10% FBS 和1%双抗的H-DMEM 培养基,于培养箱(37℃,5% CO2)中培养小鼠成纤维细胞L929 细胞系(细胞由吉林大学口腔医学院实验中心提供)。
(2)细胞毒性检测:将充分灭菌后的凝胶态LP/VEGF-SA-P 水凝胶放于50 ml 离心管中,加入空白培养基,水凝胶所占体积分别为20%、40%、60%和80%,37℃下孵育48h 后收集离心管中液体。将L929 细胞按2000 cell/孔接种于96 孔细胞培养板中,实验组加入4 种LP/VEGF-SA-P 水凝胶浸提液,空白对照组加入含有10% FBS 的H-DMEM 培养基,每组设置5 复孔,每孔加入200 μL 培养基。孵育48 h 后吸出培养基,每孔加入100 μL CCK-8溶液,继续孵育24 h。酶标仪测定450 nm 处各孔OD 值,通过计算实验组与对照组的相对生长速率[Relative growth rate(RGR),%]评价材料的细胞毒性,计算方法如下:

(3)细胞迁移能力检测:按2 方法制备水凝胶体积比为50%的LP/VEGF-SA-P 水凝胶浸提液,在6孔细胞培养板背面做3 条间距1 cm 的辅助线,将L929 细胞接种于6 孔细胞培养板中培养,待细胞铺满孔板底壁,吸弃孔中原培养基,实验组中加入2 mL LP/VEGF-SA-P 水凝胶培养基浸提液,对照组加入2 mL 含有10% FBS 的H-DMEM 培养基,每组设置2 复孔。每孔用200 μL 枪头沿辅助线划一条宽约500 μm 的划痕线,于划痕后0、48、96 h 于倒置显微镜下观察并拍照,应用Image J 软件进行图像处理及分析,计算划痕愈合速率并进行统计学分析。
5.统计学分析
所有操作进行三次独立重复试验,所得实验数据采用IBM SPSS 17.0 软件进行统计学分析,P<0.05 表示差异有统计学意义。使用GraphPad Prism 7、Microsoft Excel 2017、Image J 软件进行图像处理和图表绘制。
结 果
1.微球复合水凝胶的形貌
(1)微球形貌及粒径分析:图1 为微球的SEM照片,图1(A)可以看出微球呈规则的球体,形态饱满,由图1(B)可以看出,微球大小均匀,无粘连现象。图2 为经Image J 图像分析后得出的微球粒径分布图,可以看出,微球粒径符合正态分布,90%以上集中于200~700 nm 间,平均粒径为450 nm。

图1 单个(A)和多个微球(B)的SEM 图像

图2 微球的粒径分布
(2)微球复合水凝胶的形貌表征:图3 示出了载药微球水凝胶宏观形态及SEM 照片。由图3(A、B)可见,相变前为具有一定的流动性的溶胶态,相变后为凝胶态。由图3(C~E)可见,水凝胶微观结构内具有高度的连通性,呈三维网络状,孔径大小不一,约为50~200 μm;水凝胶三维网状的结构有助于载药微球的嵌入,大量微球均匀分布于水凝胶孔隙间;如图3(E)所示,在断层中还可以看到微球进入水凝胶片层状结构内,说明微球在水凝胶内分散情况良好。

图3 载药微球水凝胶相变前(A)和相变后(B)的照片和SEM 图像(C-E)
2.相变时间
(1)不同浓度P F127-P F68 复合水凝胶的相变时间:图4 显示了不同浓度P F127-P F68 复合水凝胶在20℃下不同时间点的储能模量(G')和损耗模量(G'')。图4(A)显示,当10% P F127 与P F68 复合后,均保持溶胶态,图4(B)显示,当12% P F127 与P F68 复合后,(d)组立即转变为凝胶态,其余均保持溶胶态;图4(C)显示,当14% P F127 与P F68 复合后,(a)组保持溶胶态,(b)组在68 s 时转变为凝胶态,(c)(d)组立即转变为凝胶态;图4(D)显示,当16% P F127 与P F68 复合后,(a)组在9 s时转变为凝胶态,其余三组立即转变为凝胶态。

图4 含10%(A)、12%(B)、14%(C)、16%(D)F127 和2%(a)、4%(b)、6%(c)、8%(d)F68 的复合水凝胶在20℃下的相变时间
(2)微球复合水凝胶的相变时间:图5 显示,加入载药微球后,16% P F127- 2% P F68 组水凝胶的相变时间缩短为8 s。这可能是由于载药微球加入后吸水,导致普朗尼克相对浓度升高,中央疏水基团作用增强,从而减少相变时间。

图5 含LP 和VEGF 微球的复合水凝胶在20℃下的相变时间
3.相变温度
(1)不同浓度P F127-P F68 复合水凝胶的相变温度:图6 显示了不同浓度P F127-P F68 复合水凝胶在不同温度下的储能模量(G')和损耗模量(G'')。图6(A)显示了当10% P F127 分别与2%、4%、6%和8% P F68 复合后,相变温度分别为42.1℃、29.1℃、23.6℃、21.1℃;图6(B)显示了当12% P F127 分别与2%、4%、6%和8% P F68 复合后,相变温度分别为29.0℃、24.6℃、21.1℃、19.1℃;图6(C)显示了当14% P F127 分别与2%、4%、6%和8% P F68 复合后,相变温度分别为24.0℃、22.1℃、20.1℃、17.1℃;图6(D)显示了当16%P F127 分别与2%、4%、6%和8% P F68 复合后,相变温度分别为21.5℃、18.8℃、16.4℃、14.6℃。

图6 含10%F127(A)、12% F127(B)、14% F127(C)、16% F127(D)和不同浓度F68 的复合水凝胶的相变温度
(2)微球复合水凝胶的相变温度:如图7 所示,加入载药微球后,16% P F127-2% P F68 组水凝胶的相变温度降低为21.2℃。这可能是由于载药微球加入后吸水,导致普朗尼克相对浓度升高,中央疏水基团作用增强,从而降低相变温度。

图7 负载LP 和VEGF 微球的复合水凝胶的相变温度
4.微球的包封率和载药率
图8 显示了LP 及VEGF 的标准曲线。LP 的标准曲线拟合方程为(其中A=2.54,B=1.70,C=15.35,D=0.08);VEGF 的标准曲线拟合方程为(其中A=0.79,B=-1.26,C=1072.46,D=0.07)。经计算得出LP 与VEGF 包封率分别为48.01%和49.58%;LP 和VEGF 的载药率分别为1.8×10-4%和1.47×10-4%。

图8 LP(A)和VEGF(B)的标准曲线
5.微球中LP 及VEGF 的体外释放情况
图9 显示了LP 及VEGF 累积释放情况,两种药物均在0~0.5 d 阶段出现释放高峰,在后续过程中表现出平稳释放,第16 d 累积释放量分别接近83.01%和81.98%,接近完全释放。

图9 LP(A)和VEGF(B)的累积释放曲线
6.细胞毒性检测结果
检测不同浓度的LP/VEGF-SA-P 水凝胶浸提液处理的L929 细胞在24 h 时的CCK-8 值,并计算每个分组的细胞相对生长速率(RGR),图10 显示,随着水凝胶占比的不断增加,L929 细胞的相对生长速率逐渐增加,在水凝胶占浸提液体积40%、60%、80%时,L929 细胞相对生长速率明显高于对照组并具有统计学意义(P<0.05),证明LP/VEGF-SA-P 水凝胶具有促进细胞增殖的作用;表1 显示了根据GB/T 16886.12-2005 评价标准,通过测定各组细胞相对生长速率得出的细胞毒性结果,不同浓度的水凝胶细胞毒性等级均为0 级,证明其不具有细胞毒性,有良好的生物相容性。

图10 L929 细胞相对生长速率

表1 L929 载药微球水凝胶的细胞毒性
7.细胞迁移能力检测结果
检测载LP/VEGF 缓释微球水凝胶对L929 细胞迁移能力影响。图11 显示了在实验组与空白对照组中,96 h 的愈合率均高于48 h 的愈合率(P<0.05),同时实验组在48 h 与96 h 均表现出了更高的愈合率(P<0.05),提示载药微球水凝胶浸提液具有良好的促进L929 细胞迁移的作用。

图11 载LP/VEGF 缓释微球水凝胶对L929 细胞迁移能力影响
讨 论
在应用于促进创面愈合的水凝胶敷料中,药物应具有良好的缓释性能,避免突释现象,同时,良好的缓释速率有助于维持创面愈合过程中创面局部组织的药物浓度。以本实验采用的VEGF 为例,如果突释现象明显,则会造成局部药物浓度过高,于创伤原位生成血管瘤[15,16]。载体的性质以及药物的包封形式共同决定了微球中药物的释放速率,包封形式主要包括微胶囊和微基质两种[17~19],本实验中包封形式为微基质,药物释放形式主要包括了微球裂解和药物本身梯度扩散。当载药微球处于水凝胶中,包载的药物首先通过微球的吸水、溶胀和溶蚀发生扩散,同时表面附着药物迅速扩散,使得药物在0~0.5 d 阶段出现释放高峰,随后Ca2+与水凝胶基质中的Na+发生置换,加速了交联结构中分子链断裂从而引发溶胀,最终导致微球的降解[20~22],随后药物主要通过微孔结构与水凝胶基质发生梯度扩散,直到在第16 d 释放接近完全,达到预期的缓释要求。
本文制备的载药微球水凝胶具有良好的相变时间及相变温度,在21.5℃下发生相变,相变时间为9s。良好的相变时间及相变温度有利于水凝胶的临床实际应用,在使用前,可将微球与水凝胶基质区分储存,从而避免了在储存过程中发生的药物缓释及降解。可控的相变温度及相变时间则保证了应用时水凝胶形态及范围的可控。可以发现,当P F127 质量分数固定时,随着P F68 质量分数增加,相变温度随之降低,这是由于普朗尼克分子总量增加引起的升温时核心疏水基团作用增强,从而导致相变温度降低[23]。同时相同质量分数的普朗尼克水凝胶相变温度基本相同,如当总质量分数为16%时,水凝胶相变温度基本维持在24.0℃左右,这主要是因为接近的分子总量使分子中核心疏水基团数量基本相同,从而带来相近的相变温度。依据《室内空气质量标准》,室内平均温度约为22.5℃,而非运动状态下裸露的体表温度约为33℃,故普朗尼克水凝胶敷料应从4℃储存状态下取出至室温后保持一定时间的溶胶态,以便微球在水凝胶中充分均匀的分散,为临床操作提供时间;同时接触皮肤后适宜的相变时间可以避免水凝胶在创面发生不必要的扩散,将其控制在10s 内可以有效避免这一问题。根据对相变时间及相变温度的筛选,选择了16% P F127-2% P F68 时形成的水凝胶进行后续研究。
结论:采用乳化交联法制备了载有LP 及VEGF的海藻酸钠缓释微球,将微球与普朗尼克水凝胶共混成功制备载药微球复合水凝胶。合成的水凝胶具有良好的相变温度、相变时间及缓释性能,同时具有良好的生物相容性,有望应用于临床难愈创面的促愈研究。
