CACNA2D3在顺铂诱导HEI-OC1细胞凋亡中的作用及机制研究*
2022-05-24田雨鑫李壮壮王菁菁冯艳梅陈正侬
田雨鑫 李壮壮 王菁菁 冯艳梅 陈正侬
顺铂(cisplatin)广泛应用于癌症的治疗,但其耳毒性副作用的平均发生率超过60%,限制了其临床应用[1]。顺铂导致的耳毒性呈永久性、进行性,主要损害耳蜗Corti器的毛细胞造成听力损失[2],极大降低了患者的生活质量[3]。顺铂致听力损失的主要机制是活性氧的积累[4, 5],此外,细胞凋亡、线粒体功能障碍、自噬、炎症和内质网应激等均参与了此过程[2],但顺铂致耳毒性的机制错综复杂,至今尚未完全了解。α2δ属于电压门控钙通道调节亚基家族,由CACNA2D1-4基因编码,CACNA2D3作为调节亚基可增加细胞内Ca2+浓度,促进癌细胞凋亡[6],Ca2+在细胞损伤或应激时可激活细胞凋亡和自噬[7]。然而,CACNA2D3在顺铂诱导产生的细胞凋亡和自噬过程中的作用尚不明确,本研究拟借助短发夹RNA(short hairpin RNA,shRNA)技术敲减毛细胞系(House Ear Institute-Organ of Corti 1 cells, HEI-OC1)细胞中CACNA2D3的表达,从而探讨CACNA2D3在顺铂耳毒性损伤中的作用。
1 材料与方法
1.1耳蜗毛细胞系(House Ear Institute-Organ of Corti 1 cells, HEI-OC1)细胞培养 HEI-OC1来自美国加利福尼亚大学洛杉矶分校,在含10%胎牛血清(Gibco,美国)且不含任何抗生素的高糖DMEM培养基(生工,中国)中培养(培养条件:10%二氧化碳、33 ℃)。
1.2shRNA转染 上海佐润生物技术公司合成了小鼠shRNA-CACNA2D3质粒,序列正义链:CCGGGCACCCATTGAAATCAGGTATCTCGAGATACCTGATTTCAATGGGTGCTTTTTG,反义链:AATTCAAAAAGCACCCATTGAAATCAGGTATCTCGAGATACCTGATTTCAATGGGTGC。100 μl Opti-MEM加2 μl LipofectamineTM2 000,混匀5分钟加入100 μl Opti-MEM与 2 ug质粒(1 ug PLKO.1质粒+ 0.75 psPAX2 +0.25 ug pMD2.G)的混合液中,混匀25分钟后加入密度约60%的293T细胞培养皿,进行24 h培养获取病毒上清;HEI-OC1细胞密度长至约30%时,将收集好的病毒上清和新鲜培养基按1∶1的比例加至细胞培养体系中进行转染,而后利用嘌呤霉素(1∶2 000)进行细胞筛选。
1.3实验分组 分为四组:①sh-Vector(转染阴性对照)+正常培养组;②sh-Cac3(转染shRNA-CACNA2D3)+正常培养组;③sh-Vector +顺铂干预组;④sh-Cac3 +顺铂干预组。所有实验组细胞均进行24 h预培养,而后正常培养组更换为新鲜培养基继续培养24 h,顺铂干预组更换为含20 μM顺铂(Sigma,美国)的培养基处理24 h。
1.4细胞活力检测 利用CCK8试剂盒(MCE,中国)检测细胞活力。将HEI-OC1细胞以2 000个/孔的密度接种于96孔培养板,在细胞培养箱进行24小时预培养。用含0、5、10、20、30 μM顺铂的新鲜培养基进行顺铂干预处理,分别继续培养12、24、48 h;造模结束后,吸干原有培养基,快速加入110 μl/孔CCK8稀释溶液(新鲜培养基:CCK8试剂=10∶1),培养箱避光孵育1小时,用酶标仪测定450 nm处的吸光度(OD)值。
1.5流式细胞术检测各组HEI-OCT细胞凋亡 利用JC-1试剂盒(碧云天,中国)检测线粒体膜电位(mitochondrial membrane potential, MMP),AnnexinV-FITC/PI试剂盒(BD,美国)检测细胞凋亡,Fluo-3AM(碧云天,中国)检测细胞内钙离子浓度。四组细胞造模结束后,弃去细胞原有培养液,用预冷4℃ PBS溶液轻柔洗涤一遍,加入1 ml 0.25%胰蛋白酶消化液(Gibco,美国)消化收集细胞。参照说明书进行荧光探针装载,流式细胞仪检测各组细胞凋亡。
1.6Tunel染色 使用Tunel试剂盒(Roche,美国)进行染色。培养皿中滴入细胞培养基,放置细胞爬片使其吸附于板底,加入细胞悬液进行孵育,获取细胞爬片后,固定液15~25 ℃孵育1小时,PBS洗涤一次后封闭液孵育10分钟,再次PBS洗涤;而后置于冰上破膜液孵育2分钟,PBS洗涤2次,擦干样品周围水分,每个样品加入50 μl Tunel反应混合液(45 μl TUNEL Label solution + 5 μl TUNEL Enzyme solution),避光湿盒中37 ℃孵育1 h;最后PBS洗涤三次,DAPI进行染色封片,共聚焦激光扫描显微镜观察各组细胞Tunel染色阳性率。所有工作液配制严格遵照说明书。
1.7Western blot检测 RIPA裂解液(碧云天,中国)以100∶1混合蛋白酶抑制剂,进行细胞蛋白提取,用BCA试剂盒(雅酶,中国)进行蛋白定量。蛋白变性后,每孔加入等量等体积样品(>30 μg)进行蛋白电泳,NC膜转膜后5%脱脂奶粉室温封闭1 h;对应一抗4℃孵育过夜(anti-CACNA2D3 10 mg/ml, Novus Biological, 美国; anti-Bcl2 1∶1 000, Abclonal,中国; anti-Cleaved PARP1 1∶1 000, Abclonal, 中国; anti-ACTB 1∶50 000, Abclonal, 中国; anti-LC3Ⅱ 1∶2 000, abcam, 美国),辣根过氧化酶标记的二抗室温孵育1 h(HRP Goat Anti-Rabbit/Mouse IgG (H+L) antibody 1∶5 000, Abclonal, 中国)。 凝胶自动成像仪曝光处理,Imgae软件进行灰度分析。
1.8统计学方法 所有实验至少重复三次。采用GraphPad Prism 8.2和SPSS 25.0进行统计分析。所有数据均以均数±标准误差(SEMs)表示。
2 结果
2.1顺铂干预后HEI-OC1细胞CACNA2D3蛋白表达水平降低 由图1可见细胞活力下降与顺铂作用浓度和时间呈依赖性,20 μM顺铂处理24 h引起的HEI-OC1细胞损伤程度适中,细胞存活率为48%±0.88%,后续实验均采用此干预条件。20 μM顺铂干预24 h,HEI-OC1细胞CACNA2D3的蛋白水平表达显著降低(图1,P<0.001),表明CACNA2D3可能参与调控HEI-OC1细胞顺铂损伤过程。
2.2CACNA2D3敲减增强了顺铂导致的HEI-OC1细胞凋亡 利用shRNA技术敲减CACNA2D3,Western blot检测CACNA2D3的表达(图2a)。应用JC-1试剂盒检测各组细胞MMP,以此评估细胞早期凋亡情况。如图2b示,正常培养条件下,CACNA2D3敲减对细胞MMP无影响,但顺铂干预后,sh-Cac3细胞MMP降低程度高于sh-Vector细胞(P<0.01)。
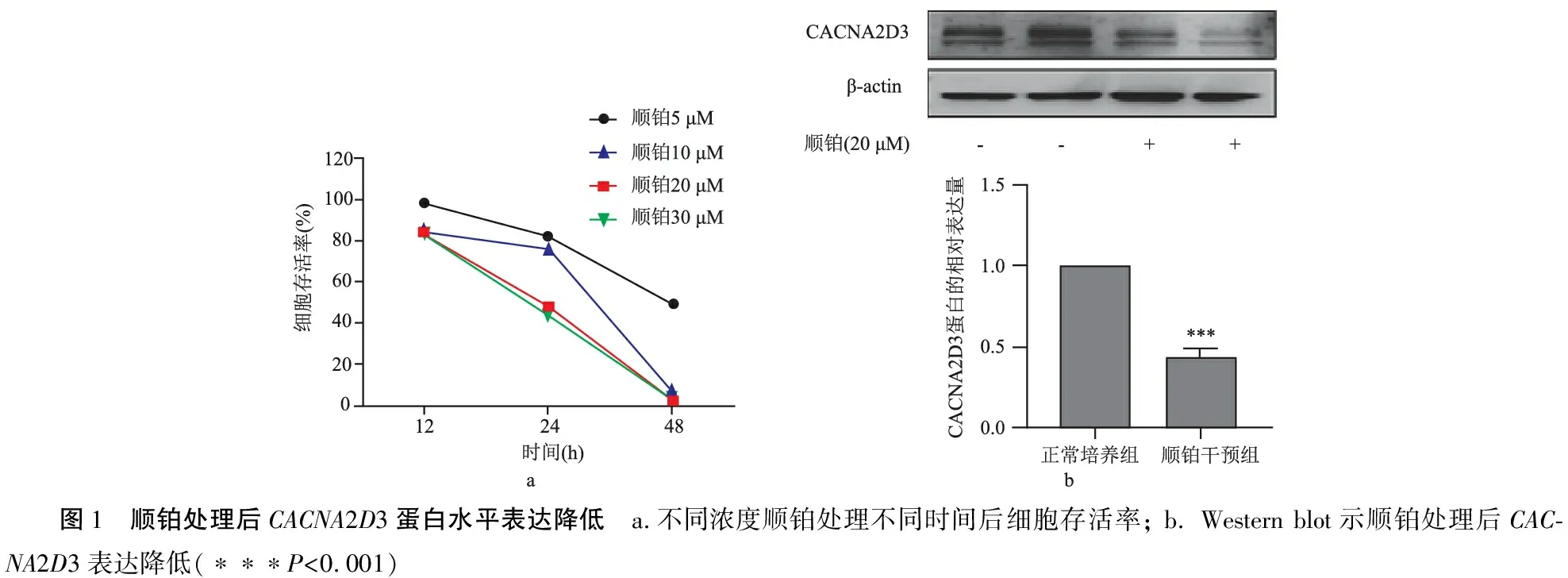
图1 顺铂处理后CACNA2D3蛋白水平表达降低 a.不同浓度顺铂处理不同时间后细胞存活率; b. Western blot示顺铂处理后CAC-NA2D3表达降低(∗∗∗P<0.001)
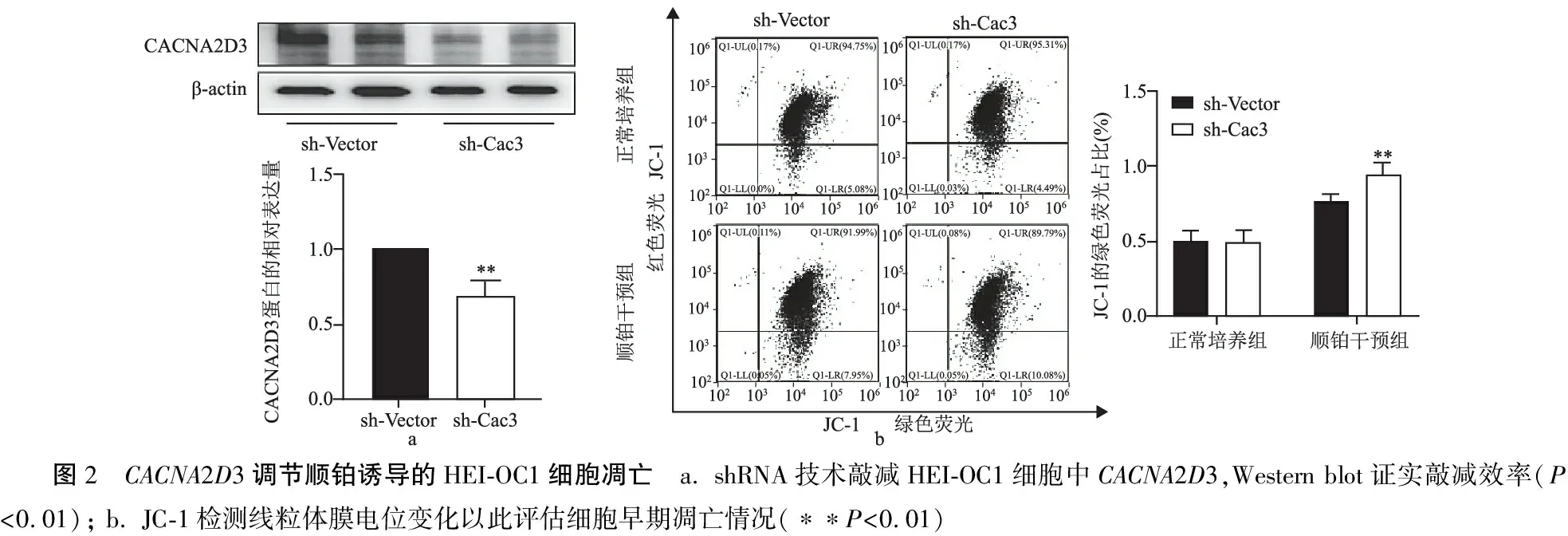
图2 CACNA2D3调节顺铂诱导的HEI-OC1细胞凋亡 a. shRNA技术敲减HEI-OC1细胞中CACNA2D3,Western blot证实敲减效率(P<0.01); b. JC-1检测线粒体膜电位变化以此评估细胞早期凋亡情况(∗∗P<0.01)
通过流式细胞术、Western blot、Tunel染色多方验证各组细胞凋亡情况。流式细胞检测发现CACNA2D3敲减对HEI-OC1细胞凋亡无影响,但促进了顺铂诱导的细胞凋亡(9.41±0.66% vs 11.53±0.45%, 图3a,P<0.01)。Western blot检测经典凋亡相关分子的蛋白水平(图3b),发现顺铂干预后sh-Cac3细胞Bcl2的表达显著降低(P<0.01),而Cleaved-PARP1的表达显著升高(P<0.01)。同时,Tunel染色法发现sh-Cac3细胞Tunel阳性率明显高于sh-Vector细胞(3.08±0.14% vs 6.40±0.43%,图4,P<0.001)。综上所述,CACNA2D3敲减增强了顺铂诱导的HEI-OC1细胞凋亡。
2.3CACNA2D3敲减调节钙相关自噬增强顺铂诱导的细胞凋亡 流式细胞术示,与sh-Vector细胞相比,sh-Cac3细胞内Ca2+水平显著降低(图5a,P<0.05)。顺铂干预后,sh-Vector细胞和sh-Cac3细胞内Ca2+浓度均升高,但前者的增长更为明显(图5a,P<0.01);此外,如图5b所示,顺铂干预组LC3-II的表达明显高于正常培养组(P<0.05),而顺铂干预后sh-Cac3细胞的自噬流明显高于sh-Vector细胞(P<0.01);表明自噬参与了顺铂诱导的细胞损伤,而CACNA2D3可能通过调节钙相关自噬参与其中。
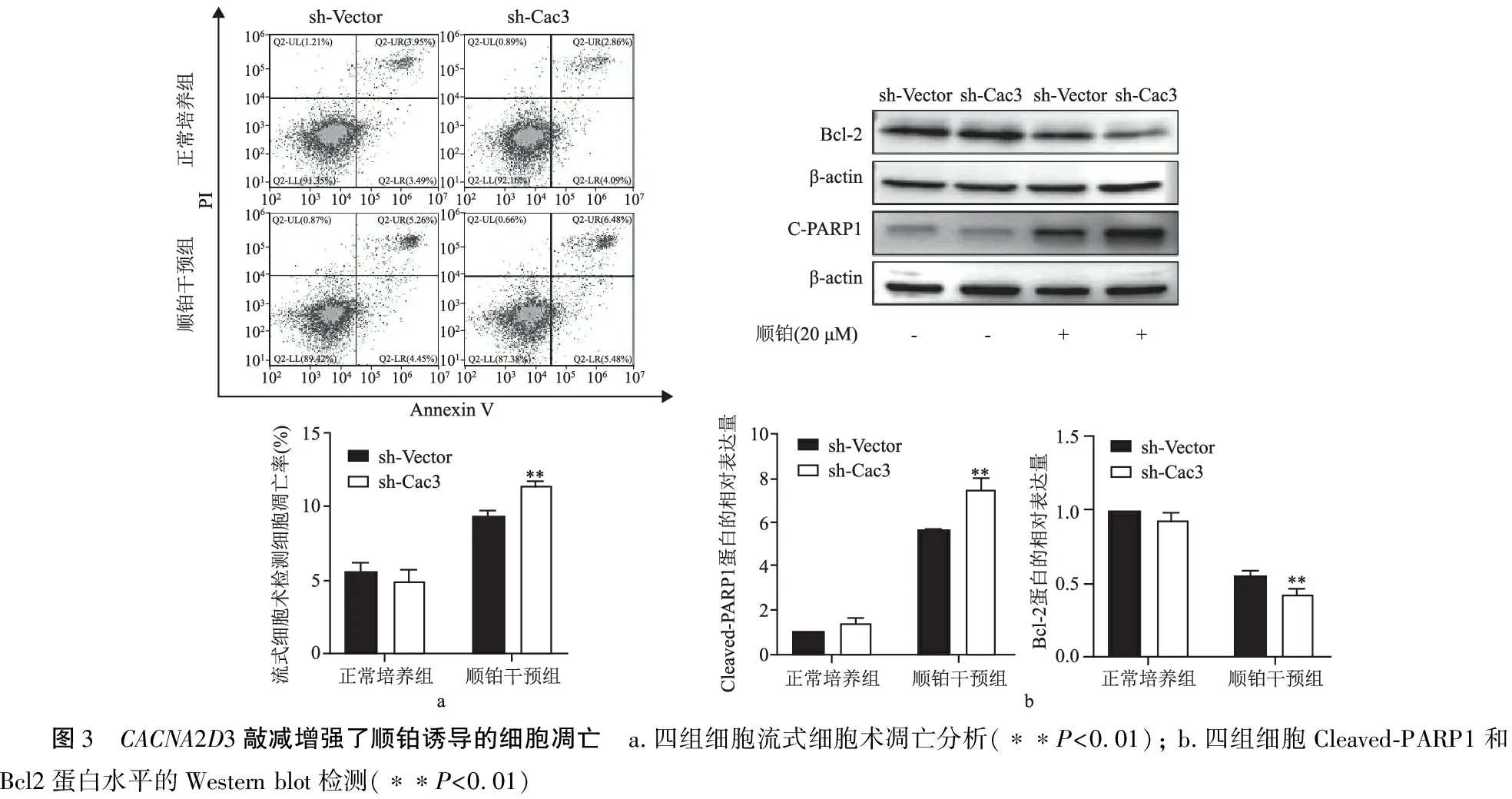
图3 CACNA2D3敲减增强了顺铂诱导的细胞凋亡 a.四组细胞流式细胞术凋亡分析(∗∗P<0.01); b.四组细胞Cleaved-PARP1和Bcl2蛋白水平的Western blot检测(∗∗P<0.01)
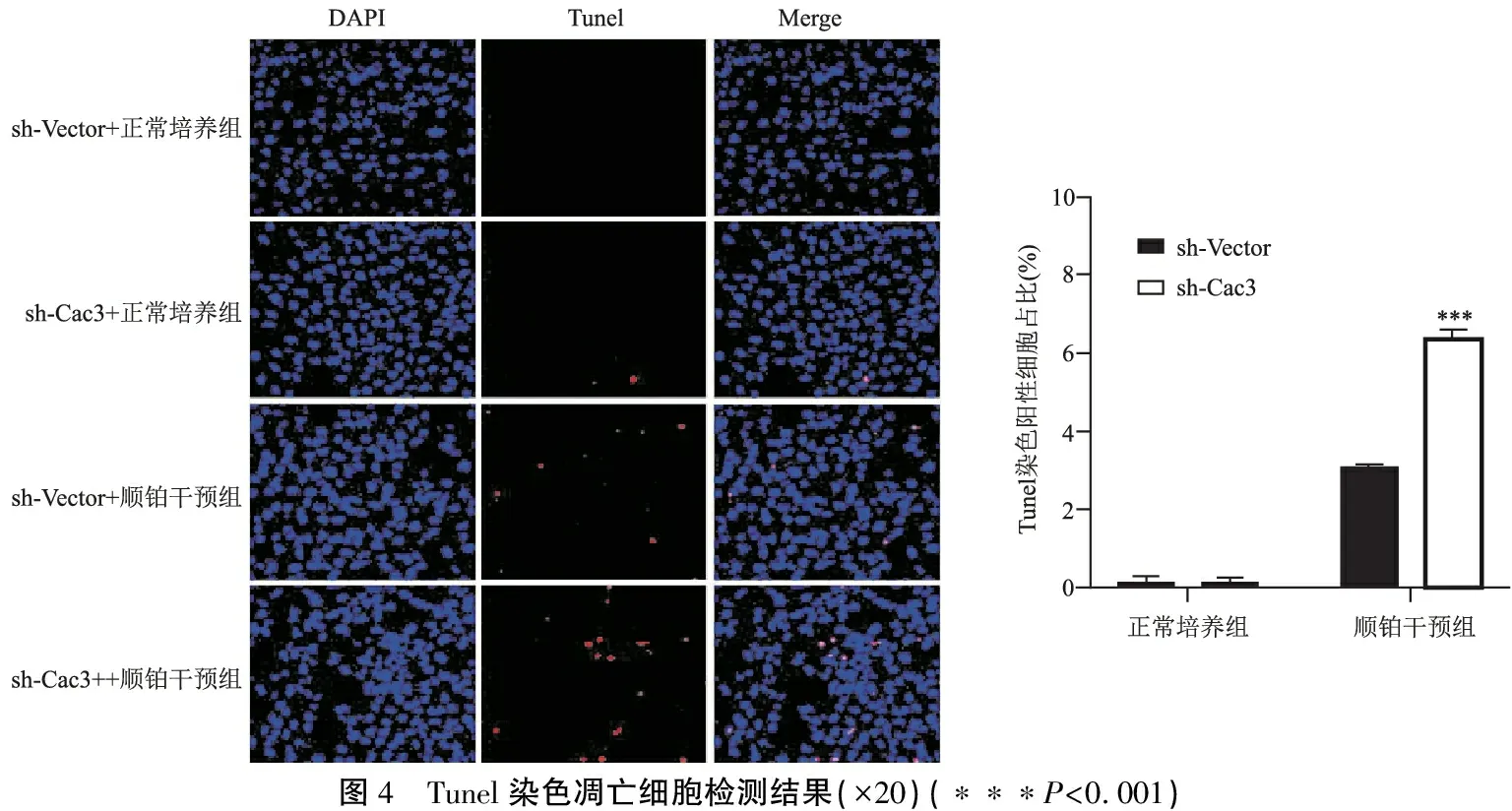
图4 Tunel染色凋亡细胞检测结果(×20)(∗∗∗P<0.001)
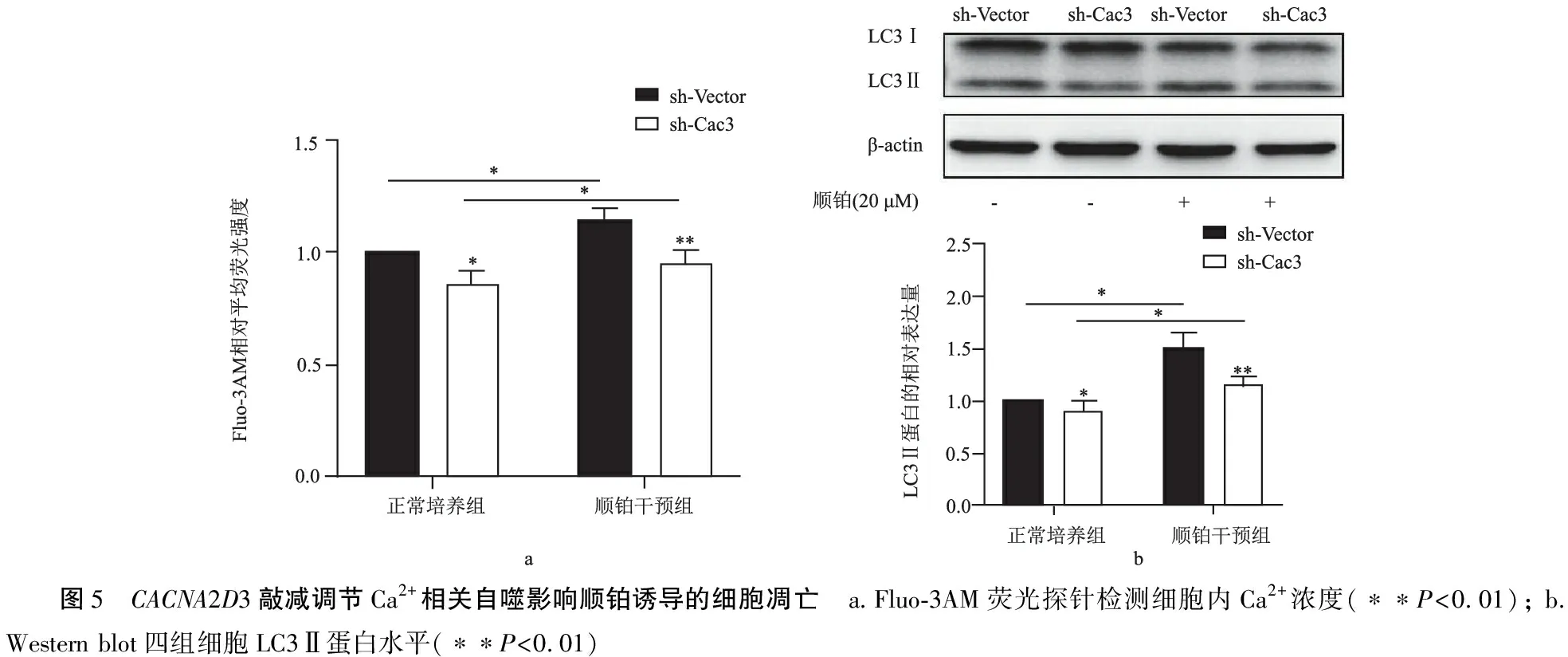
图5 CACNA2D3敲减调节Ca2+相关自噬影响顺铂诱导的细胞凋亡 a.Fluo-3AM荧光探针检测细胞内Ca2+浓度(∗∗P<0.01); b. Western blot四组细胞LC3Ⅱ蛋白水平(∗∗P<0.01)
3 讨论
长期以来,细胞内Ca2+被认为是促进各种细胞死亡过程的重要因素[8],近年来,越来越多的证据证实了细胞内Ca2+在自噬中的作用[9]。CACNA2D3作为电压门控钙通道调节亚基可增加细胞内Ca2+浓度,然而,CACNA2D3调控的Ca2+水平与顺铂耳毒性中细胞凋亡、自噬的关系仍有待进一步研究。
先前的研究证实了CACNA2D3在耳蜗中的表达,表明CACNA2D3对于维持听神经突触的正常结构和功能是必不可少的[10]。此外,CACNA2D3通过诱导Ca2+介导的凋亡,在多种肿瘤中具有潜在的肿瘤抑制功能[6, 11]。与之前的报道一致,本研究发现CACNA2D3敲减可降低细胞内游离Ca2+浓度。Nie等[6]在对食管鳞癌研究时发现CACNA2D3过表达显著增加了顺铂诱导的细胞凋亡,但本研究结果显示CACNA2D3低表达增强了顺铂诱导的HEI-OC1细胞凋亡。既往研究表明,线粒体内Ca2+超载可诱导细胞凋亡[12],同时,通过对各种Ca2+激活刺激的研究,发现Ca2+浓度增加的最终作用是诱导细胞自噬激活[13];Liu等[14]研究表明CACNA2D3可以促进小鼠细胞自噬,以保护小鼠免受结核感染。虽然目前还不清楚这些过程是如何转换和协调的,但由此可见细胞凋亡和自噬具有相同的刺激因子和调节蛋白,只是诱导阈值不同[15],因此,本研究的发现与既往研究并不矛盾。此外,不同的研究结果可能是由于肿瘤细胞与非肿瘤细胞的代谢差异,而激活不同的Ca2+信号途径所导致。
自噬与多种调控通路信号机制相互作用,共同调控细胞死亡;既往研究发现自噬可在顺铂诱导的耳毒性中诱导细胞死亡[16],而另一些研究表明自噬可以降低顺铂对大鼠和斑马鱼的耳毒性[17, 18]。此外,已明确自噬是预防氨基糖苷诱导毛细胞死亡的潜在新治疗靶点[19]。虽然,自噬在顺铂耳毒性中的作用尚未统一,CACNA2D3也可能参与自噬之外的信号转导过程[6, 20],但本研究结果至少表明,抑制钙相关自噬是CACNA2D3敲减增强顺铂诱导耳毒性的机制之一;同时为耳蜗毛细胞顺铂损伤后CACNA2D3调控Ca2+水平与细胞凋亡及自噬的关系提供了新的视角。未来的研究应继续确定下游靶点,进一步探索CACNA2D3调控细胞内Ca2+浓度变化与凋亡、自噬之间的关系,并在动物身上进行验证,为了解顺铂致耳毒性的病理生理机制和治疗方案提供潜在的靶点。
