miR-455-5p 靶向RECK 基因对A549 细胞迁移及微血管形成的影响
2022-05-19刘翠华赵方新孙鹏红梅武建强张烜
刘翠华,赵方新,孙鹏,红梅,武建强,张烜
内蒙古医科大学基础医学院,内蒙古 呼和浩特 010059
肺癌(lung cancer)的发病率和死亡率近年来一直高居各类恶性肿瘤之首,其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)患者比例占全部肺癌的85%以上[1],具有易复发、预后差、生存率低等特点[2-3],主要原因是早期诊断指标不足,发现时多数已发生局部或远端转移,患者的5 年总生存率在过去几十年仍低于20%[4]。临床数据表明,肿瘤转移是NSCLC 治疗失败和复发的主要原因之一[5]。因此,研究NSCLC 的转移机制,发现有效的生物学标记和调控靶点对预防和治疗NSCLC 具有重要意义。
RECK(reversion-inducing cysteine-rich protein with kazal motifs)基因是新型基质金属蛋白酶(matrix metalloproteinase,MMP)抑制基因,可在转录后水平抑制多种MMP 的表达,也可抑制新生血管形成,从而抑制肿瘤的侵袭及转移[6]。RECK 基因缺失时,MMP的过表达可导致细胞外基质(extracellular matrix,ECM)过度降解,血管及周围组织完整性降低,促进新生血管形成;相反,RECK 基因高表达可抑制新生血管的形成。RECK 基因在大部分正常细胞株及正常组织中均有表达,但在多种肿瘤组织及细胞株中不表达[7-9],上调RECK 基因可抑制肿瘤细胞的迁移和浸润[10-11],表明RECK 基因表达与肿瘤转移抑制具有很好的相关性。此外,RECK 对肿瘤进展的影响受微小RNA(microRNA,miRNA)调控。CHEN 等[12]发现,miR-15b 通过靶向抑制RECK 来促进前列腺癌细胞的增殖和侵袭;miR-21 通过对RECK 的负调控作用,增强结肠癌细胞的侵袭和迁移能力[13]。
miRNA 是18 ~25 nt 的内源性非编码单链RNA,通过与靶基因mRNA 的5′或3′非翻译区互补结合,在转录后水平影响靶基因mRNA 的稳定性或干扰其蛋白翻译,参与基因表达调控[14]。miRNA 与肿瘤发生及发展相关,可通过调控其靶基因抑制或促进肿瘤细胞的增殖、迁移、侵袭、凋亡等[15-16]。miR-455-5p 是近年发现的可参与调控多种恶性肿瘤进程的miRNA,在前列腺癌、肝癌、胃癌和宫颈癌中[17-20],miR-455-5p 可通过抑制癌细胞生长、迁移等发挥抑癌基因功能;而在结肠癌[21]、乳腺癌[22-23]和口腔鳞状细胞癌[24]中,miR-455-5p 可促进癌细胞增殖、迁移等恶性进程。另有报道,miR-455-5p 可通与其靶基因或与长链RNA 作用促进NSCLC 恶性进展[25-26],但其是否可靶向RECK 基因参与调控肺癌迁移尚不清楚。
本研究首先通过生物信息学在线网站预测miR-455-5p 与RECK 基因的靶向关系,并进行验证;再进一步探讨miR-455-5p 靶向RECK 对人NSCLC 细胞A549 迁移及微血管形成的影响。
1 材料与方法
1.1 细胞及载体 人NSCLC 细胞系A549 和人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)购自中科院上海细胞库;pGL3-control 荧光素酶报告基因载体和pRL-TK 海肾荧光素酶载体由南开大学惠赠。
1.2 主要试剂及仪器 胎牛血清(fetal bovine serum,FBS)、F12K 培养基、Opti-MEM 培养基、胰蛋白酶、PBS、氨苄青霉素和链霉素均购自美国GIBCO 公司;内皮细胞培养基EGM 购自瑞士Lonza 公司;LipofectamineTM2000 转染试剂购自美国Invitrogen 公司;总RNA 抽提纯化试剂盒、cDNA 特异性反转录试剂盒、miRNA 特异性反转录试剂盒、SYBR Green qPCR SuperMix、RIPA 蛋白质裂解液、蛋白酶抑制剂、BCA蛋白定量试剂盒、牛血清白蛋白(bovine serum albumin,BSA)和ECL 发光液均购自北京全式金生物技术有限公司;miR-455-5p 模拟物、miR-455-5p 抑制剂和miRNA 阴性对照均购自广州锐博生物科技有限公司;PVDF 膜购自美国Millipore 公司;兔抗人REKC 单抗、MMP9 单抗、MMP2 单抗、小鼠抗人β-actin单抗、HRP 标记的羊抗兔和羊抗小鼠IgG 购自美国CST 公司;TranswellTM小室购自美国Corning 公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)-A ELISA 检测试剂盒购自北京达科为生物技术有限公司;基质胶Matrigel 购自美国BD 公司;双荧光素酶报告基因检测试剂盒(Dual-luciferase®repoter assay system)购自美国Promega 公司。
1.3 miR-455-5p 与RECK 基因靶向关系预测 利用UALCAN 网站[27](http:/ / ualcan.path.uab.edu /)在线分析TCGA 数据库资源,获取肺癌中miR-455-5p 和RECK 基因表达水平的临床数据,采用mi-Randa[28](http:/ / www.microrna.org)预测miR-455-5p 与RECK 基因的靶向相关性。
1.4 细胞培养 A549 细胞用含10%FBS、100 μg/mL链霉素、100 U / mL 氨苄青霉素的F12K 培养基,于5% CO2,37 ℃条件下培养;HUVEC 用含10% FBS的EGM 培养基,于5% CO2,37 ℃条件下培养。
1.5 A549 细胞转染 取对数生长期的A549 细胞,按每孔3 × 105个接种于6 孔板中,继续培养过夜,当细胞达70% ~ 80%汇合时,更换为Opti-MEM 培养基。按照转染试剂说明书,用LipofectamineTM2000分别将miRNA 阴性对照(miR-NC 组)、miR-455-5p模拟物(miR-455-5p 组)及miR-455-5p 模拟物+miR-455-5p 抑制剂(inh-455-5p 组)瞬时转染至A549 细胞,设未转染组(Blank),37 ℃培养6 h 后更换细胞培养液,继续培养48 h 后进行后续试验。
1.6 miR-455-5p 与RECK 基因直接靶向关系验证采用双荧光素酶报告基因试验。根据生物信息学预测结果,将含有miR-455-5p 结合位点的RECK 3′UTR 野生型(Wild type)和突变型(Mutant)序列构建至pGL3-control 荧光素酶报告基因载体的荧光素酶基因下游。将构建好的RECK 3′UTR 野生型或突变型重组质粒分别与miR-455-5p 模拟物或阴性对照共转染至A549 细胞中。转染24 h 后,收集细胞,按双荧光报告基因检测试剂盒说明书进行操作,利用多功能酶标仪读取荧光值,并计算相对荧光活性,以miR-NC 组为基准进行归一化处理。
1.7 A549 细胞中miR-455-5p 及RECK 基因表达的检测 采用实时定量PCR(qRT-PCR)法。使用Primer premier 5 软件设计引物,引物序列见表1,由生工生物工程(上海)股份有限公司合成。用总RNA抽提纯化试剂盒提取各组转染细胞中总RNA,分别用miRNA 特异性反转录试剂盒及总RNA 反转录试剂盒将总RNA 中的miRNA 及mRNA 合成cDNA。以cDNA 为模板,用特异性引物,按照SYBR Green qPCR SuperMix 试剂盒说明书,采用qRT-PCR 法检测miR-455-5p 及RECK 基因mRNA 的表达。反应条件为:95 ℃预变性30 min;95 ℃变性10 s,60 ℃退火延伸30 s,40 个循环。分别以U6 和GAPDH 为内参,采用2-ΔΔCt法计算相对表达量。

表1 qRT-PCR 引物序列Tab.1 Primer sequences for qRT-PCR
1.8 A549 细胞中RECK、MMP2 及MMP9 蛋白表达的检测 采用Western blot 法。收集转染48 h 后的A549 细胞,加入含蛋白酶抑制剂的RIPA 裂解液,冰上裂解30 min;4 ℃,12 000 × g 离心20 min,取上清,BCA 法测定蛋白浓度。取30 μg 蛋白样品,经12% SDS-PAGE 分离后,通过湿转法转移至PVDF膜上,用含3% BSA 的TBST 液室温封闭1 h;TBST洗涤后,加入兔抗人RECK、MMP2、MMP9 抗体(均1 ∶1 000 稀释)、小鼠抗人β-actin 抗体(1 ∶2 000 稀释),4 ℃孵育过夜;TBST 洗膜3 次,每次10 min,加入HRP 标记的羊抗兔、羊抗小鼠IgG(1 ∶500 稀释),室温孵育1 h;TBST 洗膜3 次,每次10 min,加入ECL 发光液,于凝胶成像系统中采集图像,利用QuantityOne 软件分析条带灰度值,并以未转染组为基准进行归一化处理。
1.9 A549 细胞迁移能力的检测 采用TranswellTM小室试验。选用膜孔径为8 μm 的24 孔板TranswellTM小室,将转染后的A549 细胞饥饿培养12 h,用0.25%胰蛋白酶消化后,用无血清、含0.2% BSA 的F12K培养基重悬并计数。取细胞悬液100 μL(含1 ×105个细胞)加入TranswellTM小室的上室,下室加入含10% FBS 的F12K 培养基500 μL,置于37 ℃,5%CO2培养箱继续培养24 h;用棉签擦去TranswellTM小室膜内侧细胞,PBS 洗涤后,用95%乙醇室温固定20 min;除去固定液并晾干,用0.1%结晶紫溶液室温避光染色20 min;清水洗去多余染色液,倒置风干,100 倍显微镜下随机选取5 个视野观察拍照,Image J 软件分析迁移细胞数,并以未转染组为基准进行归一化处理。
1.10 A549 细胞培养上清中VEGF-A 表达的检测采用ELISA 法。分别收集各组A549 细胞72 h 后的培养液,4 ℃,2 500 × g 离心20 min,取上清,采用VEGF-A ELISA 试剂盒检测VEGF-A 的分泌量,按试剂盒说明书操作。
1.11 体外微管形成试验 将基质胶Matrigel 按60 μL / 孔平铺于预冷的96 孔板上,37 ℃放置1 h待凝。收集培养的HUVEC,PBS 洗涤2 次,分别用miR-455-5p、inh-455-5p 及miR-NC 组A549 细胞培养液上清重悬HUVEC,并接种于预先铺好基质胶的96 孔板,每孔1×104个细胞,置于37 ℃,5 % CO2培养箱中继续培养15 h。通过倒置显微镜观察成管情况,Image J 软件分析形成的微管结构,并统计管总长度,以未转染组为基准进行归一化处理。
1.12 统计学分析 应用GraphPad Prism 8 软件处理数据,两组间比较采用独立样本t 检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 miR-455-5p 与RECK 基因的相关性 利用UALCAN 网站对TCGA 数据库资源进行在线分析发现,与正常组织相比,肺癌组织中miR-455-5p 的表达显著升高(t = -2.889,P = 0.044),而RECK 基因的表达显著降低(t = 3.320,P = 0.029),二者表达呈负相关,见图1。miRanda 预测结果表明,miR-455-5p 在RECK 基因mRNA 的3′-UTR 区域第97 ~106位碱基处存在与miR-455-5p 的结合域,见图2,表明miR-455-5p 可能对RECK 基因有靶向调控作用。
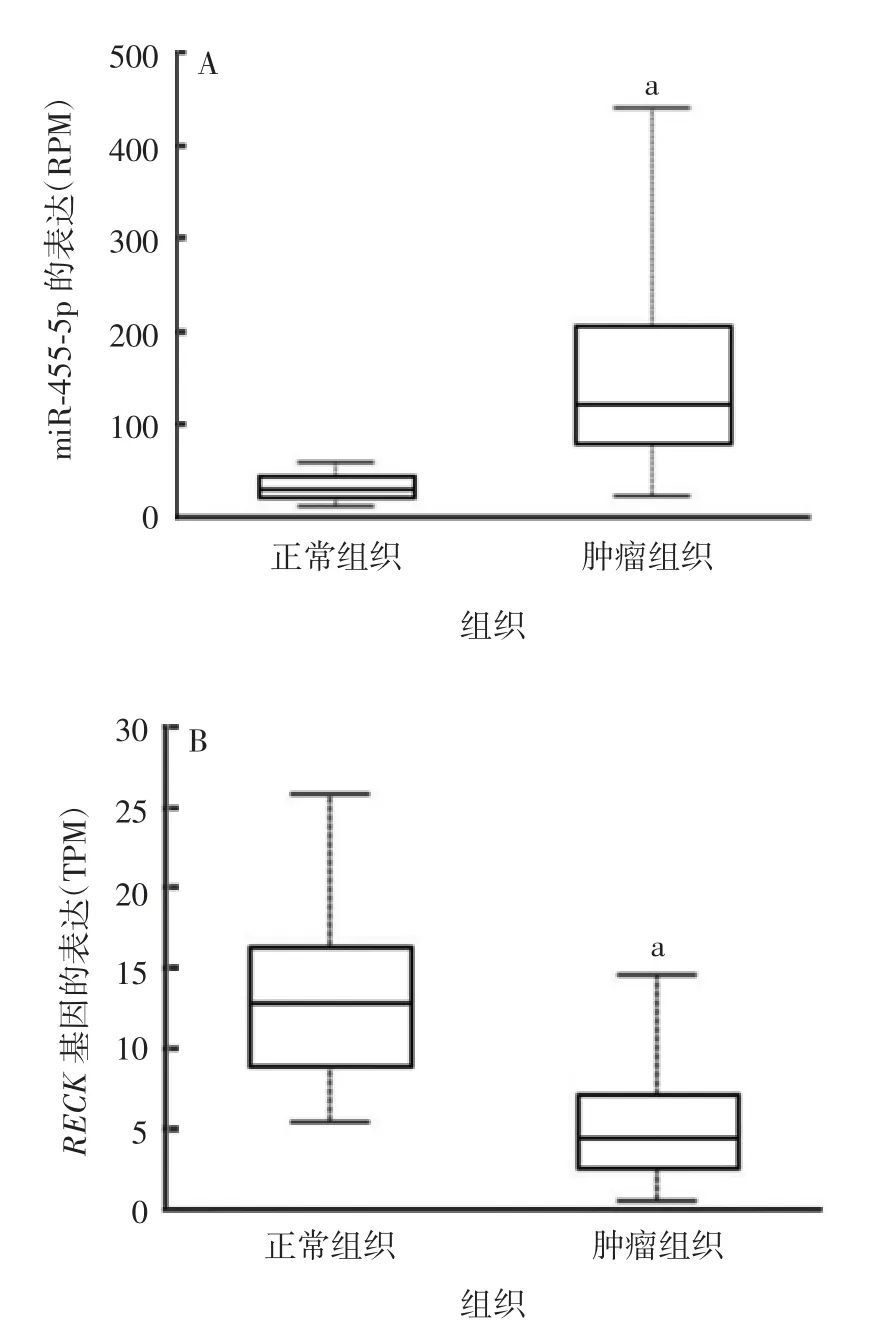
图1 正常组织和肺癌肿瘤组织中miR-455-5p(A)和RECK 基因(B)的表达Fig.1 Expressions of miR-455-5p(A)and RECK(B)genes in normal and lung cancer tissues

图2 miR-455-5p 与RECK 基因靶向关系预测Fig.2 Prediction of targeted relationship between miR-455-5p and RECK
2.2 miR-455-5p 与RECK 基因的直接靶向关系 双荧光素酶报告基因检测结果显示,与miR-NC 组相比,miR-455-5p 模拟物与RECK 3′-UTR 野生型共转染组的荧光素酶活性显著降低(t = 8.734,P =0.001);而结合位点突变后,miR-455-5p 对荧光素酶活性的抑制作用消失,与miR-NC 和突变型共转染组的荧光素酶活性差异无统计学意义(t = 0.222,P = 0.835)。见图3。因此,RECK 基因为miR-455-5p 直接调控靶点。

图3 miR-455-5p 与RECK 基因的靶向关系验证Fig.3 Validation for targeted relationship between miR-455-5p and RECK
2.3 miR-455-5p 对A549 细胞中RECK 基因表达的调控 qRT-PCR 及Western blot 分析显示,与Blank和miR-NC 组相比,miR-455-5p 组miR-455-5p 的表达水平明显升高(F = 38.085,P 均为0.001),RECK基因mRNA 及蛋白的表达水平均显著下调(F 分别为53.54 和18.502,P 均<0.001 或= 0.002),而inh-455-5p 组各自表达均有所恢复(F 分别为53.54 和18.502,P 均<0.001 或= 0.002),见图4 ~图6。提示miR-455-5p 对RECK 基因具有负调控作用。

图4 各组A549 细胞中miR-455-5p(A)和RECK(B)基因mRNA 的表达水平Fig.4 Expression levels of miR-455-5p(A)and RECK(B)mRNAs in A549 cells of various groups

图5 Western blot 分析各组A549 细胞中RECK 蛋白的表达Fig.5 Western blotting for expression of RECK protein in A549 cells of various groups

图6 各组A549 细胞中RECK 蛋白表达量的半定量分析Fig.6 Semi-quantitative analysis for expression levels of RECK protein in A549 cells of various groups
2.4 miR-455-5p 对A549 细胞迁移能力的影响TranswellTM小室试验显示,与Blank 组和miR-NC 组相比,miR-455-5p 组A549 细胞的迁移能力明显增强(F = 465.824,P 均<0.001),而inh-455-5p组这种增强作用受到抑制(F = 465.824,P <0.001),见图7 和图8。表明miR-455-5p 可促进A549 细胞迁移。

图7 显微镜下观察各组A549 细胞的穿膜情况(结晶紫染色,× 100)Fig.7 Microscopy of transmembrane for A549 cells in various groups(crystal violet staining,× 100)

图8 各组A549 细胞的迁移细胞数Fig.8 Numbers of migrated A549 cells in various groups
2.5 miR-455-5p 对A549 细胞MMP2 和MMP9 蛋白表达的影响 Western blot 分析显示,与Blank 组和miR-NC 组相比,miR-455-5p 组A549 细胞中MMP2和MMP9 蛋白的表达水平均显著上调(F 分别为56.121 和58.769,P 均<0.001),而inh-455-5p 组上调受到显著抑制(F 分别为56.121 和58.769,P均<0.001)。见图9 和图10。

图9 Western blot 分析各组A549 细胞中MMP2 和MMP9蛋白的表达Fig.9 Western blotting for expressions of MMP2 and MMP9 in A549 cells of various groups

图10 各组A549 细胞中MMP9(A)和MMP2(B)蛋白表达量的半定量分析Fig.10 Semi-quantitative analysis for expression levels of MMP9(A)and MMP2(B)in A549 cells of various groups
2.6 miR-455-5p 对A549 细胞培养上清中VEGF-A表达的影响 ELISA 检测结果显示,与Blank 组和miR-NC 组相比,miR-455-5p 组A549 细胞培养上清中VEGF-A 分泌量显著增加(F = 182.644,P 均<0.001),而inh-455-5p 组VEGF-A 分泌量的增加受到显著抑制(F = 182.644,P <0.001)。见图11。

图11 各组A549 细胞培养上清中VEGF-A 的分泌Fig.11 Secretion of VEGF-A in culture supernatant of A549 cells of various groups
2.7 miR-455-5p 对微血管形成的影响 miR-455-5p 组形成的微血管网状结构更完整,见图12;Image J 软件分析显示,miR-455-5p 组微管总长度显著高于Blank 组和miR-NC 组(F = 47.61,P 均<0.001),见图13。
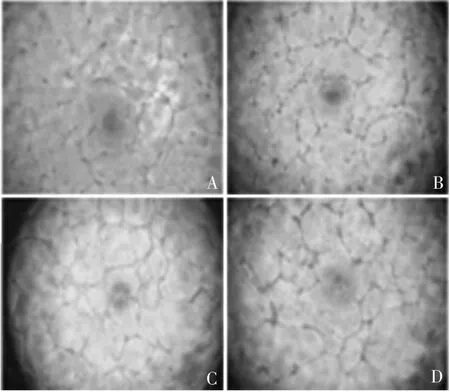
图12 显微镜下观察微管形成情况(× 100)Fig.12 Microscopy for microvascular angiogenesis(× 100)

图13 各组相对微管总长度Fig.13 Relative total capillary lengths in various groups
3 讨 论
研究表明,miRNA 参与调控细胞发育、生长、增殖、凋亡、分化及代谢等重要生物学行为,且与疾病发生相关。miRNA 的异常表达与多种肿瘤发生、发展密切相关,如乳腺癌、肺癌、肝癌、结肠癌、胃癌和血液系统肿瘤等,约50%经验证的miRNAs 在基因组上定位于肿瘤相关的脆性位点[29]。因此,miRNA作为分子标志物在肿瘤诊断和治疗新技术的开发中具有很大潜力,研究其在肿瘤生长及转移过程的调控网络及其作用机制,对肿瘤的诊疗及抗肿瘤药物开发具有重要意义。miRNAs 在不同肿瘤中发挥不同作用,可作为促癌基因诱导细胞恶性转化,也可作为抑癌基因参与抑制肿瘤发生、发展[15-16]。miR-455-5p 在卵巢癌和胶质瘤中表现为抑制肿瘤的转移和进展[17-20],而在胰腺癌、结肠癌、尤因氏肉瘤及乳腺癌中,则发挥促肿瘤作用[21-24]。据报道,miR-455-5p 在NSCLC 组织及顺铂耐药的肺癌细胞株中呈高表达[25-26]。UALCAN 为一个全面的、交互式网络资源[27],用于分析公开的癌症组学数据,可实现TCGA数据库的在线分析和挖掘。本研究利用UALCAN网站对TCGA 数据库资源进行在线分析也显示,miR-455-5p 在肺癌组织中呈明显高表达,提示miR-455-5p 可能与NSCLC 恶性进展相关,但具体作用及其机制尚不清楚。miRNA 对细胞功能的作用是通过调控其靶基因表达实现的,同一个miRNA 可调控多个靶基因,同一个基因也可受多个miRNA 的调控,形成真核生物复杂的转录后调控网络。本研究通过miRanda 对miR-455-5p 的靶基因进行在线预测,发现在RECK 基因mRNA 的3′-UTR 区存在与miR-455-5p 的结合域,表明miR-455-5p 可能对RECK 基因有靶向调控作用。但miR-455-5p 是否通过与RECK 基因直接结合而发挥调控作用尚不清楚。本研究构建了RECK 3′-UTR 野生型或突变型荧光素酶报告基因重组载体,通过双荧光素酶报告基因试验证明了RECK 基因为miR-455-5p 的直接调控靶基因。
RECK 为一种新型的MMP 抑制基因[6],通过抑制多种MMP 的表达抑制新生血管形成,从而抑制肿瘤的侵袭及转移。MMP 是一类能降解ECM 的蛋白水解酶,其中研究较多的是MMP2 和MMP9,通过降解外基质,导致肿瘤周围组织完整性降低,促进新生血管形成及肿瘤细胞的侵袭迁移[30],提示miR-455-5p 可能会通过抑制RECK 的表达而调控细胞的迁移。
本研究通过在A549 细胞中转染miR-455-5p 模拟物发现过表达miR-455-5p 会抑制RECK 基因的表达,而TranswellTM小室试验显示,miR-455-5p 可促进A549 细胞迁移。同时发现miR-455-5p 可上调MMP2 及MMP9 的表达,提示miR-455-5p 可能对肿瘤微血管形成有影响。肿瘤血管新生是肺癌转移的必要条件[31],目前在体外研究血管新生最常用的方法是微管形成试验,在培养板上铺上Matrigel 以模拟基底膜,通过观察内皮细胞在Matrigel 上分化形成管形结构的能力反映微血管生成能力。VEGF-A是诱导内皮细胞分化形成新血管的关键因子,本研究通过ELISA 法检测了A549 细胞培养液中VEGF-A的分泌量,结果显示,转染miR-455-5p 模拟物可显著升高培养液中VEGF-A 的浓度;用此培养液刺激HUVEC 后发现,miR-455-5p 模拟物组诱导HUVEC分化形成微管的能力明显高于对照组,从形成管腔结构的完整性和管总长度分析均表明,miR-455-5p可通过上调A549 细胞VEGF-A 的分泌从而诱导微血管的形成。上述研究证明,miR-455-5p 通过下调RECK 表达,上调MMP2、MMP9 及VEGF-A 的表达促进A549 细胞的迁移及微血管形成。
综上所述,miR-455-5p 可通过直接负调控RECK基因,上调MMPs 和VEGF-A 表达及分泌,进而促进NSCLC 细胞迁移及微血管形成能力,表明miR-455-5p 可作为促癌因子在NSCLC 恶性进展中发挥作用,是NSCLC 转移的一种潜在分子机制。本研究为NSCLC 的临床预防、诊断和治疗提供了新的思路。
