家兔β干扰素启动子质粒的构建及其启动子活性鉴定
2019-03-03陈萌萌范志宇胡波宋艳华魏后军仇汝龙朱伟峰徐为中王芳
陈萌萌 范志宇 胡波 宋艳华 魏后军 仇汝龙 朱伟峰 徐为中 王芳


摘要:通过家兔体内感染兔出血症病毒(RHDV)后发现体内干扰素-β(Interferon-β,IFN-β)基因表达水平明显降低。为体外研究RHDV感染宿主后IFN-β启动子的调控机制,首先以家兔肝细胞总cDNA为模板,利用PCR扩增IFN-β基因启动子区的序列,经测序确定全长为550 bp;预测软件分析,与人源IFN-β基因启动子的转录上调区域(positive regulation domain,PRD)高度同源;随后将启动子全长和一系列转录元件克隆至pGL6-Basic荧光素酶表达载体中,成功构建重组体报告基因质粒后,瞬转RK-13细胞,利用试剂盒检测荧光素酶的相对活性。结果显示,克隆的IFN-β基因启动子区和AP-1、IRF3、NF-κB和IRF7等转录元件具有显著的活性,为研究兔出血症病毒对宿主 IFN-β 基因的转录调控机制提供了有效的工具。
关键词:家兔;兔出血症病毒;IFN-β基因;启动子;荧光素酶;转录调控
中图分类号: S858.291 文献标志码: A 文章编号:1002-1302(2019)23-0078-03
干扰素是一类在机体内广泛存在的糖蛋白,可分为Ⅰ型(IFN-α、IFN-β和ω)和Ⅱ型(IFN-γ)干扰素[1-2]。干扰素-β (interferon-β,IFN-β)是由干扰素诱生剂(微生物和病毒等)刺激生物成纤维细胞和白细胞等产生的高活性多功能蛋白,具有多种生物活性,如抗病毒和免疫调节[1-4]等。近来的研究发现,多种病毒感染机体后能够采取不同的措施显著改变IFN-β的表达水平,从而逃避早期由IFN-β介导的抗病毒天然免疫反应,如在猪伪狂犬病毒[5]、圆环病毒[6]和猪繁殖与呼吸综合征病毒[7]的感染导致的疾病中。目前,对兔天然免疫系统了解很少,而且缺乏有效的检测天然免疫分子的工具,这严重阻碍了病毒与兔宿主相互作用的深入研究。
笔者发现RHDV感染家兔能够显著下调兔体内IFN-β基因的转录水平,推测IFN-β基因水平的降低可能与该病毒的致病性相关。为了分析兔源IFN-β基因的转录调控,笔者所在课题组以家兔IFN-β为研究对象,通过制备一系列含有IFN-β基因启动子和转录元件的重组体报告基因质粒,采用双报告基因系统鉴定IFN-β和转录元件的转录活性,为深入揭示启动子功能研究奠定了基础,同时也为研究RHDV调控IFN-β基因的表达提供有效的工具。
1 材料与方法
1.1 试验材料
兔肾RK-13细胞株由笔者所在实验室保存。DMEM培养基购自美国Hyclone公司。胎牛血清(FBS)和青链霉素溶液均购自美国GIBCO BRL公司。Lip3000脂质体以及无血清培养基均购自美国英杰生命技术有限公司。真核表达载体pcDNA3.1-6his购自南京金斯瑞生物科技有限公司。pGL6-Basic萤火虫荧光素酶报告载体以及pTL-TK海参荧光素酶的内参载体购自上海碧云天生物技术有限公司。
1.2 试验方法
1.2.1 RHDV攻毒 选用3月龄健康易感新西兰兔,分攻毒组和对照组,每组5只。攻毒用毒种为兔出血症病毒皖阜株肝毒,由笔者所在实验室保存。1 mL病毒(含量 105 LD50/mL,LD50为半数致死剂量)为攻毒剂量;等量的PBS(磷酸缓冲盐溶液)作为对照。
1.2.2 IFN-β和病毒基因相对表达量的检测 采用Primer 5.0软件设计针对兔IFN-β基因启动子和RHDV基因的引物(表1),送上海英骏生物技术有限公司合成。称取 0.5 g 肝脏组织匀浆提取RNA,反转录cDNA,以此为模板进行荧光定量PCR检测。体系:SYBR Mix 10 μL,PCR上下游引物(10 μmol/L)各0.4 μL,DNA模板2 μL,ddH2O 7.2 μL,共 20 μL。程序:95 ℃预变性30 s;95 ℃ 5 s,55 ℃ 30 s,循环40次。采用2-ΔΔCT法进行数据分析,计算基因相对表达水平。
1.2.3 IFN-β基因启动子的克隆 采用苯酚-氯仿法提取健康兔肝脏组织DNA,用超微量核酸分析仪检测DNA的完整性、纯度和浓度。以IFNb-F:5′-ATGATCAACAGGTGTATCCTTCAA-3′和IFNb-R:5′-TTAGAGGTAATCTATGAGCATGATGAT-3′为引物,以兔肝组织基因组DNA为模板,PCR扩增兔IFN-β启动子区550 bp序列,体系:50 μL反应体系含模板2 ng,上、下游引物(10 μmol)各1 μL,其他试剂按使用说明加入。程序:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳并回收目的片段,与pMD18-T载体4 ℃连接过夜,转化DH5α感受态细胞,挑取阳性菌,液体LB培养基中过夜培养后,提取质粒,送上海英骏生物技术有限公司测序。
1.2.4 IFN-β基因启动子序列的生物信息学 利用NCBI中的Blast同源性比对兔和人IFN-β基因启动子的转录上调区域PRD序列;通过Promoter 2.0 Prediction软件分析 IFN-β 基因的启动子序列。
1.2.5 IFN-β启动子和顺式作用元件报告基因重组体的构建 以重组IFN-β启动子载体为模板,采用PCR方法克隆IFN-β基因启动子,双酶切后,经1%琼脂糖凝胶电泳后回收酶切片段后连接到pGL6-Basic载体内,构建含IFN-β基因启动子序列的重组质粒pIFN-β-Luc并进一步双酶切和测序鉴定。另外,由公司合成了IRF-3和NF-κB結合位点序列,并构建了重组质粒pIRF-3-Luc和pNF-κB-Luc。
1.2.6 质粒转染 在试验前24 h,将兔肾细胞RK-13接种于24孔板,待细胞达80%融合度时进行转染。采用Invitrogen公司转染试剂lip3000按试剂说明书操作,转染 RK-13 细胞。试验设转染pGL6-Basic载体组(对照组)和pGL6-IFN-β启动子等阳性载体组(试验组),每组3个重复,在24孔板中共转染内参质粒(pRL-TK)与报告质粒,转染24 h后收取细胞。
1.2.7 荧光素酶活性测定 在转染24 h后,弃去培养液,用PBS液洗3次。每孔加入100 μL细胞裂解液,充分裂解细胞20 min后,取25 μL裂解液加入96孔白板,然后按照双荧光素酶检测试剂盒上的说明书操作,在微孔板发光分析仪上检测萤火虫荧光素酶活性(pGL6)和海参荧光素酶活性(pRL-TK)。以萤火虫和海参荧光素酶活性的比值即为相对荧光强度(relative luciferase activity,简称RAL)来指示试验各组的转录活性。计算各组荧光素酶的相对荧光强度RAL。
1.3 数据分析
数据分析采用SPSS 13.0统计学软件,运用统计学分析方法t检验(α=0.05),数据以“平均值±标准差”表示。
2 结果与分析
2.1 肝脏组织病毒和IFN-β mRNA水平测定
Real-time PCR检测结果表明,与对照组相比,兔出血症病毒感染兔体肝脏组织中病毒基因相对表达量快速上升(图1-A);同时,发现在病毒感染48 h以后IFN-β mRNA水平明显降低(图1-B)。
2.2 PCR扩增IFN-β基因启动子序列
设计合成引物以兔肝组织提取的DNA为模板扩增兔IFN-β基因5′UTR区,PCR扩增出约550 bp特异性目的片段(图2),将扩增产物克隆至pMD18-T载体中,筛选阳性质粒后经双酶切鉴定,最后进一步进行测序。测序表明,PCR扩增兔IFN-β基因启动子序列长度为550 bp。
2.3 IFN-β基因启动子及转录因子结合位点分析
在线预测软件分析表明,IFN-β基因启动子的ISRE包含4个转录上调区域(positive regulation domain,PRD)分别是Ⅰ~Ⅳ区(图3-A);此序列包括转录起始位点(+1)上游500 bp,具有典型的真核生物启动IFN-β基因启动子具有AP-1、IRF3、IRF7、NF-κB和TATA-box等典型的真核生物启动子元件[10](图3-A)。Blast序列比对发现,扩增得到的IFN-β基因PRD与人源IFN-β基因启动子PRD序列相似性达98%以上(图3-B)。
2.4 重组报告质粒的的构建和活性鉴定
以携带有IFN-β启动子序列的pMD18-T载体为模板,PCR扩增启动子序列,经双酶切后与酶切的pGL6-Basic载体4 ℃连接,成功构建启动子报告基因载体(pIFN-β-Luc),另外构建转录因子结合元件的荧光素酶报告基因载体(pIRF3-Luc和pNF-κB-Luc),经测序正确。
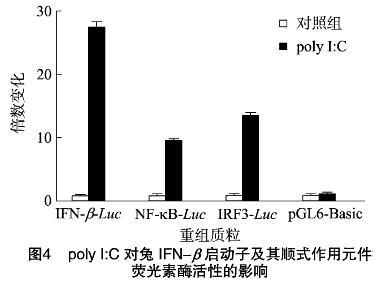
将构建好的重组质粒pIFN-β-Luc、pIRF3-Luc和 pNF-κB-Luc分别转染至RK-13细胞中,同时转染内参质粒(pRL-TK),通过检测荧光素酶的相对活性来反映启动子和顺式作用元件的活性,分别设阴性和阳性polyI:C处理组。荧光素酶活性分析表明,与转染pGL6-Basic对照组相比,polyI:C能明显诱导兔IFN-β基因启动子和顺式作用元件IRF3和NF-κB相对荧光素酶活性(图4), 由此说明成功构建了报告基因重组体。
3 讨论
Ⅰ型干扰素是由病毒直接刺激被感染细胞所转录产生的抵御病毒感染的第一防线,为了逃避宿主的免疫反应,人类乳头状病毒[5]、EB病毒[8]、埃博拉病毒[9]、丙肝病毒[10]等病毒均可通过其编码的病毒蛋白抑制干扰素顺式作用元件的活性从而抑制IFN-β的表达。本研究发现,在兔体感染兔出血症病毒后,会显著下调IFN-β基因的表达量,这也许与兔出血症病毒的致病性密切相关。然而目前对兔天然免疫系统的研究很少,缺乏有效的研究工具。
本研究成功获得了IFN-β的转录起始位点上游550 bp启动子序列,将兔IFN-β启动子及IRF3等顺式作用元件亚克隆进pGL6-Basic中,通过荧光素酶的表达活性来间接表明兔IFN-β基因启动子和顺式作用元件在RK13细胞中的活性,为研究IFN-β转录起始位点上游启动子的生物学活性提供了依据。预测软件分析出IFN-β的启动子含AP-1、IRF3、IRF7和NF-κB等多个转录因子结合序列,暗示IFN-β基因的转录受到多个转录因子的调控。同时,同源性分析发现兔IFN-β基因启动子与人源IFN-β基因启动子[11]序列高度相似,尤其是IRF3和NF-κB转录调控元件,这进一步说明本试验克隆序列的正确性。然而,具體哪些转录因子影响IFN-β的转录活性,还需要对其启动子区进行序列的缺失等试验来证实[12]。总之,本研究构建了IFN-β启动子和顺式作用元件的重组报告质粒,并分析了IFN-β启动子区域含有的AP-1、IRF3、IRF7和NF-κB等多个转录因子结合序列,为研究IFN-β转录调控以及其启动子功能提供了有效工具,也为进一步探究兔出血症病毒的致病机制奠定了基础。
参考文献:
[1]Bogdan C. The function of type I interferons in antimicrobial immunity[J]. Current Opinion in Immunology,2000,12(4):419-424.
[2]Lazear H M,Schoggins J W,Diamond M S. Shared and distinct
functions of type Ⅰ and type Ⅲ interferons[J]. Immunity,2019,50(4):907-923.
[3]Zinzula L,Tramontano E. Strategies of highly pathogenic RNA viruses to block dsRNA detection by RIG-I-like receptors:hide,mask,hit[J]. Antiviral Research,2013,100(3):615-635.
[4]Uehara J,Ohkuri T,Kosaka A,et al. Intratumoral injection of IFN-β induces chemokine production in melanoma and augments the therapeutic efficacy of anti-PD-L1 mAb[J]. Biochemical and Biophysical Research Communications,2017,490(2):521-527.
[5]Wei J Y,Ma Y M,Wang L,et al. Alpha/beta interferon receptor deficiency in mice significantly enhances susceptibility of the animals to pseudorabies virus infection[J]. Veterinary Microbiology,2017,203:234-244.
[6]Huang B,Zhang L L,Lu M Q,et al. PCV2 infection activates the cGAS/Sting signaling pathway to promote IFN-β production and viral replication in PK-15 cells[J]. Veterinary Microbiology,2018,227:34-40.
[7]Luo R,Xiao S,Jiang Y,et al. Porcine reproductive and respiratory syndrome virus(PRRSV)suppresses interferon-β production by interfering with the RIG-I signaling pathway[J]. Molecular Immunology,2008,45(10):2839-2846.
[8]Bentz G L,Liu R,Hahn A M,et al. Epstein-Barr virus BRLF1 inhibits transcription of IRF3 and IRF7 and suppresses induction of interferon-β[J]. Virology,2010,402(1):121-128.
[9]Gupta M,Mahanty S,Ahmed R,et al. Monocyte-Derived human macrophages and peripheral blood mononuclear cells infected with Ebola virus secrete MIP-1α and TNF-α and inhibit Poly-IC-induced IFN-α in vitro[J]. Virology,2001,284(1):20-25.
[10]Abe H,Imamura M,Hiraga N,et al. ME3738 enhances the effect of interferon and inhibits hepatitis C virus replication both in vitro and in vivo[J]. Journal of Hepatology,2011,55(1):11-18.
[11]Ford E,Thanos D. The transcriptional code of human IFN-β gene expression[J]. Biochimica et Biophysica Acta-Gene Regulatory Mechanisms,2010,1799(3/4):328-336.
[12]王艷艳,金 蕊,徐华国,等. 干扰素基因刺激因子启动子的克隆、鉴定及活性分析[J]. 江苏医药,2015,41(13):1489-1491.
收稿日期:2019-09-19
基金项目:国家自然科学基金(编号:31702274);现代农业产业技术体系建设专项资金(编号:CARS-43-C-1)。
作者简介:陈萌萌(1987—),女,江苏连云港人,博士,助理研究员,主要从事家兔疾病防治与兽医生物技术研究。E-mail:moonchen2010@yeah.net。
通信作者:王 芳,博士,研究员,主要从事畜禽疫病防控及免疫机理研究。E-mail:rwangfang@126.com。
