蓖麻矮化相关RcDof 蛋白的原核表达及纯化
2022-05-19张帅王双李跃李国瑞黄凤兰陈永胜
张帅,王双,李跃,3,李国瑞,4,黄凤兰,4,陈永胜,,3,4
1.内蒙古民族大学农学院,内蒙古 通辽 028000;2.内蒙古民族大学生命科学与食品学院,内蒙古 通辽 028000;3.沈阳农业大学食品学院,辽宁 沈阳 110866;4.内蒙古民族大学内蒙古自治区高校蓖麻产业工程技术研究中心内蒙古自治区蓖麻育种重点实验室内蒙古自治区蓖麻产业协同创新培育中心,内蒙古 通辽 028000
蓖麻(Ricinus communis L.)为大戟科双子叶草本植物,是一种油料作物[1],其出油率为世界十大油料作物之首,蓖麻油及其衍生物可用于工农业生产、医药治疗等领域,部分石油产品也可经蓖麻油深加工获得,因此,蓖麻油被喻为可替代石油的“绿色能源”[2]。我国普遍推广高秆蓖麻,但其投入人力较多,经济效益低,产量不高,导致蓖麻油仍以进口为主[3],因此,培育高产、适合机械化栽培的新品种成为蓖麻育种研究的新热点[4-5]。
矮秆蓖麻平均高度为80 ~150 cm,所需空间小,具有节水、抗旱、抗倒伏、易于栽培、利于实现机械化收割等优势,受到蓖麻研究人员的关注。1967年,国外研究者对矮秆蓖麻性状遗传规律、矮化相关基因与农艺性状之间的关系进行了研究[6]。国内对矮秆蓖麻育种研究起步较晚,主要进行矮秆蓖麻引种方面的工作[7]。我国引进蓖麻杂交种,并在多地进行试种,但因适应性差,生长周期长,制种条件不成熟等问题,无法在我国推广种植,这已成为蓖麻产量增长的主要制约因素[8-9]。因此,本研究尝试发掘新的矮化相关基因,探索矮化基因功能与矮化表型间的联系,旨在培育适合我国土壤状况的矮秆蓖麻新品种,使蓖麻产量得到提高。
Dof 基因主要通过调节赤霉素合成及信号转导进而调控植株矮化,相关研究主要集中在水稻、拟南芥、甘蔗等植物上[10-12],在蓖麻方面的研究较少。Dof 蛋白可与多种生长调节剂相互作用[13-14],如赤霉素(gibberellin,GA)、脱落酸等,并能对植株矮化、碳氮平衡、光响应、花的发育、花粉败育、种子萌发、次生代谢、保卫细胞基因的特异性等多方面进行调控[15-18],由于蛋白是一种两性物质,获取较为困难,表达载体和分离方法的选择决定了蛋白能否成功纯化[19-20]。
本研究通过在线软件分析蓖麻Dof 基因全序列,发现在第44 ~101 个碱基之间有一锌指保守结构域,对该段基因进行克隆,并命名为RcDof(44-101),原核表达RcDof(44-101)蛋白后,进行纯化,以期为筛选蛋白结晶条件,研究其在蓖麻中作用的分子机制奠定实验基础。
1 材料与方法
1.1 菌株及质粒 大肠埃希菌BL21(DE3)和原核表达载体pETMBP-XE 均由内蒙古民族大学蓖麻工程中心保存;pMD-18T-RcDof 质粒由内蒙古自治区高校蓖麻产业工程技术研究中心保存。
1.2 主要试剂 DNA 琼脂糖凝胶回收试剂盒和质粒提取试剂盒购自北京庄盟生物技术公司;高保真酶Ex Taq、限制性内切酶NcoⅠ和XhoⅠ、DNA marker、T4 DNA 连接酶、蛋白marker 均购自日本TaKaRa 公司;IPTG、硫酸卡那霉素(Kan)、Tris、NaCl、咪唑、SDS、PMSF 和DTT 购自美国Amersco 公司;酵母浸粉、胰蛋白胨等购自美国Oxide 公司;蛋白纯化仪AKTA purifier 10、RESOURCETMS 1 mL 阳离子层析柱、surdeex 2000 Index 层析柱购自美国GE 医疗生物公司。
1.3 RcDof 基因信号肽及结构域预测 根据RcDof 基因序列(NCB:LOC8271725),利用SignalP 4.0 server(http:/ / wwcbs.dtu.dk / services / SignalP-4.0 /)进行信号肽预测,Iprscan 软件(http:/ / www.ebi.ac.uk /interpro / search / sequence)进行结构域预测。
1.4 RcDof(44-101)基因的扩增 应用SnapGene 5.0.5 软件设计引物,上游引物序列:5′-CCATGGACCAATCAGAGCCTTTGAAGTGT-3′(下划线部分为NcoⅠ酶切位点),下游引物序列:5′-CTCGAGTCGCTTGTTTTTGCGGCCACC-3′(下划线部分为XhoⅠ酶切位点),扩增片段长度174 bp。引物由生工生物工程(上海)股份有限公司合成。以pMD-18T-RcDof质粒为模板进行PCR 扩增,反应条件为:94 ℃预变性5 min;94 ℃变性30 s,51.4 ℃退火30 s,72 ℃延伸30 s,共30 个循环;最后72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测并切胶回收目的片段。
1.5 重组原核表达质粒的构建 用NcoⅠ和XhoⅠ双酶切RcDof 基因片段和pETMBP-XE 载体,以T4 DNA 连接酶16 ℃过夜连接,连接产物通过热激法转化感受态大肠埃希菌BL21(DE3),涂布于含Kan(50 μg/mL)的LB 固体平板上,37 ℃倒扣培养12 h。挑取单个菌落,扩大培养并保存菌种,提取重组质粒,双酶切鉴定,阳性质粒送北京Gengery 公司测序分析。
1.6 RcDof(44-101)蛋白的小量诱导 将含有重组质粒且测序正确的菌株接种于4 mL 含Kan(50 μg/mL)的LB 液体培养基中,37 ℃振荡培养至菌液A600达0.6 ~ 0.8,保存菌种,其余菌液中加入IPTG 至终浓度为0.5 mmol /L,37 ℃振荡培养3 h。各取1 mL 诱导前(对照)和诱导后的菌液,离心弃上清,用50 μL SDS 加样缓冲液悬浮菌体,沸水浴煮沸10 min 使蛋白完全变性,进行15% SDS-PAGE 分析。
1.7 RcDof(44-101)蛋白的大量诱导表达 在50 mL摇瓶中加入25 mL 含Kan(50 μg / mL)的LB 培养基,接种保存的菌种,37 ℃过夜培养。在3 L 摇瓶中加入1 L 含Kan(50 μg / mL)的LB 液体培养基,接种10 mL 大肠埃希菌过夜培养物,37 ℃振荡培养至菌液A600达0.6 ~0.8,加入不同浓度(0.1、0.5、1.0 mmol /L)的IPTG,分别于37 ℃诱导3 h 和18 ℃诱导15 h 后收集菌体,离心弃上清,悬浮菌体,加入1% PMSF 与1 mmol / LDTT,超声破碎后再次离心,分取上清和沉淀进行15% SDS-PAGE 分析。取未诱导的菌液1 mL 作为对照。
1.8 RcDof(44-101)蛋白的纯化 采用亲和层析法分离RcDof(44-101)蛋白,分别用0、20、60、100、200、300、500 mmol / L 咪唑洗脱目的蛋白。使用蛋白纯化仪用20 个柱体积使溶液浓度达到完全高盐浓度(20 mmol / L Tris,1 mol / L NaCl,pH 7.3)后,对目的蛋白进行阳离子交换层析。将经离子交换纯化的目的蛋白进行浓缩,再以0.5 mL / min 的速度,50 mmol / L Tris,pH 7.3 的分子筛Buffer 对目的蛋白进行分子筛层析,UV 法测定蛋白浓度。对各步层析得到的洗脱液进行15% SDS-PAGE 分析。
2 结 果
2.1 RcDof 基因信号肽及结构域预测 分析结果显示,RcDof 基因无信号肽剪切序列,可直接设计引物进行原核表达,见图1;RcDof 基因在44 ~101 个碱基之间存在1 个锌指保守结构域,其他地方无保守域,见图2。

图1 RcDof 基因信号肽序列分析Fig.1 Sequence analysis of signal peptide of RcDof gene

图2 RcDof 基因保守结构域分析Fig.2 Analysis of conserved domain of RcDof gene
2.2 RcDof(44-101)基因扩增产物的鉴定 RcDof(44-101)基因扩增产物经1%琼脂糖凝胶电泳分析,可见174 bp 的单一条带,大小与预期一致,见图3。

图3 RcDof(44-101)基因扩增产物电泳图Fig.3 Electrophoretic profile of PCR product of RcDof(44-101)gene
2.3 重组原核表达质粒的鉴定 pETMBP-XE-RcDof(44-101)的双酶切(NcoⅠ/ XhoⅠ)产物经1%琼脂糖凝胶电泳分析,可见6 344 bp 的载体条带和174 bp的目的基因条带,大小均与预期一致,见图4。测序结果显示,RcDof(44-101)基因与pETMBP-XE 载体正确连接,pETMBP-XE-RcDof(44-101)重组质粒构建正确。

图4 重组原核表达质粒pETMBP-XE-RcDof(44-101)的双酶切(NcoⅠ/ XhoⅠ)鉴定Fig.4 Restriction map of recombinant plasmid pETMBPXE-RcDof(44-101)(NcoⅠ/ XhoⅠ)
2.4 RcDof(44-101)蛋白小量诱导表达产物的鉴定15%SDS-PAGE 分析显示,经IPTG 小量诱导后,可见相对分子质量约43 000 的目的蛋白条带,见图5。

图5 RcDof(44-101)蛋白小量诱导表达产物的SDS-PAGE分析Fig.5 SDS-PAGE profile of expressed RcDof(44-101)protein in a small quantity
2.5 RcDof(44-101)蛋白大量诱导表达产物的鉴定15%SDS-PAGE 分析显示,IPTG 浓度为0.1 mmol/L,温度为37 ℃时诱导效果最好,目的蛋白以可溶形式存在于上清中,见图6。
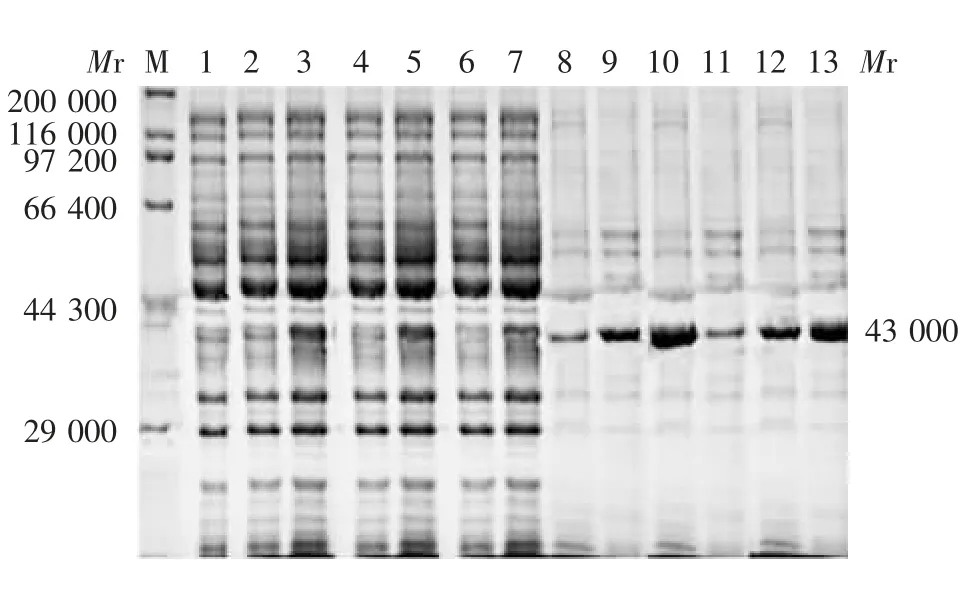
图6 RcDof(44-101)蛋白大量诱导表达产物的SDSPAGE 分析Fig.6 SDS-PAGE profile of expressed RcDof(44-101)protein in a large quantity
2.6 纯化RcDof(44-101)蛋白的鉴定
2.6.1 亲和层析 15%SDS-PAGE 分析显示,咪唑浓度为100、200、300 mmol / L 时,RcDof(44-101)蛋白明显被洗脱下来,且蛋白纯度与浓度较高,见图7。

图7 RcDof(44-101)蛋白亲和层析产物的SDS-PAGE分析Fig.7 SDS-PAGE profile of RcDof(44-101)protein purified by affinity chromatography
2.6.2 阳离子交换层析 亲和层析纯化后的蛋白经脱盐处理后,目的蛋白主要集中在B 液,收集B液利用阳离子交换柱和蛋白纯化仪进一步纯化,洗脱液体积为14 ~22 mL 时,A280有单一峰,RcDof(44-101)蛋白带电状态单一,见图8。15% SDS-PAGE 分析显示,第6 ~9 管洗脱液中蛋白浓度较高,表明阳离子交换层析可成功纯化RcDof(44-101)蛋白,见图9。

图8 RcDof(44-101)蛋白离子交换层析结果Fig.8 Purification of RcDof(44-101)protein by ion exchange chromatography

图9 RcDof(44-101)蛋白离子交换层析产物的SDSPAGE 分析Fig.9 SDS-PAGE profile of RcDof(44-101)protein purified by ion exchange chromatography
2.6.3 分子筛层析 洗脱液体积为15 ~20 mL 时,A280有单一峰,对称性好且分散度低,聚合状态单一且为单体。15% SDS-PAGE 分析显示,第5 ~7 管蛋白浓度较高,见图10。
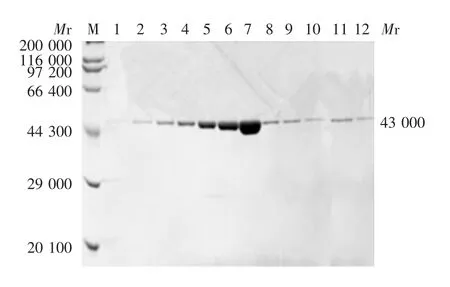
图10 RcDof(44-101)蛋白分子筛层析产物的SDS-PAGE分析Fig.10 SDS-PAGE profile of RcDof(44-101)protein purified by molecular sieve chromatography
2.6.4 蛋白浓缩 浓缩后的蛋白浓度为10 mg/mL,可用于后续晶体生长试验,见图11。

图11 浓缩蛋白的SDS-PAGE 分析Fig.11 SDS-PAGE profile of concentrated protein
3 讨 论
锌指蛋白是植物特有的一类转录因子,种类较多,Dof 蛋白含有特异单锌指DNA 结合结构域,在植物生长发育中具有重要作用[21]。研究发现,DAG1(Dof 同源蛋白)激活后,可增强拟南芥光敏色素基因B(phytochrome B,phB)敏感度,该基因正调节GA合成基因AtGA3ox1 和AtGA3ox2,负调节GA 降解基因AtGA2ox2,从而影响胚轴伸长,使植株产生矮化表型[22-23]。另外,Dof 蛋白通过调节脱落酸(abscisic acid,ABA)合成、降解及信号转导相关基因,使ABA 含量发生改变,同样会使植物矮化[24-25]。
本实验室前期利用cDNA-AFLP 技术从高矮秆蓖麻中分离矮化相关差异表达基因RcDof,采用PCR 法克隆该基因,由于RcDof 基因属植物异源表达基因,合适的表达载体能够帮助蛋白正确折叠,从而获得高纯度可溶蛋白。本实验选择pETMBP-XE原核表达载体,该载体含有T7-lac 启动子、麦芽糖结合蛋白(maltose binding protein,MBP)标签、多组氨酸(6 × His)标签等。T7-lac 启动子能够与宿主菌大肠埃希菌BL21(DE3)共表达T7 溶菌酶,T7 溶菌酶可抑制T7 RNA 聚合酶的表达,从而增加大肠埃希菌BL21(DE3)在诱导和表达之间的滞留时间。6 ×His 标签能够增强融合蛋白结合金属的亲和力,使目标蛋白更易被洗脱,MBP 标签在蛋白表达时具有明显的促溶效果,且在与目的蛋白连接处存在3 个丙氨酸,使目的蛋白与MBP 之间为刚性连接,若进行晶体生长试验,MBP 标签可携带目的蛋白,与目的蛋白结晶方向一致,能促进目的蛋白结晶,因此,本实验选择pETMBP-XE 载体表达RcDof 蛋白。
综上所述,本实验原核表达并纯化获得了RcDof可溶蛋白,为解析该蛋白的晶体结构,分析蛋白功能提供了实验依据。
