新冠灭活疫苗不同免疫针次和免疫间隔诱导抗体免疫反应的比较
2022-05-19苍天乐李克雷蒋聪利胡威刘思远王海欣王美荣刘建凯刘建东
苍天乐,李克雷,蒋聪利,胡威,刘思远,王海欣,王美荣,刘建凯,刘建东
1.北京民海生物科技有限公司结合疫苗新技术研究北京市重点实验室,北京 102600;2.深圳康泰生物制品有限公司 广州 深圳 518000
新型冠状病毒(简称新冠)感染导致的肺炎疫情仍在全世界范围内流行,腾讯疫情数据显示,截至2022 年3 月8 日,已有超过200 多个国家和地区发现了新冠感染病例,全球新冠感染病例已超过4.46亿人,死亡病例超过601 万。疫苗被认为是控制疫情蔓延的最有效手段,目前全球已有几十种不同类型的新冠疫苗上市,中国也已有7 个上市或者紧急批准使用的新冠疫苗,其中5 个上市或紧急批准使用的新冠疫苗为灭活疫苗。尽管已有多个上市的灭活新冠疫苗产品,但灭活疫苗诱导免疫反应的免疫程序的相关研究仍较少,针对灭活疫苗的免疫程序的研究对于更好地了解灭活疫苗诱导的免疫反应情况及加强针免疫策略的制定具有十分重要的意义[1-4]。随着新冠疫情的蔓延,全世界已出现上千种新冠变异株,根据新冠变异株造成的危害和流行情况,WHO将其分为值得担忧的毒株(variants of concern,VOC)、值得关注的毒株(variants of interest,VOI)和其他毒株。目前VOC 变异株为5 个,包括B.1.1.7、B.1.351、P.1、B.1.671.2 和P.1.529,VOI 为2 个,包括C.37和B.1.621[5-8]。新冠变异株的出现给新冠的预防增加了较大难度,目前上市疫苗针对变异株的中和抗体滴度会下降[9-10]。为了更好地优化灭活疫苗诱导免疫反应的免疫程序,提高疫苗保护效率,本文对新冠灭活疫苗不同免疫针次和免疫间隔诱导的免疫反应进行初步研究。
1 材料与方法
1.1 疫苗、病毒、细胞及抗原 新冠灭活疫苗为北京民海生物科技有限公司的中试生产疫苗,抗原含量5 μg / 剂,每剂0.5 mL;原型株新冠由中国疾病预防控制中心病毒病研究所提供;Beta 株新冠由广东省疾控中心提供;Delta 株新冠由深圳第三人民医院提供;Vero 细胞购自ATCC;新冠S 蛋白抗原购自义翘神州生物技术有限公司。
1.2 主要试剂及仪器 磷酸二氢钠、磷酸氢二钠、氯化钾、氯化钠、碳酸钠、碳酸氢钠购自国药集团化学试剂有限公司;HRP 标记的羊抗小鼠IgG 购自北京博奥森生物技术有限公司;HRP 标记的山羊抗小鼠IgG1、IgG2a、IgG2b、IgG3、IgA 和IgM 购自美国Abcam 公司;BSA 购自美国Sigma 公司;酶标仪购自美国Biotek 公司。
1.3 实验动物 SPF 级BALB / c 小鼠,6 周龄,体重18 ~ 22 g,购自北京维通利华实验动物技术有限公司,动物合格证号:11001121102725138。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,严格按照《北京市实验动物管理条例》的相关规定进行动物实验操作。
1.4 动物免疫 将BALB / c 小鼠分为2 组,每组10只,免疫新冠灭活疫苗。一组免疫间隔为14 d,免疫3 针,另一组免疫间隔为28 d,免疫2 针。免疫剂量均为1 μg /(只·次),免疫方式均为肌肉注射。每次免疫后14 d 采血(中间为面部静脉丛采血,末次为摘眼球采血),分离血清,检测针对新冠S 蛋白特异的IgG 结合抗体反应及针对原型株新冠的中和抗体反应。
1.5 免疫血清新冠S 蛋白特异性IgG、IgG1、IgG2a、IgG2b、IgG3、IgM 和IgA 结合抗体的检测 采用ELISA 法。用0.1 mol/L pH 9.6 的碳酸盐缓冲液包被新冠S 蛋白抗原,包被浓度为1 μg / mL,4 ℃过夜;PBST 洗板3 次,拍干后加入封闭液(5% BSA 溶液),200 μL / 孔,37 ℃封闭1 h;PBST 洗板3 次,拍干后加入免疫血清(封闭液1 ∶250 稀释),100 μL/孔,37 ℃反应2 h;PBST 洗板3 次,拍干后加入HRP 标记的山羊抗小鼠IgG、IgG1、IgG2a、IgG2b、IgG3、IgA和IgM(均封闭液1 ∶5 000 稀释),100 μL / 孔,37 ℃反应1 h;PBST 洗板3 次,拍干后加入TMB 显色底物,100 μL / 孔,显色5 min;加入1 mol / L 硫酸溶液终止反应,50 μL / 孔。用酶标仪测定A450值。
1.6 免疫血清中和抗体检测 采用原型株、Beta 株和Delta 株新冠在P3 实验室进行检测。将免疫血清用细胞维持液按1 ∶4 稀释后,加至96 孔培养板,200 μL/孔,重复2 孔,倍比稀释后,加入100 CCID50新冠,混匀,37 ℃,5%CO2培养箱中和2 h;加入(1.5 ~2.5)× 105个/ mL 的Vero 细胞悬液,100 μL / 孔,37 ℃,5% CO2培养箱培养4 d;观察细胞病变。用未感染病毒的细胞作为细胞对照,用PBS 处理的细胞作为阴性对照,用标定的新冠S 蛋白特异的羊血血清作为阳性对照进行质控。能够保护50%细胞不受100 CCID50攻击病毒感染的血清最高稀释度为该血清的抗体滴度。
1.7 统计学分析 使用GraphPad Prism 5 进行数据分析,不同组间的差异分析选用unpaired t test 进行,以P <0.05 为差异有统计学意义。
2 结 果
2.1 不同免疫次数诱导的抗体免疫反应 针对新冠S 蛋白抗原的IgG 结合抗体反应结果显示,2 针免疫后14 d 血清诱导产生的结合抗体反应极显著高于1针免疫(t = 7.199,df = 16;P <0.000 1);3 针免疫后14 d 血清诱导产生的结合抗体反应极显著高于1针免疫(t = 8.584,df = 15;P <0.000 1)。见图1。针对原型株新冠的中和抗体检测结果显示,2 针免疫后14 d 血清中和抗体几何平均滴度为262.79,3 针免疫后14 d 血清中和抗体几何平均滴度为1 142.91,3 针免疫后14 d 血清中和抗体几何平均滴度为2 针免疫后14 d 的4.35 倍;3 针免疫后14 d 血清中和抗体滴度与2 针免疫后14 d 相比,差异有统计学意义(t = 6.006,df = 20;P <0.000 1)。见图2。

图1 灭活疫苗不同免疫次数诱导的IgG 结合抗体免疫反应Fig.1 IgG binding antibody response induced with different doses of inactivated COVID-19 vaccine

图2 灭活疫苗不同免疫次数诱导的中和抗体免疫反应Fig.2 Neutralizing antibody response induced with different doses of inactivated COVID-19 vaccine
2.2 不同免疫间隔时间诱导的抗体免疫反应 针对新冠S 蛋白抗原的IgG 结合抗体反应结果显示,免疫间隔14 d 2 针免疫诱导的结合抗体反应略低于免疫间隔28 d 2 针免疫诱导的结合抗体反应,但两者差异无统计学意义(t=0.227 2,df=16;P >0.05),见图3。针对原型株新冠的中和抗体滴度检测结果显示,免疫间隔14 d 2 针免疫后14 d 血清中和抗体几何平均滴度为262.79,免疫间隔28 d 2 针免疫后14 d 血清中和抗体几何平均滴度为738.43,免疫间隔28 d 2 针免疫后血清中和抗体几何平均滴度为免疫间隔14 d 2 针免疫后的2.81 倍,两者差异有统计学意义(t = 2.699,df = 17;P <0.05)。见图4。
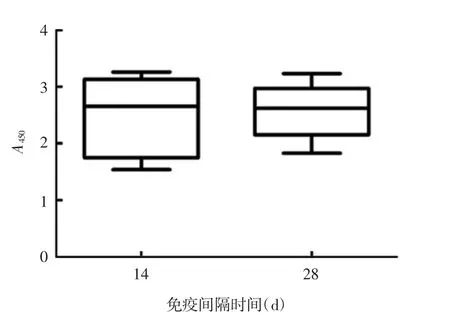
图3 灭活疫苗不同免疫间隔诱导的IgG 结合抗体免疫反应Fig.3 IgG binding antibody response induced with inactivated COVID-19 vaccine at different intervals

图4 灭活疫苗不同免疫间隔诱导的中和抗体免疫反应Fig.4 Neutralizing antibody response induced with inactivated COVID-19 vaccine at different intervals
2.3 不同免疫程序抗体亚类的变化 IgG 抗体亚类的检测结果显示,不同免疫次数诱导的针对新冠S蛋白的IgG1 和IgG2a 抗体逐渐增强,2 针和3 针免疫后血清IgG1(2 针与1 针比较:t = 11.48,df = 15;3 针与1 针比较:t = 23.47,df = 15;3 针与2 针比较:t = 4.127,df = 15;P 均<0.000 1)、IgG2a(2 针与1 针比较:t = 7.611,df = 16;3 针与1 针比较:t =6.358,df = 15;P 均<0.000 1)和IgG2b 抗体(2 针与1 针比较:t = 3.994,df = 15;3 针与1 针比较:t =3.699,df = 15;P 均<0.01)极显著高于1 针免疫后血清产生的抗体反应,IgG2a / IgG1 比值也随着免疫次数逐渐降低。见图5 和图6。提示铝佐剂灭活疫苗抗体成熟过程中抗体会偏向Th2 型。免疫间隔对于诱导产生的IgG1、IgG2a 和IgG2b 抗体以及IgG2a / IgG1 比值影响不大;不同免疫次数与免疫间隔基本不能诱导新冠S 蛋白特异的IgG3 抗体。

图5 不同免疫次数诱导的结合抗体亚类Fig.5 Subclasses of binding antibody induced by different doses of vaccine

图6 不同免疫间隔诱导的结合抗体类型Fig.6 Classes of binding antibody induced by vaccine at different intervals
2.4 不同免疫程序IgM 抗体的变化 不同免疫次数及免疫程序诱导的针对新冠S 蛋白的特异性IgM 抗体检测结果显示,随着免疫次数增加,2 针免疫后IgM 抗体显著高于1 针免疫后(t = 2.650,df = 16;P <0.05),3 针免疫后IgM 抗体相比2 针免疫后有所下降,免疫间隔14 d 诱导的IgM 抗体显著高于免疫间隔28 d(t=3.214,df=16;P <0.01)。见图7。

图7 不同免疫次数(A)和不同免疫间隔(B)诱导的IgM抗体反应Fig.7 IgM antibody response induced by different doses(A)of vaccine at different intervals(B)
2.5 灭活疫苗免疫血清对不同变异株的中和抗体反应 不同新冠变异株的检测结果显示,免疫血清针对变异株的中和抗体滴度会下降,其中针对原型株的中和抗体几何平均滴度为738.43;针对Delta株的中和抗体滴度下降4.52 倍,中和抗体几何平均滴度为163.25;针对Beta 株的中和抗体滴度下降3.20 倍,中和抗体几何平均滴度为230.88。针对原型株的中和抗体滴度显著高于针对Beta 株的中和抗体滴度(t = 2.817,df = 17;P <0.05),极显著高于针对Delta 株的中和抗体滴度(t = 3.161,df =17;P <0.01)。见图8。

图8 3 针免疫后血清对新冠变异株的中和抗体反应Fig.8 Neutralizing antibody response against SARS-COV-2 variants of mouse sera immunized with three doses of vaccine
3 讨 论
新冠引起的肺炎疫情对全球的人类健康造成了巨大威胁。为了应对快速蔓延的新冠疫情,预防性疫苗是保护健康人群免受病毒感染的最有效的手段,目前有5 种不同技术路线研究的新冠疫苗,分别为mRNA 疫苗、重组蛋白疫苗、病毒载体疫苗、DNA 疫苗和灭活疫苗。临床试验结果显示,辉瑞和Moderna 两种上市的mRNA 疫苗BNT162b2 和mRNA-1273 的保护率分别为95%和94.1%[11-12]。上市的病毒载体疫苗主要为腺病毒疫苗,包括5 型、26 型腺病毒以及黑猩猩腺病毒载体疫苗。阿斯利康的黑猩猩腺病毒载体新冠疫苗的保护率为70.4%,康希诺5 型腺病毒载体新冠疫苗的保护率为65.7%,俄罗斯5 型和26 型腺病毒载体新冠疫苗的保护率为91.6%[13-14]。灭活疫苗和重组蛋白疫苗目前已有多家上市产品,疫苗保护率不尽相同。Novavax 公司生产的新冠重组蛋白疫苗NVX-CoV2373 可提供89.3%的保护率,北京生物制品研究所有限责任公司和北京科兴生物制品有限公司生产的新冠灭活疫苗的保护率分别为79.34%和50.38%[15-17]。其中中国已经接种新冠疫苗超过20 亿剂,接种最多的为灭活疫苗。尽管已有多个上市或紧急批准使用的新冠灭活疫苗产品,但新冠疫苗由于研发时间较短,免疫程序尚有很大提升空间。临床研究数据显示,不同厂家的新冠灭活疫苗产生的中和抗体滴度具有较大差异。北京科兴生物制品有限公司生产的灭活疫苗CoronaVac 的中和抗体滴度为64,北京生物制品研究所有限责任公司和武汉生物制品研究所有限责任公司生产的灭活疫苗的中和抗体滴度分别为282.7和247[18-20]。已有研究显示,随着时间的推移疫苗产生的抗体滴度会不断下降[21-22]。为了更好地优化免疫程序,本研究对新冠灭活疫苗的免疫次数和免疫间隔等免疫程序进行了分析,结果显示,3 针免疫产生的中和抗体反应极显著高于2 针免疫诱导产生的中和抗体反应,提示3 针免疫可明显提高疫苗产生的保护性抗体免疫反应,进一步提高了疫苗的保护效果,为健康人群提供了更好的免疫保护。免疫间隔28 d 诱导产生中和抗体和结合抗体反应均优于免疫间隔14 d,可能由于长免疫间隔能够诱导产生更好的免疫记忆反应,快速产生更强的抗体免疫反应。已有研究显示,抗体亚类的变化对抗体的功能具有重要作用,IgG2a / IgG1 比值可确定是Th1 还是Th2 型抗体反应,其中IgG2a 抗体包含的功能性抗体可能更具有保护活性[23-28]。为研究不同免疫程序产生的抗体类型及其IgG 抗体亚类的变化,本研究对不同免疫次数及免疫间隔的血清进行了新冠S蛋白特异性IgG、IgG1、IgG2a、IgG2b、IgG3、IgM 和IgA结合抗体检测,结果显示,随着免疫次数增加,IgG2a和IgG1 抗体反应均显著增加,其中IgG2a / IgG1 比值随免疫次数增加而降低,提示灭活疫苗免疫次数可能会促使抗体偏向Th2 型反应。IgM 是抗体成熟过程中产生的未成熟抗体,随着免疫次数和免疫间隔的变化,抗体不断成熟,IgM 抗体会不断减少。已有研究显示,目前上市的新冠疫苗产品对于新冠变异株的中和抗体反应会发生不同程度的下降从而影响疫苗保护效率[21-22]。本研究结果显示,灭活疫苗免疫血清针对新冠变异株的中和抗体滴度也会下降,下降后的中和抗体滴度仍能提供免疫保护。已有报告显示,随着免疫剂量和免疫次数的增加,灭活疫苗免疫后产生的针对变异株的中和抗体的下降倍数会不断减少[29]。本研究显示,通过优化包括免疫针次和免疫间隔在内的免疫程序,可提高新冠灭活疫苗诱导产生的抗体免疫反应,进而可能会提高疫苗保护效率,为新冠灭活疫苗免疫程序的优化提供了数据支持。
