人骨髓间充质干细胞培养上清在SH-SY5Y 细胞氧化应激损伤修复中的作用及其机制
2022-05-19蒲文星米旭光周阳汪文涛景猛孟繁凯
蒲文星,米旭光,周阳,汪文涛,景猛,孟繁凯
1.长春中医药大学临床医学院,吉林 长春 130117;2.吉林省人民医院,吉林 长春 130021
氧化应激损伤在多种疾病中起重要作用,如帕金森病、创伤性颅脑损伤、脑出血、脑梗死等。氧化应激伴随抗氧化剂储备的耗尽和关键生物分子的损伤[1-2]。1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridine ion,MPP+)是一个带正电荷的分子,通过干扰线粒体氧化磷酸化诱导大量氧化应激,导致神经元损伤[3-4]。人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs)是一种多能细胞,具有自我更新、分化和免疫调节等特性,广泛应用于各种疾病的治疗[5-6]。近年来,体外和体内研究已证明hBMSCs 在临床治疗中的安全性和有效性,在治疗过程中输入hBMSCs 可对损伤或炎症部位产生影响。也有研究表明,hBMSCs 通过分泌生物活性因子表达远距离效应[7-8]。而hBMSCs 所分泌的生物活性因子尽管普遍被认为可保护细胞抵抗氧化应激损伤、减少细胞凋亡和炎症,但其确切机制尚未得到充分研究。本研究利用MPP+处理人神经母细胞瘤细胞SH-SY5Y 建立神经细胞的氧化应激损伤模型,探索hBMSCs 分泌物对神经细胞氧化应激损伤修复作用的机制。
1 材料与方法
1.1 细胞 hBMSCs 和SH-SY5Y 细胞为吉林省人民医院中心实验室传代保存。
1.2 主要试剂及仪器 MesenCultTM-ACF Plus Medium(#05445)和Animal Component-Free Cell Dissociation Kit(#05426)购自英国STEMCELL 公司;NutriFreezTMD10 Cryopreservation Medium(05-713-1)购自以色列BI 公司;DMEM-HIGH GLUCOSE 培养基(SH30022.01)购自美国Hyclone 公司;胰蛋白酶(FG301-01)和凋亡检测试剂盒(FA101-02)购自北京全式金生物技术有限公司;胎牛血清(FB15015)购自美国CLARK公司;Penicillin-Streptomycin(HY-K1006)和外泌体分泌抑制剂GW4869(HY-19363)购自美国MedChem-Express 公司);MPP+(N137206)和DMSO(D103280)购自上海阿拉丁生化科技股份有限公司;MTT(M8-180)购自美国Solarbio 公司;活性氧(reactive oxygen species,ROS)检测试剂盒(S0033M)购自上海碧云天生物技术有限公司;兔抗AKT 单克隆抗体(#4685)、兔抗phospho-AKT XP®单克隆抗体(#4060)、兔抗Bcl-2 单克隆抗体(#4223)、兔抗Bax 单克隆抗体(#14796)、鼠抗GAPDH 单克隆抗体(#51332)、HRP标记的抗兔(#7074)和抗鼠(#7056)IgG 均购自美国Cell Signaling Technology 公司;酶标仪(Multiskan Mk3)购自美国Thermo 公司);流式细胞仪(BeamCyte-1026)购自常州必达科生物科技有限公司。
1.3 细胞培养 用含10%胎牛血清和1%双抗(青霉素-链霉素)的DMEM 高糖培养基,于37 ℃,5% CO2培养箱中常规培养SH-SY5Y 细胞。hBMSCs 的培养、传代采用无血清培养体系,按照试剂说明书操作。
1.4 hBMSCs 培养上清(hBMSCs-Sup)的收集 培养两组hBMSCs,一组正常收集hBMSCs 指数增长期的培养液;另一组加入1 μmol / L GW4869,同样在hBMSCs 指数增长期收集培养液。716 × g 离心5 min,收集上清,分别为hBMSCs-Sup 和无外泌体的hBMSCs-Sup(hBMSCs-Supexo-)。
1.5 细胞活性检测 采用MTT 法。将SH-SY5Y 细胞接种于96 孔板中,每孔6 000 个细胞,培养24 h后,分为4 组:分别用含等容积磷酸盐缓冲液(对照组)、不同浓度MPP+(0.25、0.5、1、2、4 mmol / L)、0.25 mmol / L MPP++ hBMSCs-Sup 或0.25 mmol / L MPP++hBMSCs-Supexo-完全培养基培养不同时间(24、48 和72 h);每孔加入20 μL 5 mg / mL 的MTT 溶液,37 ℃孵育4 h;弃上清,每孔加入100 μL DMSO,低速振荡10 min,用酶标仪检测各孔在波长570 mm处的吸光度值,并计算细胞存活率及MPP+的半数抑制浓度(IC50)。
细胞存活率(%)=(加药处理组A570平均值- 空白对照孔A570值)/(对照组A570平均值-空白对照孔A570值)×100%
1.6 ROS 检测 采用流式细胞术。用无血清培养液1∶2 000 稀释DCFH-DA,使其终浓度为5 μmol / L。分别收集0.25 mmol /L MPP+、0.25 mmol /L MPP++hBMSCs-Sup 处理48 h 和对照组细胞于1.5 mL 离心管中,用稀释好的DCFH-DA 溶液重悬,细胞浓度为1×106~2×107个/mL,37 ℃培养箱内孵育20 min,每隔3 ~5 min 颠倒混匀1 次,使探针和细胞充分接触。用无血清培养液洗涤细胞3 次,充分去除未进入细胞内的DCFH-DA。于流式细胞仪上检测细胞内ROS 的表达。利用FlowJo version 10 软件对数据进行分析。
1.7 细胞凋亡检测
1.7.1 细胞凋亡率 采用流式细胞术。分别收集0.25 mmol / L MPP+、0.25 mmol / L MPP++ hBMSCs-Sup 处理48 h 和对照组细胞,用不含EDTA 的胰酶消化,含血清的培养基终止反应,2 ~8 ℃,500 × g离心5 min,收集(5 ~10)× 104个细胞;用预冷的1× PBS 洗涤2 次,2 ~8 ℃,500 × g 离心5 min,收集细胞;加入100 μL 预冷的1 × Annexin V Binding Buffer,重悬细胞;加入5 μL Annexin V-FITC 和5 μL PI,轻弹混匀,室温(20 ~25 ℃)条件下避光反应15 min;再加入400 μL 预冷的1×Annexin V Binding Buffer,轻弹混匀,将样品冰上避光放置,于流式细胞仪上检测各组细胞的凋亡情况。使用FlowJo version 10 软件对数据进行分析。
1.7.2 细胞凋亡相关蛋白表达 采用Western blot法。在6 孔板中分别用0.25 mmol / L MPP+和0.25 mmol / L MPP++ hBMSCs-Sup 处理细胞48 h,弃这两组及对照组上清,每孔加入100 μL 含1%PMSF的RIPA,提取各组细胞总蛋白,BCA 法测定蛋白浓度。各取20 μL 蛋白,经10% SDS-PAGE 分离后,转移至PVDF 膜上,以10%脱脂牛奶室温封闭1 h;TBST 洗膜,加入兔抗AKT、phospho-AKT XP、Bcl-2、Bax单克隆抗体、鼠抗GAPDH 单克隆抗体(1∶1 000 稀释),4 ℃孵育过夜;TBS-T 洗膜3 次,每次5 min,加入HRP 标记的抗兔和抗鼠IgG(1∶1 000 稀释),室温作用2 h;TBS-T 洗膜3 次,每次10 min,进行化学发光检测。采用Image J 软件对图像进行量化分析。
1.8 统计学分析 应用Excel Office 2019、GraphPad Prism 5、FlowJoTM10.7.1、Image J 等软件进行数据统计和图像处理。多组间比较采用方差分析,两组间比较采用t 检验,以P <0.05 为差异有统计学意义。试验均设4 个复孔。
2 结 果
2.1 MPP+对SH-SY5Y 细胞活性的影响 MTT 检测结果显示,与对照组相比,不同浓度的MPP+处理24、48、72 h,均显著抑制了SH-SY5Y 细胞的存活率(t 分别为7.16、29.39 和45.76,P 分别为5.60 E-03、5.90 E-08 和6.84 E-09),且呈剂量依赖性,见图1。MPP+处理SH-SY5Y 细胞24、48 和72 h 的IC50值分别为(9.14 ± 0.55)、(4.99 ± 0.25)和(4.63 ±0.26)mmol / L,且呈时间依赖性,见图2。
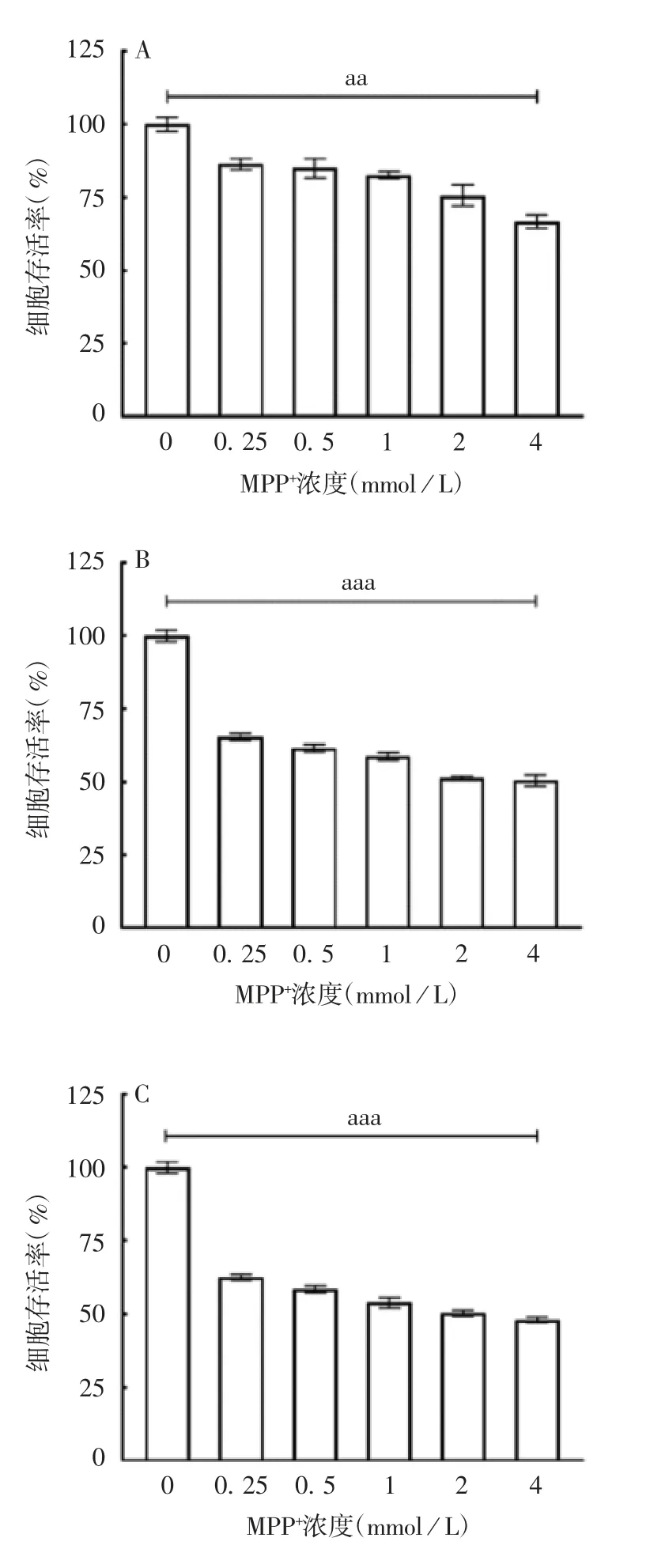
图1 不同浓度MPP+处理24(A)、48(B)、72 h(C)SHSY5Y 细胞的存活率Fig.1 Survival rates of SH-SY5Y cells treated with MPP+ at various concentrations for 24(A),48(B)and 72 h(C)

图2 相同浓度梯度的MPP+处理SH-SY5Y 细胞不同时间的IC50 值Fig.2 IC50 of SH-SY5Y cells treated with MPP+ at the same concentration gradients for various hours
2.2 hBMSCs-Sup 和MPP+对SH-SY5Y 细胞活性的影响 MTT 检测结果显示,0.25 mmol / L MPP+处理SH-SY5Y 细胞48 h 后,细胞存活率为(65.33 ±1.18)%,与对照组相比,显著下降(t = 30.35,P =8.19 E-08);而0.25 mmol / L MPP+和hBMSCs-Sup共处理SH-SY5Y 细胞48 h 后,细胞存活率为(80.44 ±2.98)%,较MPP+单独处理显著升高(t = 14.37,P =8.07 E-05)。见图3。表明hBMSCs-Sup 可减轻MPP+对SH-SY5Y 细胞活性的抑制作用。
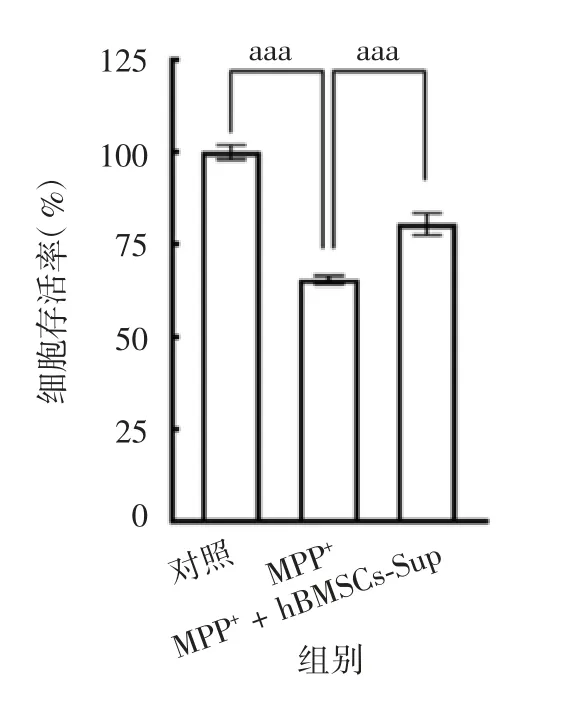
图3 MPP+单独及与hBMSCs-Sup 共处理SH-SY5Y 细胞的存活率Fig.3 Survival rates of SH-SY5Y cells treated with MPP+alone and in combination with hBMSCs-Sup
2.3 hBMSCs-Sup对MPP+诱导的SH-SY5Y细胞ROS含量的影响 流式细胞术检测结果显示,0.25 mmol/ L MPP+处理SH-SY5Y 细胞48 h 后,细胞内ROS 含量显著升高(t=8.42,P=3.95 E-04);而0.25 mmol /L MPP+与hBMSCs-Sup 共处理SH-SY5Y 细胞48 h 后,细胞内ROS 含量显著下降(t=30.69,P=6.54 E-04)。见图4 和图5。表明hBMSCs-Sup 可抑制MPP+在SH-SY5Y 细胞中诱导产生的ROS。

图4 流式细胞术分析各组SH-SY5Y 细胞的ROS 含量Fig.4 Flow cytometry of ROS contents in SH-SY5Y cells of various groups

图5 MPP+单独及与hBMSCs-Sup 共处理SH-SY5Y细胞的ROS 含量Fig.5 ROS contents in SH-SY5Y cells treated with MPP+alone and in combination with hBMSCs-Sup
2.4 hBMSCs-Sup 对MPP+诱导的SH-SY5Y 细胞凋亡的影响
2.4.1 细胞凋亡率 流式细胞术Annexin V/PI 法检测结果显示,0.25 mmol / L MPP+处理SH-SY5Y 细胞48 h 后,细胞凋亡率为28.22%,较对照组(5.57%)显著升高(t = 30.28,P = 6.60 E-04);而0.25 mmol / L MPP+和hBMSCs-Sup 共同处理SH-SY5Y 细胞48 h后,细胞凋亡率为11.19%,较单用MPP+处理组显著下降(t = 7.92,P = 5.11 E-03)。见图6 和图7。表明hBMSCs-Sup 可抑制MPP+诱导的SH-SY5Y 细胞凋亡发生。

图6 流式细胞术分析各组SH-SY5Y 细胞的凋亡率Fig.6 Flow cytometry of apoptosis rates of SH-SY5Y cells in various groups

图7 MPP+单独及与hBMSCs-Sup 共处理SH-SY5Y 细胞的凋亡率Fig.7 Apoptosis rates of SH-SY5Y cells treated with MPP+alone and in combination with hBMSCs-Sup
2.4.2 细胞凋亡相关蛋白表达 Western blot 分析显示,与对照组相比,0.25 mmol / L MPP+处理SH-SY5Y细胞48 h 后,细胞中P-AKT 和Bcl-2 蛋白的表达水平显著降低(t=4.86,P=8.27 E-03),Bax 蛋白的表达水平显著升高(t=6.12,P=3.61 E-03);而0.25 mmol / L MPP+和hBMSCs-Sup 共同处理SH-SY5Y 细胞48 h后,较单用MPP+处理组P-AKT 和Bcl-2 蛋白的表达水平显著升高(t=3.48,P=2.53 E-02),Bax 蛋白的表达水平显著降低(t=4.57,P=1.02 E-02)。见图8 和图9。

图8 Western blot 分析各组SH-SY5Y 细胞凋亡蛋白的表达Fig.8 Western blotting of apoptosis-associated proteins in SH-SY5Y cells of various groups

图9 MPP+单独及与hBMSCs-Sup 共处理SH-SY5Y 细胞中凋亡蛋白的表达水平Fig.9 Expression levels of apoptosis-associated proteins in SH-SY5Y cells treated with MPP+ alone and in combination with hBMSCs-Sup
2.5 hBMSCs-Supexo-和MPP+对SH-SY5Y 细胞活性的影响 MTT 检测结果显示,0.25 mmol / L MPP+和hBMSCs-Supexo-共处理SH-SY5Y 细胞48 h 后,细 胞存活率为(61.65 ± 1.69)%,与单用MPP+[(59.25 ±1.29)%]比较,差异无统计学意义(t = 1.95,P =1.23 E-01),见图10。表明hBMSCs-Sup 中的外泌体为减轻MPP+对细胞活性抑制作用的关键组分。

图10 MPP+单独及与hBMSCs-Supexo-共处理SH-SY5Y 细胞的存活率Fig.10 Survival rates of SH-SY5Y cells treated with MPP+alone and in combination with hBMSCs-Supexo-
2.6 hBMSCs-Supexo-对MPP+诱导的SH-SY5Y 细胞ROS 增加的影响 流式细胞术检测结果显示,0.25 mmol / L MPP+和hBMSCs-Supexo-共处理SHSY5Y 细胞48 h 后,与单用MPP+比较,细胞ROS 含量差异无统计学意义(t = 1.02,P = 3.65 E-01),见图11 和图12。表明hBMSCs-Sup 中外泌体为抑制MPP+诱导SH-SY5Y 细胞ROS 增加的。

图11 流式细胞术分析hBMSCs-Supexo-对MPP+诱导的SH-SY5Y 细胞ROS 增加的影响Fig.11 Flow cytometry of effect of hBMSCs-Supexo- on increase of ROS in SH-SY5Y cells induced with MPP+

图12 各组SH-SY5Y 细胞的ROS 含量Fig.12 ROS contents in SH-SY5Y cells of various groups
3 讨 论
有研究显示,创伤性脑损伤(traumatic brain injury,TBI)、脑出血、脑梗死在各年龄段的疾病中是最常见的死亡和功能缺失原因。低收入和中等收入国家的发病率和死亡率较高,已成为全球卫生挑战[9]。中枢或外周神经系统的创伤往往会导致患者严重的功能缺失和相关后遗症[10]。尽管周围神经系统(peripheral nervous system,PNS)比中枢神经系统(central nervous system,CNS)具有更多的再生潜力,但长期致残率高是由于神经组织的再生潜力总体上有限[11]。而目前临床上普遍采用的对这种严重CNS功能缺失的治疗措施仅局限在简单的康复训练,且效果甚微[12]。
氧化应激损伤的本质是指自由基的产生和抗氧化防御机制之间的严重失衡导致潜在的组织损伤[13-14]。低水平的氧化剂对正常的信号转导过程是必需的,但高水平的氧化剂被证明与许多病理情况有关[15]。MPP+是一种神经毒素,通过破坏线粒体功能,导致氧化应激和神经元死亡[16-17]。本研究将MPP+作为诱导神经细胞氧化应激损伤的药物。
目前间充质干细胞(MSC)移植治疗CNS 损伤的有效性虽已达成共识,但其机制尚不清楚[18]。本研究结果显示,hBMSCs-Sup 对MPP+诱导的SH-SY5Y细胞氧化应激损伤具有明显的修复作用。这种修复作用体现在hBMSCs-Sup 对MPP+诱导的SH-SY5Y细胞活性的恢复、胞内ROS 含量的下调以及细胞凋亡的减少。其潜在机制与hBMSCs-Sup 中的一些生物活性因子参与细胞生命代谢活动有关,本实验也证实了hBMSCs-Sup 可提高经MPP+诱导的SH-SY5Y细胞内P-AKT 及Bcl-2 蛋白的表达水平,且抑制Bax表达。因此,hBMSCs-Sup 中肯定存在某种或多种组分参与调控细胞增殖、凋亡和抗凋亡相关的信号通路。
近几年,随着研究的逐渐深入,外泌体逐渐引起研究者关注。已有研究表明,外泌体是一种内源性的纳米级细胞外脂质双层囊泡,在生理和病理条件下,几乎所有类型的细胞均能分泌,是生命活动中细胞间信号传递的重要媒介[19]。而MSC 来源的外泌体已被证实具有免疫调控、抗凋亡、促进血管新生和组织修复以及改善受损的周围神经功能的作用[20-22],因此,有研究者猜测外泌体可能是干细胞修复神经损伤的重要介质,是治疗性干细胞的良好替代品[23]。GW4869 是一种具有细胞渗透性、非竞争性的中性鞘磷脂酶(neutral sphingomyelinase,N-Smase)抑制剂(外泌体抑制剂),IC50值为1 μmol / L。其对N-SMase具有选择性,在浓度为150 μmol/L 时,对酸性SMase无抑制作用。其能阻断神经酰胺介导的多泡体萌芽,从而抑制多泡体释放外泌体,是常用的抑制外泌体生成的药物[24-25]。本研究使用GW4869 预先处理hBMSCs,收集无外泌体的hBMSCs-Sup 后,证实hBMSCs-Sup 失去了恢复MPP+诱导的SH-SY5Y 细胞氧化应激损伤的能力。提示外泌体是hBMSCs-Sup修复氧化应激损伤的关键组分。
综上所述,hBMSCs-Sup 通过其外泌体组分降低细胞内的ROS 含量,激活AKT 途径,恢复MPP+下调的SH-SY5Y 细胞存活率和MPP+提高的SHSY5Y细胞凋亡率。本研究结果为临床治疗严重CNS损伤及其相关后遗症提供了新的思路和可行的治疗措施。
