基于Wnt/β-catenin 信号通路黄芩素对帕金森大鼠旋转行为及对脑黑质多巴胺能神经元凋亡的影响①
2022-03-22周云鹏刘喜灿卜淑芳郑州大学附属郑州中心医院神经内科郑州450006
李 琳 周云鹏 刘喜灿 卜淑芳 张 申(郑州大学附属郑州中心医院神经内科,郑州 450006)
帕金森(Parkinson's disease,PD)是中老年群体高发慢性神经系统退行性疾病,临床表现为运动迟缓、步态异常、肌强直、静止性震颤等,严重影响患者的正常生活[1]。目前PD 治疗以口服左旋多巴制剂类药物为主,但长期使用存在药效降低、副作用较多等问题[2]。既往研究显示,PD 主要病理变化为脑黑质多巴胺能神经元变性丢失、路易小体形成、纹状体多巴胺分泌减少[3]。因此,研究安全、有效的治疗方式保护PD 神经元、减少多巴胺神经元丢失,从而缓解疾病进程具有广阔前景。黄芩素(baicalein,BA)提取自中草药黄芩的根部,可减轻炎症反应及氧化应激,改善纤溶系统功能,杀灭病原菌。近年来研究发现,BA 同时具有显著的神经保护作用,可减少6-羟多巴胺诱导的多巴胺能神经元及β淀粉样肽诱导的皮层神经元损伤,为神经退行性疾病的治疗提供了可能[4-5]。鉴于此,本研究通过建立PD 大鼠模型,观察BA 对PD 大鼠旋转行为及对脑黑质多巴胺能神经元凋亡的影响,报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性SD大鼠60只,6周龄,体质量(200±20)g,购自中国科学院理化技术研究所,许可证号:SYXK(京)2018-0042。自由进食饮水,饲养环境温度维持在(24±1)℃,相对湿度(55±5)%,12 h/12 h明暗交替下适应性饲养1周。
1.1.2 主要药物与试剂 BA(上海源叶生物科技有限公司);多巴丝肼片(上海罗氏制药有限公司);戊巴比妥钠(北京华业寰宇化工有限公司);二甲基亚砜(dimethyl sulfoxide,DMSO)、6-羟多巴胺、抗坏血酸、阿扑吗啡(江苏菲亚生物科技有限公司);TNF-α、IL-1β、IL-6、超氧化物歧化 酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)ELISA 试剂盒(上海恒远生物科技有限公司);Tunel细胞凋亡原位检测试剂盒(北京博奥森生物工程有限公司);酪氨酸羟化酶(TH)、p-β-catenin、β-catenin、cyclin-D1、c-myc 单抗(美国Abcam 公司);辣根过氧化物酶(horse radish peroxidase,HRP)标记的山羊抗兔二抗[西化仪(北京)科技有限公司]。
1.1.3 主要仪器 Tecan-5082 Sunrise 全自动酶标仪(奥地利TECAN 公司);SM2010R 切片机、EG1150分体式包埋机(德国徕卡显微系统贸易有限公司);CX23 光学显微镜(日本奥林巴斯株式会社);GelDoc-It 310凝胶成像系统(美国UVP公司)。
1.2 方法
1.2.1 模型建立及分组 参照文献[6]建立PD 大鼠模型:取50只大鼠采用2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,采用立体定位仪固定头部,术区皮肤清洁、消毒,沿头部矢状线切开头皮、骨膜,使前囟充分暴露。分别于前囟右3.5 mm、前囟后3.7 mm、硬膜下4.5 mm 位置(纹状体区)矢状缝向右侧1.7 mm、硬膜下7.8 mm(右侧前脑内侧束区)位置注射6-羟多巴胺6 μl(溶于含2 g/L 抗坏血酸的生理盐水中),注射速度为1 μl/min,留针5 min 后以1 mm/min 速度缓慢退针,后逐层缝合,肌注青霉素80 000 U/次,1 次/d,连续7 d 预防感染。10 只大鼠同法注射等量含2 g/L 抗坏血酸的生理盐水不注射6-羟多巴胺,设为伪手术组。建模成功标准:术后14 d 测试大鼠旋转行为,使其在旋转检测仪中适应5 min,安静后以0.5 mg/kg 阿扑吗啡耳后皮下注射诱发旋转试验,诱导大鼠向对侧旋转,观察30 min,平均旋转次数>7 转/min。42 只大鼠建模成功,将其分为PD 组(10 只/组)、BA 低剂量组(10 只/组)、BA高剂量组(11只/组)、多巴丝肼组(11只/组)。
1.2.2 干预方式 确定造模成功后第2 天开始干预,根据前期实验基础并参照文献[7]确定BA干预剂量,BA 低剂量组、BA 高剂量组分别采用80 mg/(kg·d)、160 mg/(kg·d)BA 灌胃,灌胃前用0.1 ml 2%DMSO 溶液溶解,按照5 ml/(kg·d)灌胃,1次/d;多巴丝肼组采用多巴丝肼片干预,根据人、大鼠的体表面积比例换算为等效剂量6.5 mg/(kg·d),使用0.1 ml 2%DMSO 溶液溶解,按照5 ml/(kg·d)灌胃,1 次/d。伪手术组与PD 组均给予等量0.1 ml 2%DMSO溶液灌胃,1次/d,连续干预4周。
1.2.3 旋转行为测试 末次给药后4 h 每组随机选取5 只大鼠以0.5 mg/kg 阿扑吗啡耳后皮下注射诱发其向一侧旋转,记录30 min旋转次数。
1.2.4 组织取材、保存 旋转行为测试完成后次日每组脱颈处死10 只大鼠,迅速取出完整脑组织,冰盘上分离脑黑质,5 只大鼠分离的脑黑质保存于-80℃备用,5只大鼠分离的脑黑质以40%中性甲醛固定备用。
1.2.5 脑黑质IL-1β、TNF-α、IL-6 水平测定 取冷冻保存的脑黑质组织,加入1 ml PBS,剪刀剪碎,置于预冷玻璃匀浆器中,捣杆充分研磨约5 min,使组织匀浆化。匀浆后10 000 r/min 离心10 min,离心半径10 cm,ELISA 试剂盒检测脑黑质组织中IL-1β、TNF-α、IL-6水平,采用酶标仪测定570 nm 波长时的吸光度光密度值,根据标准曲线计算IL-1β、TNF-α、IL-6水平。
1.2.6 脑黑质SOD、MDA 水平测定 取冷冻保存的脑黑质组织,同1.2.5 匀浆、离心,分别按照SOD、MDA 试剂盒说明书要求,经硫代巴比妥酸比色法、羟胺法测定脑黑质SOD、MDA 水平,严格按照试剂盒要求设计实验步骤。
1.2.7 TH 染色观察各组脑黑质多巴胺能损伤情况 取40%中性甲醛固定的脑黑质组织,常规脱水、包埋,以病理切片机制作成4 μm 连续切片,采用TH免疫组化染色。3%过氧化氢孵育10 min,蒸馏水冲洗,PBS 浸泡,滴加5 ml 枸橼酸盐抗原修复液,微波高火10 min,常温下冷却至40℃,蒸馏水冲洗。山羊血清室温封闭15 min,弃去血清后甩干。滴加TH单抗(1∶1 000),4℃孵育24 h,滴加生物素标记的山羊抗兔IgG 二抗。显微镜下DAB 染色,室温孵育3 s,PBS 冲洗,苏木素复染,脱水,干燥,中性树胶封片,于显微镜下观察。TH阳性神经元为棕褐色,采用多媒体彩色病理图文分析系统分析图像。
1.2.8 Tunel染色测定各组脑黑质多巴胺能神经元凋亡率 取40%中性甲醛固定的脑黑质组织,常规脱水、包埋,以病理切片机制作成4 μm连续切片,严格按照Tunel 细胞凋亡原位检测试剂盒说明书要求加入Tunel反应混合液,湿盒中37℃孵育1 min,PBS冲洗后加入POD 转化剂,湿盒中继续孵育30 s,PBS冲洗,加入DAB 底物溶液,室温孵育3 s,PBS 冲洗,苏木素复染、脱水、干燥、中性树胶封片,于显微镜下观察。细胞核被染成棕色或棕黑色为阳性细胞,凋亡率(%)=阳性细胞数/细胞总数×100%。每张切片任选5个视野计数,求平均值。
1.2.9 Western blot 测定各组脑黑质p-β-catenin、β-catenin、cyclin-D1、c-myc 蛋白相对表达量 取冷冻保存的脑黑质组织50 mg,充分研磨,转至离心管,加入RIPA细胞裂解液,于冰上裂解30 min,提取总蛋白,BCA 试剂盒测定蛋白浓度。沸水浴5 min使蛋白变性,10 000 r/min 离心20 min,离心半径10 cm,进行聚丙烯酰胺凝胶电泳,湿转至PVDF 膜,5%脱脂奶粉封闭2 h,加入稀释倍数为1∶1 000 的p-β-catenin、β-catenin、cyclin-D1、c-myc 单抗,4℃摇床孵育过夜,洗膜3 次,每次8 min,加入稀释倍数为1∶10 000 的HRP 标记的山羊抗兔IgG 二抗,室温孵育2 h,洗膜3 次,每次8 min,加入ECL 发光液,曝光,以凝胶成像系统扫描、分析灰度值,蛋白相对表达量以p-β-catenin、β-catenin、cyclin-D1、c-myc 与内参β-actin灰度值的比值表示蛋白相对表达量。
1.3 统计学分析 采用SPSS22.0统计软件对数据进行分析,以表示计量资料,以单因素方差分析处理多样本资料,如Levene检验方差齐,以单因素方差分析处理总均值,采用LSD-t两两比较,若Levene检验方差不齐,改用welch检验行总体均值比较,然后再采用Dunnett T3检验两两比较。P<0.05 表示差异存在统计学意义。
2 结果
2.1 各组大鼠旋转情况比较 30 min 旋转次数组间比较差异有统计学意义(P<0.05);与伪手术组相比,PD 组、BA 低剂量组、BA 高剂量组、多巴丝肼组30 min旋转次数增加(P<0.05);与PD组相比,BA低剂量组、BA 高剂量组、多巴丝肼组30 min 旋转次数减少,差异有统计学意义(P<0.05);与BA 低剂量组相比,BA 高剂量组、多巴丝肼组30 min 旋转次数减少(P<0.05);与BA 高剂量组相比,多巴丝肼组30 min旋转次数减少(P<0.05)。见表1。
表1 各组大鼠旋转情况比较(,次)Tab.1 Comparison of rats rotation times in each group(,times)

表1 各组大鼠旋转情况比较(,次)Tab.1 Comparison of rats rotation times in each group(,times)
Note:Compared with Sham group,1)P<0.05;compared with PD group,2)P<0.05;compared with BA low-dose group,3)P<0.05;com⁃pared with BA high-dose group,4)P<0.05.
2.2 各组脑黑质IL-1β、TNF-α、IL-6 水平比较 脑黑质IL-1β、TNF-α、IL-6 水平组间比较差异均有统计学意义(P<0.05);与伪手术组相比,PD 组、BA 低剂量组、BA 高剂量组、多巴丝肼组脑黑质IL-1β、TNF-α、IL-6 水平均升高(P<0.05);与PD 组相比,BA 低剂量组、BA 高剂量组、多巴丝肼组脑黑质IL-1β、TNF-α、IL-6 水平均降低(P<0.05);与BA 低剂量组相比,BA高剂量组、多巴丝肼组脑黑质IL-1β、TNF-α、IL-6 水平均降低(P<0.05);与BA 高剂量组相比,多巴丝肼组脑黑质IL-1β、TNF-α、IL-6 水平均降低(P<0.05)。见表2。
表2 各组脑黑质IL-1β、TNF-α、IL-6水平比较(,n=5)Tab.2 Comparison of IL-1β,TNF-α and IL-6 levels in substantia nigra in each group(,n=5)
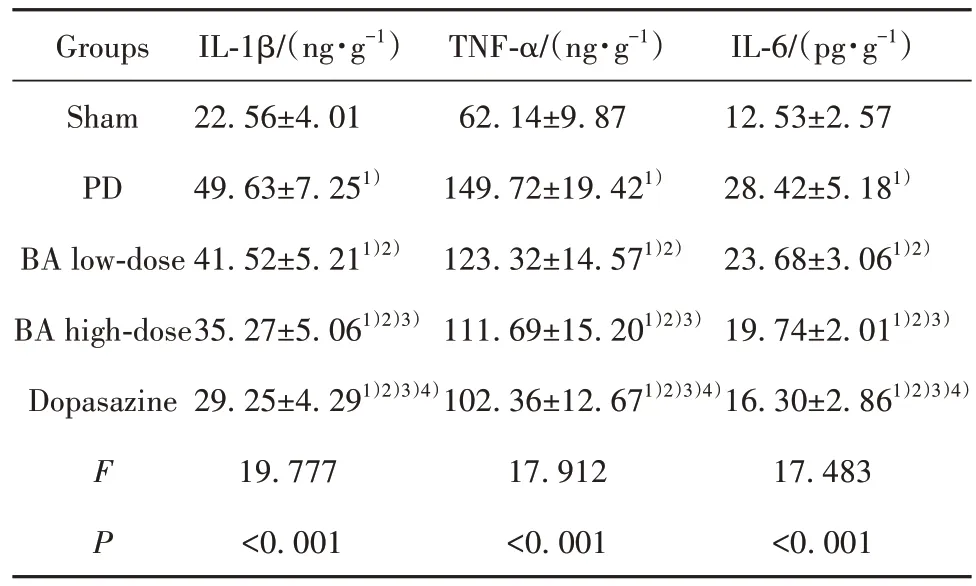
表2 各组脑黑质IL-1β、TNF-α、IL-6水平比较(,n=5)Tab.2 Comparison of IL-1β,TNF-α and IL-6 levels in substantia nigra in each group(,n=5)
Note:Compared with Sham group,1)P<0.05;compared with PD group,2)P<0.05;compared with BA low-dose group,3)P<0.05;com⁃pared with BA high-dose group,4)P<0.05.
2.3 各组脑黑质SOD、MDA 水平比较 脑黑质SOD、MDA 水平组间比较差异有统计学意义(P<0.05);与伪手术组相比,PD 组、BA 低剂量组、BA 高剂量组、多巴丝肼组脑黑质MDA 水平均升高,SOD水平均降低(P<0.05);与PD 组相比,BA 低剂量组、BA 高剂量组、多巴丝肼组脑黑质MDA 水平均降低,SOD水平均升高(P<0.05);与BA低剂量组相比,BA高剂量组、多巴丝肼组脑黑质MDA 水平均降低,SOD 水平均升高(P<0.05);与BA 高剂量组相比,多巴丝肼组脑黑质MDA 水平降低,SOD 水平升高(P<0.05)。见表3。
表3 各组脑黑质SOD、MDA水平比较(,n=5)Tab.3 Comparison of SOD and MDA levels in substantia nigra in each group(,n=5)

表3 各组脑黑质SOD、MDA水平比较(,n=5)Tab.3 Comparison of SOD and MDA levels in substantia nigra in each group(,n=5)
Note:Compared with Sham group,1)P<0.05;compared with PD group,2)P<0.05;compared with BA low-dose group,3)P<0.05;com⁃pared with BA high-dose group,4)P<0.05.
2.4 各组脑黑质多巴胺能损伤情况观察 伪手术组脑黑质TH 染色结果可观察到细胞丰富,胞体均匀着色,具有丰富突起;PD 组脑黑质多巴胺能神经元细胞数量、残存神经细胞突起显著减少;BA 低剂量组、BA 高剂量组、多巴丝肼组经干预后脑黑质多巴胺神经细胞数量增加,神经细胞突起丰富,其中多巴丝肼组改善最为明显,其次为BA 高剂量组,最后为BA低剂量组。见图1。

图1 各组脑黑质TH染色结果(×400)Fig.1 Results of TH staining of brain substantia nigra in each group(×400)
2.5 各组脑黑质多巴胺能神经元凋亡情况观察各组脑黑质多巴胺能神经元凋亡率比较差异均有统计学意义(P<0.05);与伪手术组相比,PD 组、BA低剂量组、BA 高剂量组、多巴丝肼组脑黑质多巴胺能神经元凋亡率均升高(P<0.05);与PD组相比,BA低剂量组、BA 高剂量组、多巴丝肼组脑黑质多巴胺能神经元凋亡率均降低(P<0.05);与BA 低剂量组相比,BA 高剂量组、多巴丝肼组脑黑质多巴胺能神经元凋亡率均降低(P<0.05);与BA 高剂量组相比,多巴丝肼组脑黑质多巴胺能神经元凋亡率降低(P<0.05)。见表4、图2。

图2 各组脑黑质Tunel染色结果(×400)Fig.2 Tunel staining results of substantia nigra in each group(×400)
表4 各组脑黑质多巴胺能神经元凋亡情况观察(,n=5)Tab.4 Observation on apoptosis of substantia nigra dopa⁃minergic neurons in each group(,n=5)
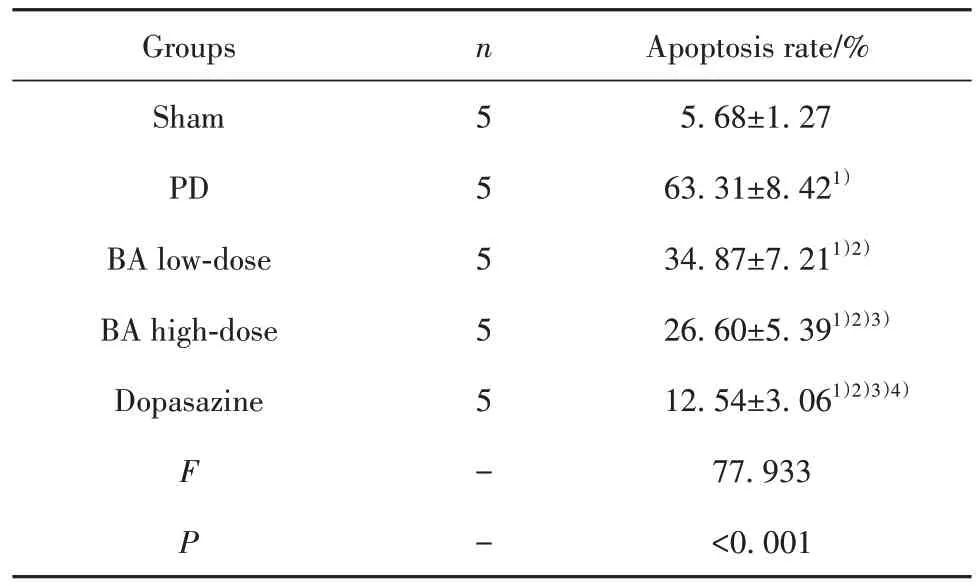
表4 各组脑黑质多巴胺能神经元凋亡情况观察(,n=5)Tab.4 Observation on apoptosis of substantia nigra dopa⁃minergic neurons in each group(,n=5)
Note:Compared with Sham group,1)P<0.05;compared with PD group,2)P<0.05;compared with BA low-dose group,3)P<0.05;com⁃pared with BA high-dose group,4)P<0.05.
2.6 各组脑黑质p-β-catenin/β-catenin、cyclin-D1、c-myc 蛋白相对表达量比较 脑黑质p-β-catenin/β-catenin、cyclin-D1、c-myc 蛋白相对表达量组间比较差异均有统计学意义(P<0.05);与伪手术组相比,PD 组、BA 低剂量组、BA 高剂量组、多巴丝肼组p-β-catenin/β-catenin、cyclin-D1、c-myc 蛋白相对表达量均降低(P<0.05);与PD 组相比,BA 低剂量组、BA 高剂量组、多巴丝肼组p-β-catenin/β-catenin、cyclin-D1、c-myc 蛋白相对表达量均升高(P<0.05);与BA 低剂量组相比,BA 高剂量组、多巴丝肼组p-β-catenin/β-catenin、cyclin-D1、c-myc 蛋白相对表达量均升高(P<0.05);与BA 高剂量组相比,多巴丝肼组p-β-catenin/β-catenin、cyclin-D1、c-myc 蛋白相对表达量均升高(P<0.05)。见表5、图3。
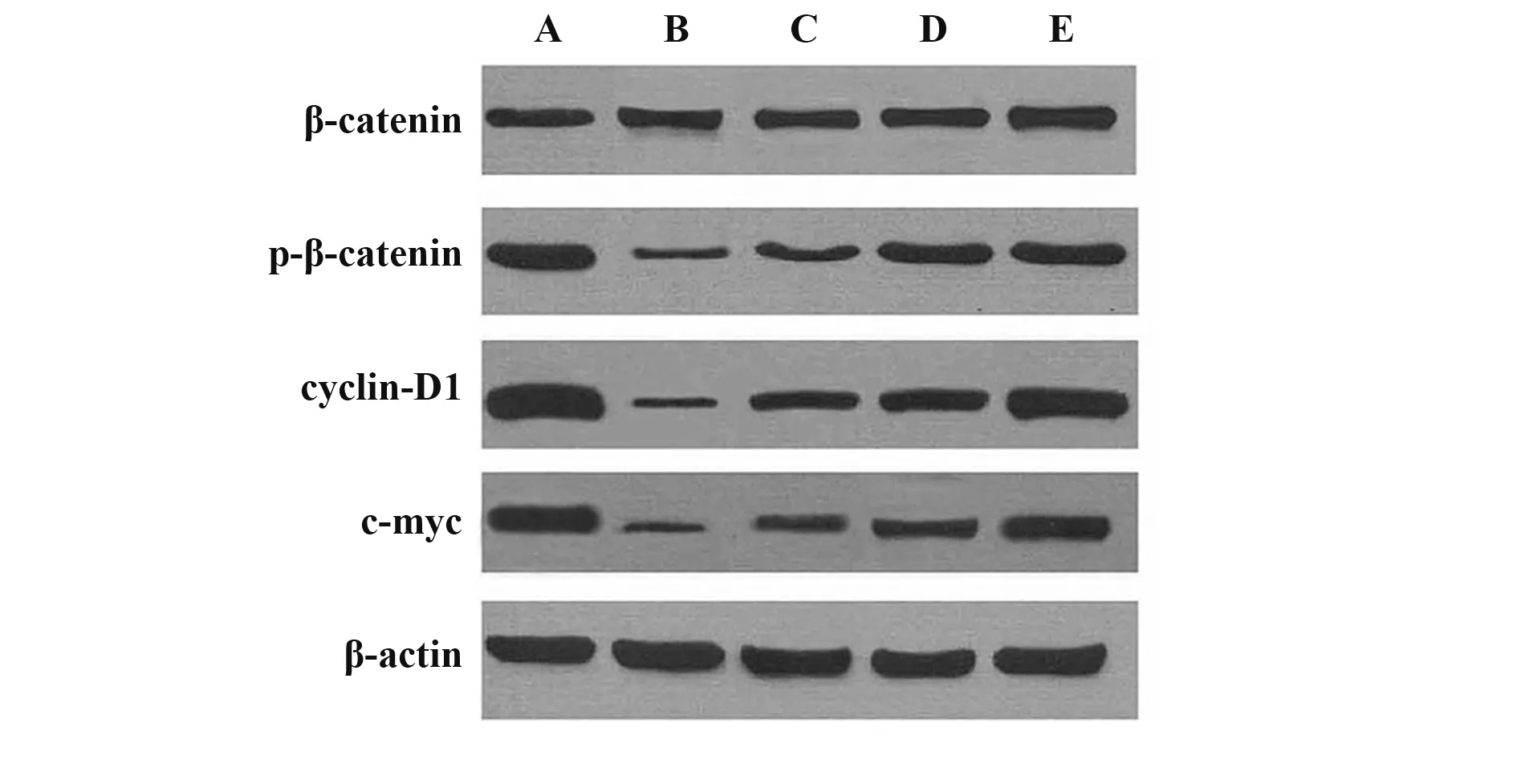
图3 各组Western blot结果Fig.3 Western blot results of each group
表5 各组脑黑质p-β-catenin/β-catenin、cyclin-D1、c-myc蛋白相对表达量比较(,n=5)Tab.5 Comparison of relative expression levels of p-βcatenin/β-catenin,cyclin-D1 and c-myc proteins in substantia nigra in each group(,n=5)
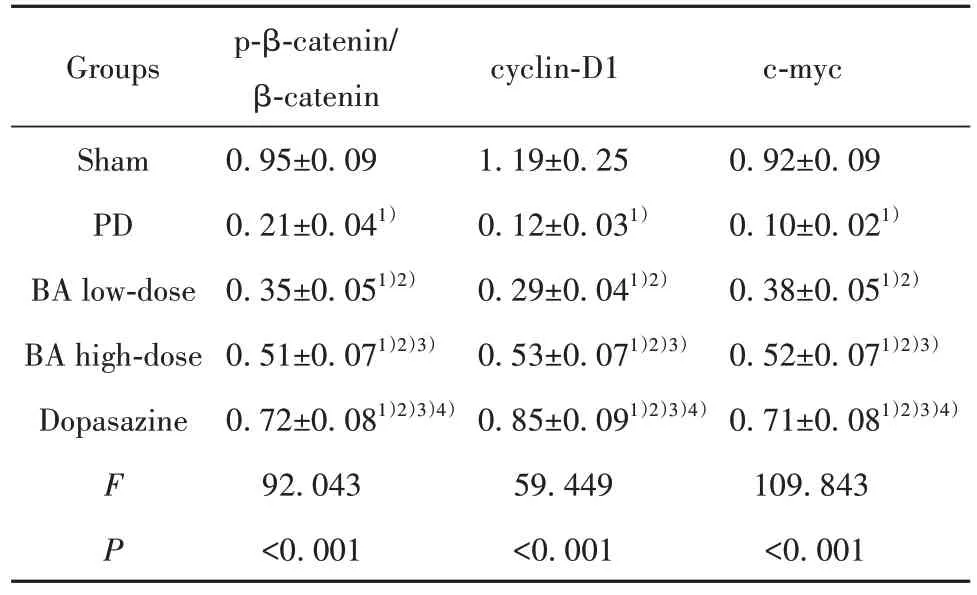
表5 各组脑黑质p-β-catenin/β-catenin、cyclin-D1、c-myc蛋白相对表达量比较(,n=5)Tab.5 Comparison of relative expression levels of p-βcatenin/β-catenin,cyclin-D1 and c-myc proteins in substantia nigra in each group(,n=5)
Note:Compared with Sham group,1)P<0.05;compared with PD group,2)P<0.05;compared with BA low-dose group,3)P<0.05;com⁃pared with BA high-dose group,4)P<0.05.
3 讨论
PD 是脑黑质纹状体通路退变所致的慢性神经退行性疾病,研究认为年龄、家族史、饮食习惯、农业暴露、重金属中毒、头颅创伤史等均是其发生的危险因素[8-9]。目前尚未完全阐明PD 的发病机制,通常认为其与兴奋性毒性、氧化应激、免疫性炎症反应等相关。传统PD 治疗方式以药物干预补充纹状体多巴胺为主,但神经保护作用不明显,且长期使用可发现药物相关性运动障碍及运动波动,导致病情加重。因此,研究具有神经保护作用,且安全可靠的治疗方式对于PD治疗至关重要。
研究显示,PD 存在免疫及炎症反应失调,其中脑部免疫细胞小胶质细胞激活可能参与其神经变性发病过程[10-11]。小胶质细胞在受到外源性刺激时可分泌IL-1β、TNF-α、IL-6 等多种细胞因子,导致神经元损伤及细胞程序性死亡,从而参与神经变性疾病进程。多巴胺能神经元自身具有高水平游离铁离子,铁离子可加快多巴胺能神经元氧化,损伤线粒体功能,参与PD 发病进程。本研究结果显示,PD组、BA低剂量组、BA高剂量组、多巴丝肼组、伪手术组30 min 旋转次数依次减少,脑黑质IL-1β、TNF-α、IL-6、MDA 水平及多巴胺能神经元凋亡依次降低,脑黑质SOD 水平依次升高;伪手术组脑黑质TH 染色结果可观察到细胞及突起丰富,胞体均匀着色,PD组脑黑质多巴胺能神经元细胞数量、残存神经细胞突起显著减少,BA 低剂量组、BA 高剂量组、多巴丝肼组经干预后上述变化有所改善,提示BA 可改善PD 大鼠旋转行为,减轻脑黑质炎症反应,保护氧化损伤,减少脑黑质多巴胺能损伤及神经元凋亡。BA 是黄芩主要的类黄酮提取物之一,具有抗菌、抗病毒、抗炎、保肝、抗氧化、抗凝血、抗血栓形成、抗肿瘤等多种药理功能[12]。BA 主要通过减少炎症介质生成及释放进而发挥抗炎作用。此外,BA是优秀的铁离子螯合剂,作为天然自由基清除剂具有很强的抗氧化作用。既往动物实验发现,对高脂血症大鼠进行BA 灌胃后,可降低其血液炎症因子及氧化应激因子水平,从而使其免受高脂介导损伤[13]。另有研究认为,BA可显著降低人诱导多能干细胞诱导的肝样细胞中MDA 水平,增强SOD 活性,从而减少氧化损伤[14]。
Wnt/β-catenin 信号通路在神经元存活、神经发生及轴突延长中起关键作用,可调节多种细胞生理进程,控制细胞增殖、分化、凋亡等,并参与糖尿病、肿瘤、神经退行性疾病等的发生。研究显示,Wnt/β-catenin 信号通路在PD 患者中枢神经系统中被显著抑制,且有证据提示β-catenin 在细胞中大量累积是该通路活化的关键,β-catenin 自胞浆转至细胞核结合对应基因并激活cyclin-D1、c-myc 等下游基因表达,增加神经元株存活数量[15-16]。Wnt/β-catenin信号通路减少凋亡的作用主要通过调节β-catenin表达及其磷酸化作用实现。AKIEDA 等[17]认为,在β-catenin 发生突变的胚胎中,敲除β-catenin 可导致神经嵴细胞、感觉神经元、背后侧神经元凋亡增加。本研究结果中,PD组、BA低剂量组、BA高剂量组、多巴丝肼组、伪手术组p-β-catenin/β-catenin,cyclin-D1、c-myc 蛋白相对表达量依次升高,提示BA 可能通过激活Wnt/β-catenin 信号通路发挥改善PD 大鼠旋转行为、减轻炎症反应及氧化损伤,保护脑黑质多巴胺能神经元的功能。
综上所述,BA可改善PD大鼠旋转行为,减轻脑黑质炎症反应及氧化损伤,减少脑黑质多巴胺能损伤及神经元凋亡,推测其作用机制与激活Wnt/β-catenin 信号通路有关,为BA 相关药物的研发及应用于PD的临床治疗提供理论支持。