网络药理学方法预测附子-熟地黄配伍治疗COPD 作用机制以及初步验证研究①
2022-03-22位佳琳赵东凯初洪波长春中医药大学药学院长春130117
汪 景 位佳琳 何 蕊 赵东凯 初洪波 位 鸿(长春中医药大学药学院,长春 130117)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是持续性的呼吸系统症状和不完全可逆性气流受限,中医属“肺胀”范畴。临床表现以“胀、喘、咳、痰”等症为主,随病情发展症状逐渐加重,严重影响患者运动能力和生存质量。COPD 的发病机制尚未完全明了,目前研究表明,气道、肺实质和肺血管的慢性炎症反应、肺部的蛋白酶和抗蛋白酶失衡、氧化与抗氧化失衡以及自主神经系统紊乱等参与COPD的发生[1-3]。
我国传统医学在治疗COPD 的过程中取得了不错的效果,特别是在缓解临床症状、改善预后等方面尤为突出[4]。吉林省名中医王檀教授的临床经验方“温肺消胀”可明显改善COPD的症状,延缓COPD的进展[5]。在中医治疗疾病的过程中,药物之间不同的配伍可以起到不同的治疗作用[6],药对是最简单的配伍,只含两味药。“附子-熟地黄”为温肺消胀方中的君药,组方原则源于阴阳学说,以附子、熟地黄阴阳同补,以阳化阴,以阴涵阳,温肾以助元阳,滋阴以填肾精。而在肺胀病中,以肺肾关系为要,“附子-熟地黄”以补肾精而达到缓解治疗肺胀的目的。
中药对“附子-熟地黄”中的确切活性成分及其治疗COPD 的机制尚不清楚。本研究旨在分析FZSD 治疗COPD 的有效成分及初步探索可能的作用机制,为治疗COPD提供更多的临床理论依据。
1 材料与方法
1.1 材料 附子(Aconitum carmichaeli Debx.)、熟地黄(Rehmannia glutinosa Libosch.)经长春中医药大学肖井雷教授鉴定均符合规定;乙腈为色谱纯(美国Thermo Fisher Scientific 公司);水为超纯水(实验室自制);高效液相质谱-飞行质谱联用仪(Agilent,美国);人肺泡上皮细胞A549细胞(中国科学院上海细胞生物研究所细胞库,中国);胎牛血清(Clark,美国);DMEM 培养基(Gibco,美国);青链霉素双抗(定州百克赛斯生物科技有限公司,中国);CCK-8 工作液(大连美仑生物技术有限公司,中国);脂多糖(上海懋康生物科技有限公司,中国);TNF-α、IL-17 ELISA 试剂盒(人源)(黄石研科,中国);抗体AKT1、MAPK8、羊抗兔IgG(索莱宝,英国);CO2培养箱、酶联免疫检测仪(Thermo Fisher Scientific,美国);TC20细胞计数仪(Bio-Rad,美国);可视相差倒置显微镜(奥林普斯,日本)。
1.2 方法
1.2.1 活性成分及作用靶点的筛选 通过TCMSP数据库将附子、熟地黄所有的化学成分和药物靶点进行筛选,类药性(DL)≥0.18、口服生物利用度(OB)≥30%为条件筛选出其主要活性成分及药物靶点。以“chronic obstructive pulmonary disease”为关键词,从Gene cards 数据库查找COPD 的疾病靶点,并以相关性得分(relevance score≥10)作为条件筛选出疾病靶点。
1.2.2 蛋白质与蛋白质相互作用关系网络图(PPI)的构建 将药物与COPD 的交集基因导入STRING数据库获取蛋白之间的结合度数据,并将数据导入Cytoscape 3.7.2实现可视化。
1.2.3 基因本体(GO)功能、京都基因与基因组百科全书(KEGG)通路分析 使用DAVID 6.8 数据库对药物治疗COPD的靶点进行GO、KEGG分析,借助R语言对两者结果进行可视化处理。
1.2.4 “疾病-成分-靶点-通路”的网络构建 将筛选后的数据导入Cytoscape 3.7.2 构建疾病-成分-靶点-通路网络图,以说明FZSD通过多通路、多靶点来发挥治疗COPD的作用机制。
1.2.5 供试品的制备 根据吉林省名中医王檀教授的院内制剂“温肺消胀方”的临床用法用量,称取附子10 g、熟地黄20 g,先以蒸馏水浸泡30 min,加入10 倍量的水,先以武火煮沸后再以文火煎煮1 h,煎煮两次,将两次的煎煮液合并过滤得水煎液,冷冻干燥,得冻干粉。精密量取冻干粉0.2 g,加入50%甲醇8 ml,至10 ml 容量瓶中超声30 min 后,用50%甲醇定容至刻度,摇匀,过0.22 μm 滤膜,得供试品溶液。
1.2.6 色谱及质谱条件 检测色谱条件:色谱柱(OOD-4475-ANC18,2.1×100 mm,1.7 μm);流动相乙腈(A)-水(B),如表1进行梯度洗脱;流速0.3 ml/min;进样量5 μl,柱温室温。
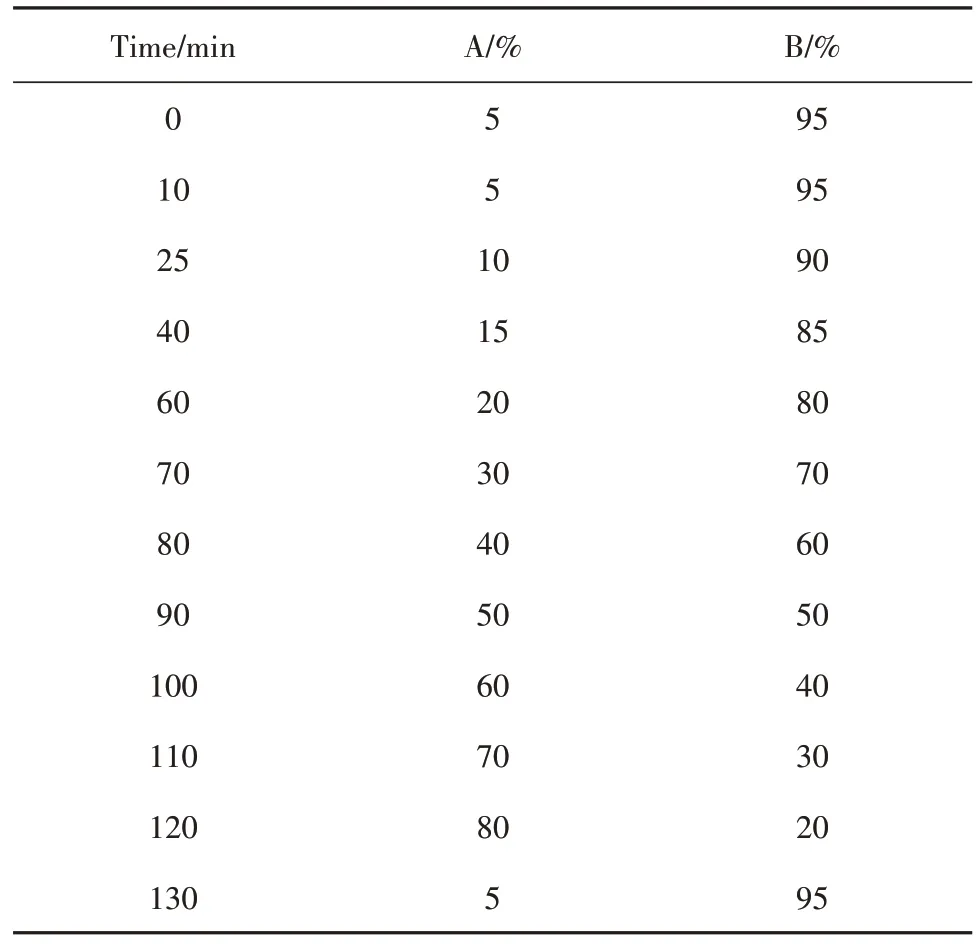
表1 液相梯度Tab.1 UPLC gradient elution
质谱条件:使用Agilent 6540 Q-TOF LC/MS系统(Agilent Technologies,Santa Clara,CA,United States)进行质谱分析,ESI源,扫描方式ESI+模式。界面的操作条件如下:正/负电离模式;喷雾电压3.8 kV;干燥气体流速10.0 L/min;气体温度350℃;流速0.3 ml/min;全扫描范围为50~1 000 m/z。
在网络药理学筛选出活性成分的基础上,建立FZSD 筛选出的化合物的分子离子数据库[7],在分析供试品数据的时候,利用建立的数据库进行靶向提取,在相对误差<10 ppm 的条件下,确认目标化合物。
1.2.7 细胞培养 从液氮罐中取出存有A549 细胞的冻存管,于37℃恒温水浴中轻轻摇动2~3 min使其迅速融化,在紫外消毒的超净台内操作,将细胞悬液加入完全培养基(含10%胎牛血清、1%青霉素/链霉素双抗的DMEM 培养基)中;1 000 r/min 离心5 min 后弃除上清,再用5 ml DMEM 完全培养基悬浮细胞,加入培养皿中于37℃、5%CO2培养箱中培养过夜。次日进行常规换液,观察细胞生长状态,细胞生长密度至70%~80%使用胰酶消化传代培养扩增。
1.2.8 CCK-8 法检测细胞增殖活力 在96 孔板内铺A549 细胞悬液8 000 个/孔,将培养板置于培养箱内培养24 h 后,给予不同浓度的FZSD 对其干预,观察细胞增殖状态。将细胞分成3组,对照组:完全培养基+细胞;空白组:完全培养基;FZ-SD 组:FZ-SD(31.25、62.5、125、250、500、1 000 μg/ml)干预24 h。3组处理后,每孔加入CCK-8工作液10 μl,继续在培养箱中孵育1 h,使用酶标仪在波长450 nm 下检测各孔吸光度(OD)值,计算各组细胞存活率。
1.2.9 ELISA 法检测A549 细胞中TNF-α 和IL-17的表达 酶联免疫吸附试验检测培养上清液中TNF-α和IL-17的水平。A549细胞在6孔板中孵育,用FZSD预孵育24 h,分别用LPS(50 μg/ml)刺激24 h后,收集培养上清液。3 000 r/min 离心20 min,收集上清液检测蛋白水平并进行分析。
1.2.10 蛋白免疫印迹法检测A549 细胞中MAPK8和AKT1 蛋白表达 收集A549 细胞样品,并将细胞裂解液加入到A549 细胞中,4℃超声裂解5 次,12 000 r/min离心10 min取上清;按照BCA蛋白定量试剂盒进行蛋白定量,经凝胶电泳转膜封闭后,按照说明书配制相应浓度的一抗稀释液,4℃摇床过夜;再用TBST 溶液清洗5 次,5 min/次,加入终浓度1∶5 000 的二抗稀释液,室温摇晃1 h,再用TBST 溶液清洗5 次,5 min/次;最后使用凝胶成像系统进行发光显色,拍照记录条带。
2 结果
2.1 COPD 靶点分析结果 通过对TCMSP 数据库的检索可得到:附子的所有成分65 种,主要为生物碱类成分,相关的药物靶点139个;熟地黄的所有成分76种,主要成分为环烯醚萜、单萜类及其苷类,相关的药物靶点327 个。通过对Gene Cards 数据库的检索可得到COPD 的相关靶点有6 843 个,以Rele⁃vance score≥10 为筛选条件,得到COPD 相关靶点3 868个。将药物成分靶点和疾病的靶点做韦恩图,得到两者的交集靶点81个,如图1A所示。
2.2 PPI 网络的构建及核心靶标的筛选 将81 个交集靶点导入到STRING 数据库,进行蛋白质互作网络分析,根据置信度>0.9,初步筛选出关键蛋白后,将数据导入Cytoscape 3.7.2 中,使用Network 中的Analyzer 插件对网络图的拓扑性质进行分析,其中节点的面积越大,颜色越深,表示degree 值越大,与其相关的靶点蛋白越多,结果如图1B 所示,MAPK8、NCOA1、AKT1、NR3C1、NCOA2、PPARG、FOS、IL-6、ESR1蛋白degree值较大。
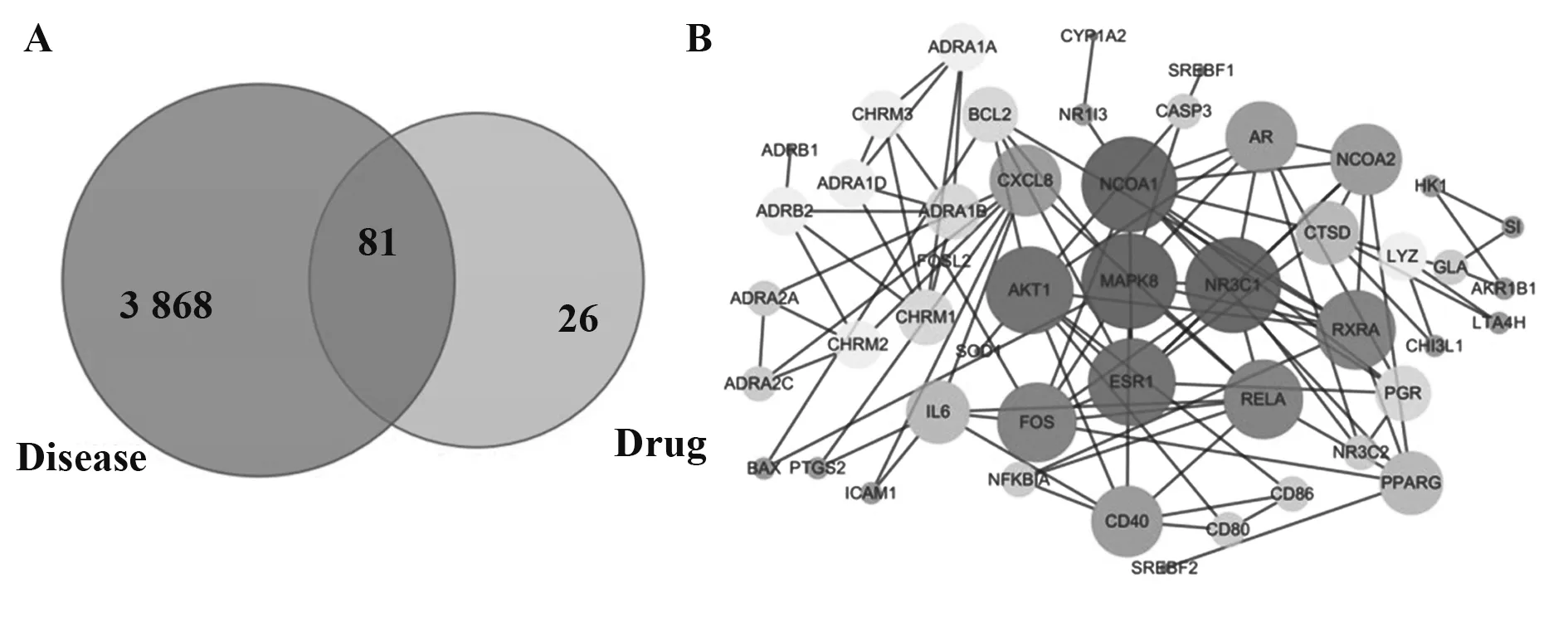
图1 FZSD治疗COPD的网络药理学结果分析图Fig.1 Analysis of network pharmacology results of FZSD in treatment of COPD
2.3 GO、KEGG 分析 通过GO 数据库分析,如图2A 所示,对FZSD 水煎液中的49 个核心靶标进行GO 富集分析,筛选P<0.05 的数据,并选出前20 条结果做以下分析,图中数量值的大小表示在该生物功能中富集的靶蛋白数量,数量值越大则说明富集的靶标数越多,P值越小代表相关性越强。GO 富集分析结果表明,核心靶标主要涉及炎症、细胞凋亡、癌症等。核心靶标主要参与蛋白酶活性、酶结合和蛋白结合等途径。其中相关性较强的为G蛋白偶联受体信号通路、肾上腺素受体活性、核受体活性、配体激活的转录因子活性、类固醇激素受体活性、神经递质受体活性、突触后神经递质受体活性等生物功能。
利用DAVID 数据库分析,如图2B 所示,对FZSD 水煎液中的49 个核心靶标进行KEGG 通路富集分析,筛选P<0.05 的数据,并选出前20 条结果做以下分析,图中数量值的大小表示在该条通路富集的靶标数,数量值越大则说明富集的靶标数越多;P值表示该通路与COPD 的相关强弱,值越小代表相关性越强。KEGG 通路富集分析表明,与这些靶标关联最为密切的有脂质与动脉粥样硬化、糖尿病并发症中的晚期糖基化终末产物-糖基化终末产物受体(AGE-RAGE)信号通路、Toll 样受体信号通路、非酒精性脂肪肝(NAFLD)、神经活性配体-受体相互作用、肿瘤坏死因子(TNF)信号通路、小细胞肺癌、IL-17 信号通路、细胞凋亡、NF-κB 信号通路、环腺苷酸信号途径、雌激素信号通路等。
2.4 “疾病-成分-靶点-通路”的网络图分析 筛选得到化学成分、靶点及其相应信号通路,具体如图3所示。将编辑好的化合物、靶点、信号通路Network及相对应的Type 导入Cytoscape 3.7.2 构建网络通路图。从内到外分别为最内层菱形为慢性阻塞性肺疾病,第二层三角形为通路,第三层三角形为化学成分,最外层三角形为靶点。由图可直观看出,连接10 个以上交集靶点的成分为Benzoylmesaconine、Salsolinol、Acetylcatalpol、Sitogluside、Succinic acid、Lauric acid、TMPEA、Sucrose、Stigmasterol,Deltoin 连接7 个交集靶点Arachic acid 连接8 个交集靶点,其余成分连接2 个及以上交集靶点,这些成分可能是FZSD 治疗COPD 的活性成分。MAPK8、PTGS1、PTGS2、NCOA2、AKT1、IL-6 连接的活性成分较多,且和通路密切相关,可能为治疗COPD的核心靶点。
2.5 FZSD化学成分结果分析 为了进一步确认基于网络药理学预测FZSD 水煎液中对COPD 有治疗作用的活性成分,采用LC-MS 对FZSD 水煎液中的化学成分进行验证。结果如图3、表2所示。正谱负谱的总离子流图以及确认的化合物棒状图和化合物结构式,见附图1、附图2(http://www.immune99.com)。表2为正谱以及负谱数据库中鉴定出来的化学成分,其中包括其出峰时间、化学名称、分子式、相对分子量以及加合物的相对分子质量。通过与化学数据库的比对,共鉴别出15 种化学成分,与网络药理学中预测的相关成分有8 种,附子中的成分有:(R)-Norcoclaurine、Benzoylmesaconine、Glutin⁃oside、Deltoin;熟地黄中的成分有:Sitosterol、Pen⁃tadecylic acid、Acetylcatalpol、Arachic acid。
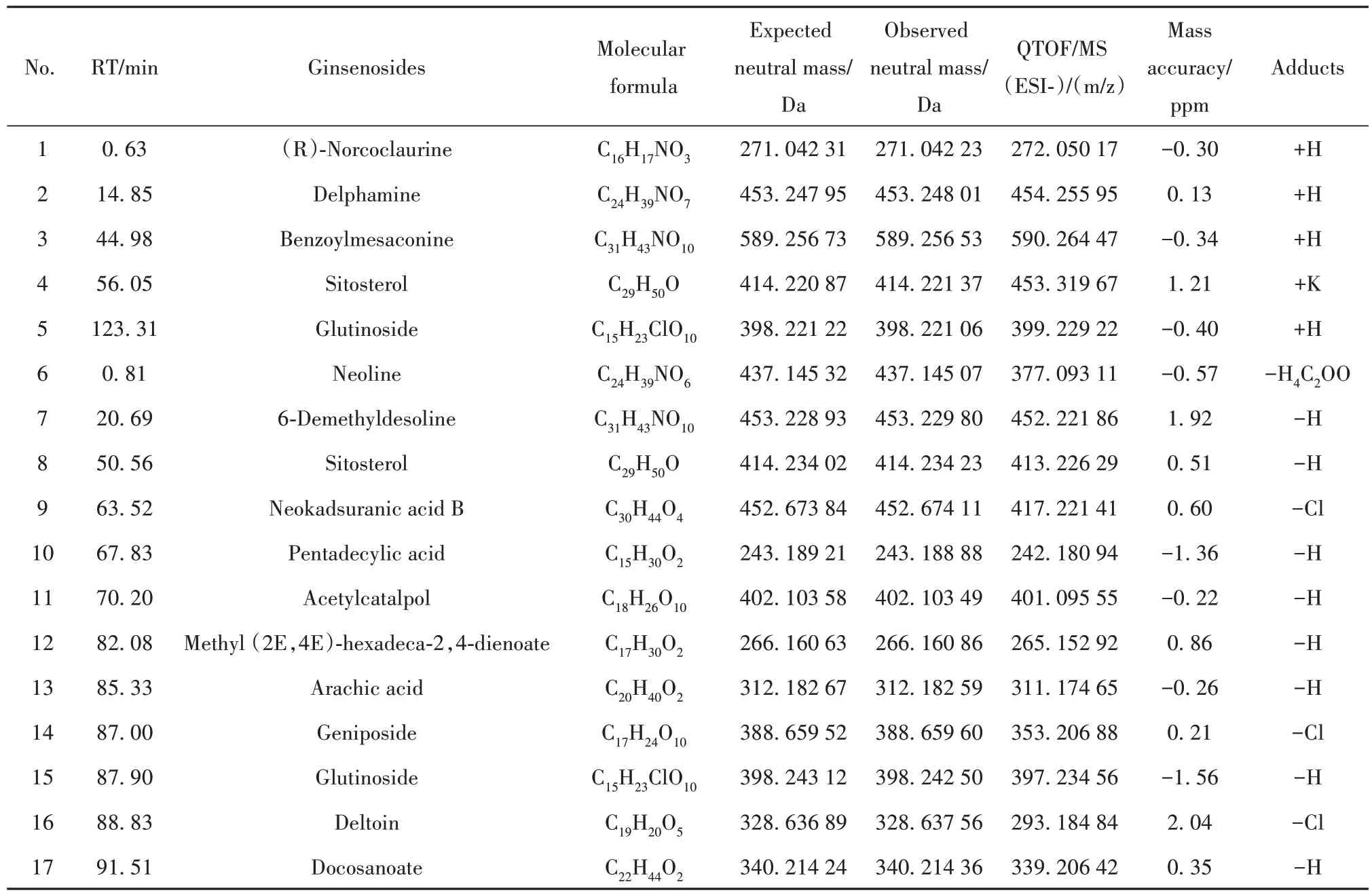
表2 FZSD水煎液质谱化学成分的UPLC-Q-TOF-MS/MS 鉴定结果Tab.2 UPLC-Q-TOF-MS/MS identification results of chemical components of FZSD decoction mass spectrometry
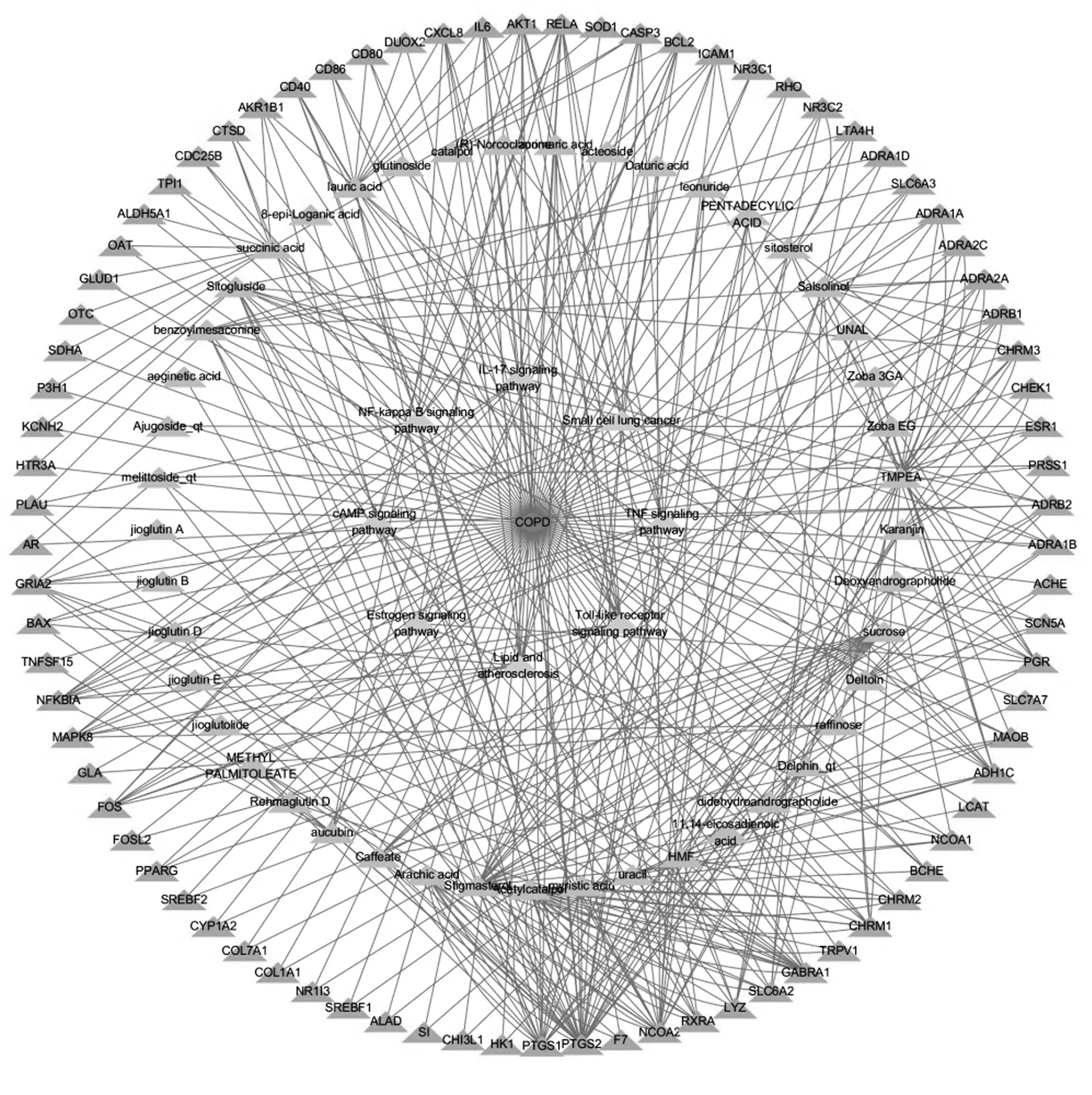
图3 “疾病-成分-靶点-通路”的网络图Fig.3 "Disease-component-target-pathway"network diagram
2.6 FZSD的细胞毒性 为了选择合适的浓度用于后续实验,本研究采用CCK-8 法检测FZSD 对A549细胞的毒性。用含有不同浓度的FZSD 培养基培养A549细胞,24 h后用CCK8检测细胞活力,结果如图4所示。当用31.25、62.5、125 μg/ml的FZSD处理细胞时,促进细胞增殖;当用125、250、500 μg/ml的FZSD处理细胞时,细胞活力没有显著变化;1 000 μg/ml时有显著毒性,因此,选择了31.25、62.5和125 μg/ml进行后续实验。
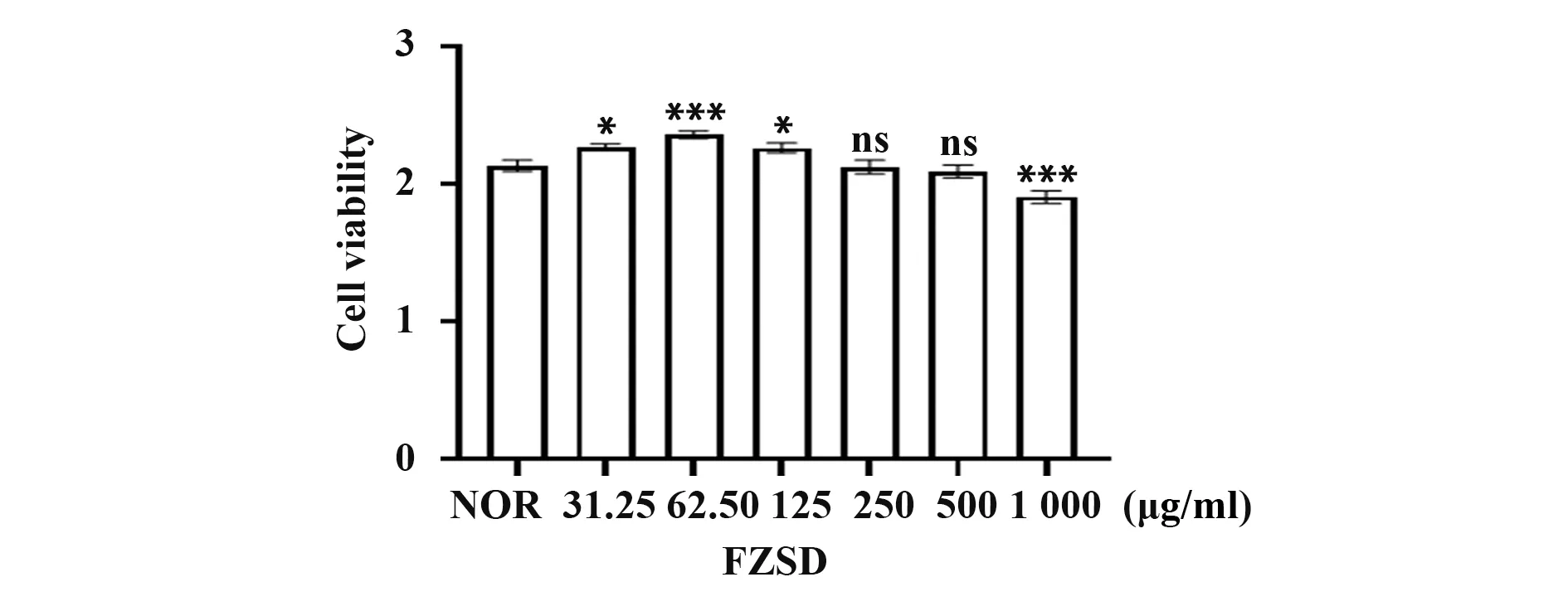
图4 不同浓度FZSD对细胞活力值的影响Fig.4 Effect of FZSD decoction of different concentrations on cell viability
2.7 FZSD 抑制促炎细胞因子的表达 根据结果2.3 可知,FZSD 与TNF-α 信号通路和IL-17 信号通路有关,故采用ELISA 法测定细胞炎症因子证实了网络药理学的预测,即FZSD 通过抑制炎症因子释放来达到治疗COPD 的目的。结果如图5 所示,在A549 细胞中,模型组与空白组相比,A549 细胞在LPS 的刺激下,能显著增加TNF-α 和IL-17 的表达。药物组与模型组相比,随着FZSD 在LPS 诱导的A549 细胞中孵育,培养上清液中TNF-α 和IL-17 的蛋白表达呈显著降低,鉴于以上研究结果,表明FZSD可以有效下调TNF-α和IL-17的水平。
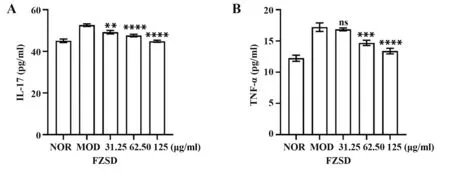
图5 FZSD对IL-17、TNF-α表达水平的影响Fig.5 Effects of FZSD on expression levels of IL-17 and TNF-α
2.8 FZSD 对MAPK8、AKT1 蛋白表达的影响 根据结果2.4 可知,MAPK8、AKT1 连接的活性成分较多,且和通路密切相关,可能为治疗COPD 的核心靶点。采用Western blot 法检测A549 细胞中MAPK8、AKT1 蛋白的变化,与对照组相比,模型组细胞MAPK8、AKT1蛋白表达明显上升(P<0.05);与模型组比较,FZSD低中高剂量组(31.25 μg/ml、62.5 μg/ml、125 μg/ml)细胞中AKT1蛋白表达有下降趋势,MAPK8 蛋白表达呈剂量依赖性下降(P<0.05),见图6。
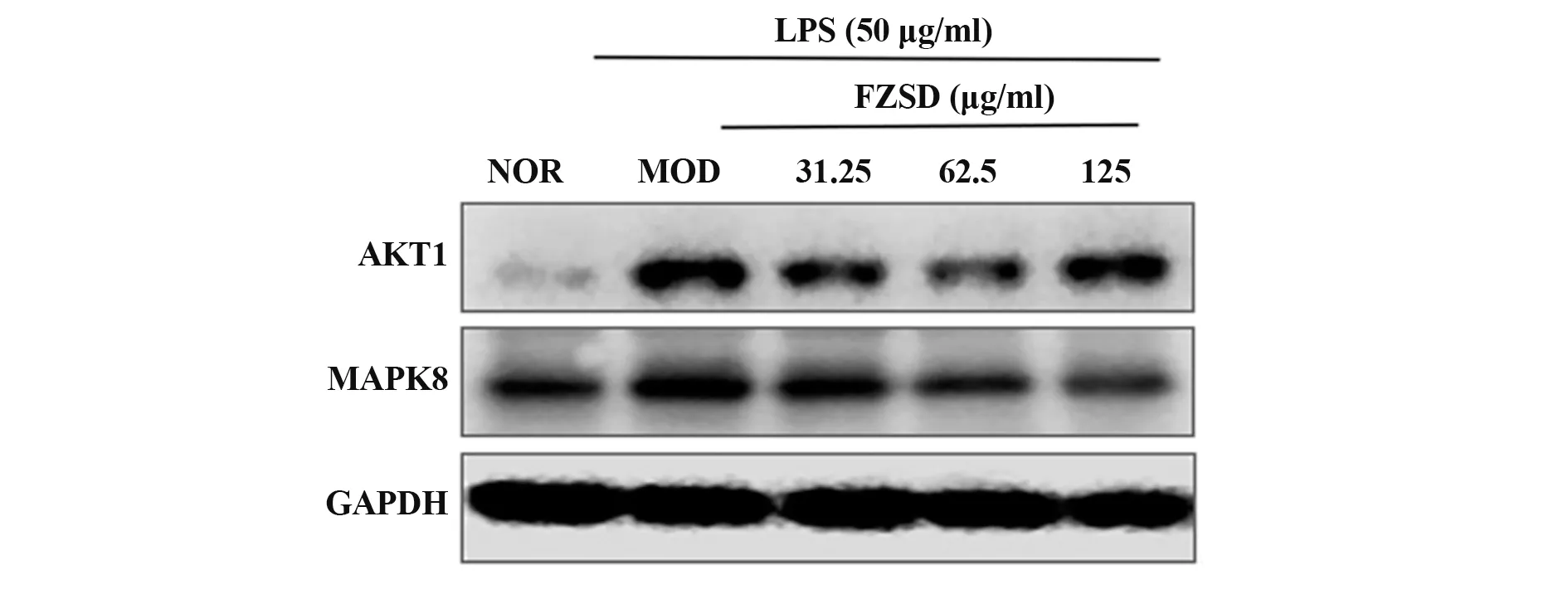
图6 FZSD对MAPK8、AKT1表达水平的影响Fig.6 Effects of FZSD on expression levels of MAPK8,AKT1
3 讨论
COPD 是呼吸内科常见病之一,具有较高的患病率及致死率,患者通常伴有不完全可逆性气流受限的现象,并且此现象呈进行性进展,其实质是发生在气道、肺血管和肺泡的一种慢性炎症。临床应用表明,温肺消胀方可以有效缓解COPD 患者“胀、喘、咳、痰”的症状,从而达到缓解COPD 的发展进程。附子和熟地黄这两味药在温肺消胀方中,其组方原则为“行温补肺肾,逐饮化瘀之效”。虽有临床使用可证明FZSD 可治疗COPD,但其潜在的作用机制尚不明确,因此研究探索FZSD 治疗COPD 的潜在作用机制。
本研究用网络药理学来预测FZSD 治疗COPD的物质基础和作用机制[8]。网络药理学中共筛选出45种活性成分和81种药物与疾病的交集靶标蛋白,其中附子的生物碱类成分(R)-Norcoclaurine、Benzoylmesaconine、熟地黄的Sitosterol 和环烯醚萜类成分Acetylcatalpol 连接最多的靶点蛋白为MAPK8、PTGS1、PTGS2、NCOA2、AKT1、IL-6,因此预测这些化合物为FZSD 治疗COPD 的主要成分,这些靶点为治疗COPD 的核心靶点。通过PPI 网络拓扑进行分析,其中与COPD 疾病相关性显著的靶点蛋白是MAPK8、NCOA1、AKT1、NR3C1、NCOA2、PPARG、FOS、IL-6、ESR1等。HOU 等[9]通过体内和体外实验发现,MAPK8 信号通路是COPD 的潜在治疗靶点。有研究表明,AKT1 和IL-6 等蛋白靶点可通过参与PI3K-Akt 信号通路和MAPK 信号通路,预防COPD的病程进一步发展[10]。DASTAN 等[11]临床试验在对急性加重COPD 患者的常规治疗过程中,通过抑制IL-6、TNF-α 蛋白的表达使全身炎症得到显著缓解。由此可推测,FZSD 中的有效成分可能通过MAPK8、AKT1、TNF-α 等靶点蛋白参与相关的信号通路来发挥治疗COPD的作用。
在GO 和KEGG 信号通路分析中,FZSD 治疗COPD 密切相关的有TNF-α、IL-17、Toll 样受体和NF-κB 信号通路等。有文献报道,在外界环境的刺激下,气道上皮细胞和肺泡巨噬细胞会释放TNF-α、白细胞介素等多种炎症因子,诱导炎症反应从而引起COPD 的发生[12-13]。TNF-α 相关的病理机制在COPD 的病理中起着关键作用,其通过加剧炎症细胞的募集、炎症介质的产生以及气道氧化来放大气道炎症[14-16]。由以上文献可知,抑制TNF-α 蛋白表达是治疗COPD 的重要途径。MAMMEN 等[17]发现IL-17 调节相关蛋白基因表达,导致COPD 中黏液高分泌和持续气道炎症。并且有研究表明,在肺上皮细胞系A549中,抑制IL-17蛋白表达水平,可导致气道上皮中黏蛋白表达增加,从而起到抑制COPD 炎症反应的作用[18-20]。由此可预测,FZSD 治疗COPD可能通过调控TNF-α和IL-17信号通路。
由上述网络药理学方法中的推测可得知,FZSD复方中的关键成分可通过调控MAPK8、AKT1、TNF-α等靶点蛋白调控TNF-α、IL-17 信号通路来发挥治疗COPD 的作用。质谱分析结果与上述网络药理学中预测一致,确定FZSD起治疗作用的关键成分有8个(如表2 所示),它们分别是(R)-Norcoclaurine、Benzoylmesaconine、Sitosterol、Pentadecylic acid、Arachic acid、Acetylcatalpol、Glutinoside、Deltoin(如图3所示)。相关研究表明,(R)-Norcoclaurine 可通过抑制AKT1 蛋白的表达来发挥抗炎等作用,而AKT1 蛋白的分泌正是导致COPD 进一步恶化的关键 原因[21-24]。Benzoylmesaconine 是附 子中 的生 物碱,它可通过其抗炎活性对LPS 诱导的大鼠急性肺损伤表现出有效的保护作用[25-26]。Sitosterol 可用于治疗肺组织的病理变化和预防气道炎症,显著抑制炎症反应[27]。研究表明,Acetylcatalpol 具有抗炎、抗氧化等作用,可明显降低TNF-α 蛋白表达[28-29]。由以上文献可进一步说明,FZSD 对COPD 发挥主要作用的化学成分可通过调控相关的靶点蛋白和信号通路来达到治疗目的。
为了进一步验证网络药理学的推测,本文采用了体外细胞实验研究。ELISA 和Western blot 实验结果表明FZSD 能够下调TNF-α、IL-17、MAPK8、AKT1 蛋白的表达水平来调控TNF-α、IL-17 信号通路,抑制COPD 炎症细胞的增殖、生长、分化,促进炎症细胞凋亡,从而起到抑制COPD 进一步发展的作用[30-32]。研究表明,MAPK8 蛋白的激活会诱导肺自噬,促进肺细胞凋亡和COPD 的发生[33]。因 此MAPK8 蛋白表达的降低可以抑制COPD 的进一步发展,达到缓解和治疗的作用。体外细胞实验证实FZSD 对COPD 有治疗作用这一预测,阐明了FZSD起作用的关键成分通过下调TNF-α、IL-17、MAPK8、AKT1 蛋白的表达调控TNF-α、IL-17 信号通路这一作用机制。
综上所述,本研究通过网络药理学对FZSD 治疗COPD 的作用靶点及作用机制进行预测。运用UPLC-Q-TOF-MS/MS 发现FZSD 水煎液中的8 种活性成分,并与网络药理学中的成分相对应。通过体外细胞实验验证网络药理学中的作用机制,说明FZSD 能通过抑制TNF-α、IL-17、MAPK8、AKT1 蛋白的表达水平减轻COPD 的损伤。本研究只进行了基础的体外细胞实验验证,存在一定的局限性,在后续的实验过程中会进一步进行体内动物实验和临床验证。本文的内容为进一步深入研究FZSD 治疗COPD 的机制提供了思路,为临床应用提供理论依据。