抗烟草疫霉活性木霉与芽孢杆菌共培养体系的构建与优化
2022-03-21张希芬林伟李清钰刘荣欣刘建阳王美丁应福赵栋霖张成省
张希芬 林伟 李清钰 刘荣欣 刘建阳 王美 丁应福 赵栋霖 张成省




摘 要:為减轻化学药剂防治烟草疫霉带来的弊端,提高生防菌剂效果,通过琼脂糖扩散法筛选抗性木霉并构建木霉和枯草芽孢杆菌Tpb55共培养体系,采用菌丝生长速率法评价了种间互作防治烟草疫霉的效果,利用单因素法优化共培养体系的培养基成分和发酵条件,并通过盆栽试验验证其对烟草黑胫病的防治效果。结果表明,棘孢木霉HG1具有良好的抗烟草疫霉活性,与枯草芽孢杆菌Tpb55的共培养体系如下:HG1(106 CFU/mL)接种量为2%,与Tpb55(106 CFU/mL)接种比例为10∶1,采用序列共培养方式,即先接种HG1,24 h后接种Tpb55。优化后的最适培养基成分为木糖10 g/L,蛋白胨和酵母粉(质量比为2∶1)5 g/L;最佳发酵为温度25 ℃,初始pH 7.5,转速140 r/min。共培养发酵液盆栽防病效果显著优于单培养,防治效果达到74.72%。该体系发酵后能够明显提升两株生防菌抑制烟草疫霉的活性,并对烟草黑胫病具有显著防病效果,为后续多菌株共发酵生防菌剂的开发提供基础。
关键词:棘孢木霉;枯草芽孢杆菌;烟草疫霉;共培养;发酵条件
Abstract: In order to reduce the disadvantages of chemical control of Phytophthora nicotianae and improve the effect of biocontrol agents, Trichoderma asperellum HG1 with obvious anti-Phytophthora nicotianae activity was obtained by the agarose diffusion method and the a co-culture system of Trichoderma asperellum HG1 and Bacillus subtilis Tpb55 was constructed to evaluate the inhibition effect of interspecific interaction against Phytophthora nicotianae by the mycelial growth rate method. The composition of medium media and fermentation conditions were optimized by single factor experiment. The control effects of co-culture and single-culture fermentation liquors of Trichoderma asperellum HG1 and Bacillus subtilis Tpb55 on tobacco black shank were compared by pot experiments. The suitable co-culture system was determined as follows: the inoculation ratio of HG1 (106 CFU/mL) and Tpb55 (106 CFU/mL) was 10:1. Sequential inoculation was adopted as HG1 was inoculated first, and Tpb55 was inoculated after 24 h. The fermentation broth composition and culture conditions of the co-culture system were optimized by single factor method, guiding by the inhibition rate of Phytophthora nicotianae. The optimum medium composition was determined as follows: xylose 10 g/L, peptone and yeast powder (the mass ratio was 2:1) 5 g/L; The optimal fermentation conditions were as follows: temperature 25 ℃, initial pH 7.5, rotating speed 140 r/min. The disease control effect of co-culture fermentation liquors in pot experiments was 74.72%, which was significantly better than that of single-culture. The system could significantly improve the inhibition activity of the two biocontrol strains against Phytophthora nicotianae, and the fermentation liquors of the system had significant disease control effect on tobacco black shank, which provides a basis for the development of subsequent multi strain co-culture biocontrol agents.
Keywords: Trichoderma asperellum; Bacillus subtilis; Phytophthora nicotianae; co-culture; fermentation conditions
烟草疫霉(Phytophthora nicotianae)是一种危害严重的病原卵菌,其引起的烟草黑胫病每年对各地烟叶生产造成极大损失[1-3]。目前仍以化学防治为主,存在农药残留、环境污染、病菌抗药性等问题[4-6]。生物防治因其成本低、环境友好、无药物残留等优点成为植物土传病害防治领域的研究热点[7-8]。目前已有较多关于木霉、芽孢杆菌等生防菌株对烟草黑胫病防治效果的报道。
李小杰等[9]筛选出3株木霉菌对烟草疫霉具有较强抑制作用,且对烟草黑胫病均具有较好室内防效,其中近渐绿木霉(Trichoderma paraviridescens)XYLS-5对烟草黑胫病防效达80%以上。宋玉娟等[10]研究表明棘孢木霉T-6在温室盆栽条件下对烟草黑胫病和根黑腐病的防治效果分别达到74.45%和75.14%,具有良好应用潜力。LIN等[11]发现内生淀粉样芽孢杆菌BA01可以显著降低马铃薯赤霉病的发生率。何明川等[12]在美洲大蠊肠道中分离得到一株枯草芽孢杆菌(Bacillus subtilis)MC4-2菌株,室内盆栽试验结果表明其对烟草黑胫病防效达到63.86%。陆新莉等[13]从健康烟草根际土壤中分离出5株对黑胫病菌具有较强拮抗作用的根际细菌,而田间防效中对黑胫病防效最好的菌株YWGJ07初步鉴定为芽孢杆菌属。
然而,单一菌株存在定殖不稳定等问题,而混合菌株的共同培养可以提高抑制病原体的活性,并扩大环境适应性[14-16]。利用多种微生物防治植物病害是提高生物防治效果的有效方法。丛韫喆[17]发现拟康氏木霉(Trichoderma pseudokoningii)与黑根霉(Rhizopus nigricans)混合发酵液的施用可以在土壤中建立新的微生物生态平衡,改善土壤的理化生性状,对病害防治效果明显。李兆防[18]发现球毛壳(Chaetomium globosum)ND35、哈茨木霉(Trichoderma harzianum)T88和深绿木霉(T. atroviride)T95两两混合菌株对立枯病和根腐病的防治效果都高于单一拮抗菌。
本研究筛选了一株具有显著抗烟草疫霉活性的木霉,与本课题组前期筛选出的一株抗烟草疫霉的枯草芽孢杆菌Tpb55进行共培养,以对烟草疫霉的抑制率为标准,建立合适的培养体系后进行单因素优化试验,并利用发酵液进行烟草黑胫病盆栽试验,以验证其防病效果。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 木霉分离自海南红树林样品,共23株,通过分子生物学及形态学方法进行鉴定;枯草芽孢杆菌Tpb55分离自烟草叶面生境[19]。病原菌为烟草疫霉JM01菌株,分离自烟草黑胫病株[20]。以上菌株均采用甘油保存法(50%甘油∶马铃薯葡萄糖水培养基=1∶1)保存于中国农业科学院烟草研究所海洋农业研究中心。
1.1.2 活化培养基 马铃薯葡萄糖琼脂(PDA)培养基[21]、营养肉汤(NB)培养基[22]、营养琼脂(NA)培养基[22]、燕麦(OA)培养基[23]、LA培养基[23],均购自北京索莱宝科技有限公司。
1.1.3 优化培养基 GPYE(改良葡萄糖蛋白胨酵母粉培养基)[24]:葡萄糖10 g/L,蛋白胨2 g/L,酵母粉1 g/L,其余为蒸馏水,调节pH=7。Czapek-Dox(察氏培养基)[25]、PDW(马铃薯葡萄糖水培养基)[23]、LB肉汤[23],购自北京索莱宝科技有限公司。
1.2 菌株种子液制备
1.2.1 木霉孢子悬浮液制备 木霉在PDA培养基上28 ℃培养5 d,以无菌水冲洗孢子,血球计数板测定孢子悬浮液浓度,并用无菌水将浓度调整至106 CFU/mL备用。
1.2.2 枯草芽孢杆菌Tpb55种子液制备 枯草芽孢杆菌Tpb55菌液在LA培养基上活化,挑取单菌落于LB培养基中培养过夜即得到Tpb55菌液。紫外分光光度计测定OD值,调整浓度为106 CFU/mL备用。
1.3 具有抗烟草疫霉活性的木霉菌株筛选
将23株木霉孢子悬浮液各取5 mL分别接种于NB培养基(250 mL/500 mL)中,28 ℃、180 r/min培养。纱布分离第15天时的发酵液和菌体。发酵液用等体积的乙酸乙酯萃取后旋蒸浓缩至干。菌体用甲醇和二氯甲烷1∶1混合液100 mL浸泡3 d后过滤,滤液浓缩后,水相采用1.5倍体积的乙酸乙酯萃取后旋蒸浓缩至干。将得到的23种发酵液和23种发酵菌体提取物分别用二甲亚砜(DMSO)溶解,配制成10.0 mg/mL溶液。采用琼脂糖扩散法测其对烟草疫霉的活性。
琼脂糖扩散法:以P. nicotianae为靶标,燕麦(OA)培养基28 ℃培养4 d后,用无菌打孔器取直径为5 mm的菌饼,倒置于新的OA平板中央。在离培养基边缘3 cm处打取4个直径为5 mm的孔,4个小孔呈十字排列。在其中3个孔中加入30 μL发酵液和发酵菌体提取物,另一孔中加入DMSO作对照,28 ℃培养72 h,观察抑菌圈大小。
1.4 共培养体系的构建
本研究采用液体培养基对1.3中筛选出的活性木霉与枯草芽孢杆菌进行共培养和单培养。共培养模式为联合共培养和序列共培养[26]。联合共培养:5 mL木霉孢子悬浮液和500 μL枯草芽孢杆菌Tpb55种子液同时接种于NB培养基(250 mL/500 mL瓶)中,28 ℃、180 r/min培养。序列共培养:先分别接种木霉孢子悬浮液或枯草芽孢杆菌种子液,24 h后接种另一菌株,其余条件与联合共培养一致。通过评价两種生防菌株的生长情况,确定培养方式为先接种木霉,再接种芽孢杆菌。
在培养3、5、7 d时分别取5 mL发酵液过滤除菌后,用菌丝生长速率法测其对烟草疫霉的活性,以确定最适发酵时间。
菌丝生长速率法:取5 mL过膜除菌后的发酵液加入20 mL燕麦培养基中混合均匀,制作平板培养基。从活化后的黑胫病菌落边缘,取直径为5 mm的菌饼,倒置于平板中央。28 ℃恒温培养96 h,采用十字交叉法记录菌饼生长直径,计算抑制率。每个处理重复3次。
抑制率(%)=(对照组病原生长直径−处理组病原直径)/对照组病原直径×100.
5 mL木霉孢子悬浮液接种到NB培养基中,28 ℃、180 r/min培养24、36和48 h后接种500 μL枯草芽孢杆菌Tpb55种子液,连续培养7 d[27]。以发酵液的抗烟草疫霉效果评价合适接种时间。
1.5 单因素优化
按照1.4构建的共培养体系,对培养基配方和培养条件进行下列单因素试验,用生长速率法测定1 mg/mL发酵液提取物对烟草疫霉的抑制活性,以选出最优单因素。每组处理设3次重复。
1.5.1 基础培养基的选择 选择GPYE、察氏培养基、PDW、NB、LB共5种培养基作为木霉与枯草芽孢杆菌Tpb55共培养的培养基,进行筛选。
1.5.2 碳源种类及浓度 以木糖、蔗糖、乳糖、麦芽糖、果糖以及淀粉替换基础培养基中的碳源,每种碳源的浓度均为10 g/L。筛选出的最佳碳源浓度设置为0、5、10、20、30 g/L,筛选最优浓度。
1.5.3 氮源种类及浓度 以花生饼粉、胰蛋白胨、玉米粉和味精替换基础培养基中的氮源,每种氮源的浓度均为3 g/L,进行筛选。筛选出的最佳氮源的浓度设置为1、3、5、7、9 g/L,筛选最优浓度。
1.5.4 初始pH 使用1 mol/L NaOH和1 mol/L HCl调节培养基的初始pH为4.5、5.5、6.5、7.5、8.5,进行筛选。
1.5.5 发酵温度 采用优化后的培养基和初始pH,设定温度为23、25、28、30 ℃,进行筛选。
1.5.6 摇床转速 采用优化后的培养基、初始pH和温度,设置摇床转速为120、140、160、180 r/min,进行筛选。
1.6 盆栽防病试验
烟草疫霉菌谷制备方法:用蒸馏水熬煮谷子约30 min,至2/3谷子开花后取出用纱布过滤水分,置于锥形瓶中高压灭菌(115 ℃、30 min)。将烟草疫霉接种于燕麦培养基(OA)上活化4 d后,用打孔器取疫霉菌饼。每瓶灭菌谷子培养基中放置3~5个菌饼,25 ℃下培养14 d,即为烟草疫霉菌谷。
将土壤与疫霉菌谷混匀(每公斤土壤加入4 g菌谷)作为病土,供试土壤为烟草所即墨基地灭菌基质土。选取长势一致的烟苗移栽到病土中,并立即施加生防菌株发酵菌液10倍稀释液。盆栽试验共设5个处理:CK(清水处理);枯草芽孢杆菌Tpb55菌液;棘孢木霉HG1菌液;Tpb55+HG1复配菌液(各自发酵,共同施用);Tpb55+HG1共培养菌液(共同发酵)。
每个花盆1株烟,每个处理15株,重复3次。移栽后第21天以株为单位对各处理烟草黑胫病发病情况进行调查,统计病情指数和防病效果。
1.7 数据分析
使用Microsoft Office Excel 2019和SPSS 18.0进行数据统计分析,使用Adobe Photoshop 2020作图。
2 结 果
2.1 棘孢木霉HG1与枯草芽孢杆菌Tpb55共培养体系的构建
在本研究中,筛选到3株对烟草疫霉具有明显抑制活性的木霉,分别为里氏木霉HT6和HT7,以及棘孢木霉HG1。联合共培养以及序列共培养1(先加入枯草芽孢杆菌,后加入木霉)均表现为枯草芽孢杆菌Tpb55生长迅速,木霉未见生长。而序列共
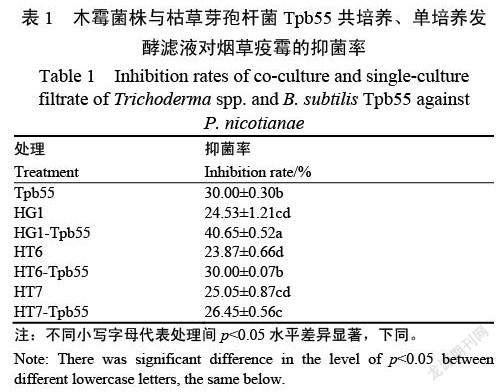
培养2(先木霉,后Tpb55)中,3株木霉和枯草芽孢杆菌Tpb55共培养后均能较好生长。在此发酵条件下,分别在发酵3、5、7 d取发酵液进行抗菌活性测定,发现第7天时的发酵液具有抗疫霉活性。故采用序列共培养,先加入木霉,培养24 h再加入枯草芽孢杆菌Tpb55,发酵时间为7 d。3株木霉与枯草芽孢杆菌Tpb55共培养后,均能提高抗烟草疫霉活性。与单培养及其他共培养处理相比,棘孢木霉HG1与Tbp55共培养后,发酵液活性最高,菌丝抑制率达到40.65%(表1)。
通过将棘孢木霉HG1培养24、36以及48 h后加入枯草芽孢杆菌共培养,观察两株菌单培养及共培养时的菌丝生长状态及其发酵液的抑菌活性。单独培养的枯草芽孢杆菌Tpb55呈乳黄色,棘孢木霉HG1呈淡黄色,菌丝呈絮状。在HG1培养24 h后接种Tpb55,Tpb55和HG1能在共培养体系中生长,共培养7 d后的发酵液呈现暗黄至棕红色,而在36 和48 h后接种,棘孢木霉HG1占主要地位,枯草芽孢杆菌Tpb55不能正常大量生长。抗菌活性测试结果表明(图1和表2),HG1培养24 h后接种Tpb55的发酵滤液抗疫霉活性(42.34%)显著高于其他处理。
2.2 共培养发酵培养基成分的单因素筛选
2.2.1 初始培养基的选择 初始培养基的筛选结果如表3所示。棘孢木霉HG1单培养处理中,GPYE和Czapek-Dox培养基的抑菌率没有显著差异,但显著高于其他3个培养基处理。枯草芽孢杆菌Tpb55单培养处理中,GPYE的抑菌率最高,为44.20%±0.82%,显著高于其他处理。同时,共培养处理中,GPYE的抑菌率(69.09%)依舊显著高于其他4个处理。因此,选用GPYE培养基为初始培养基。
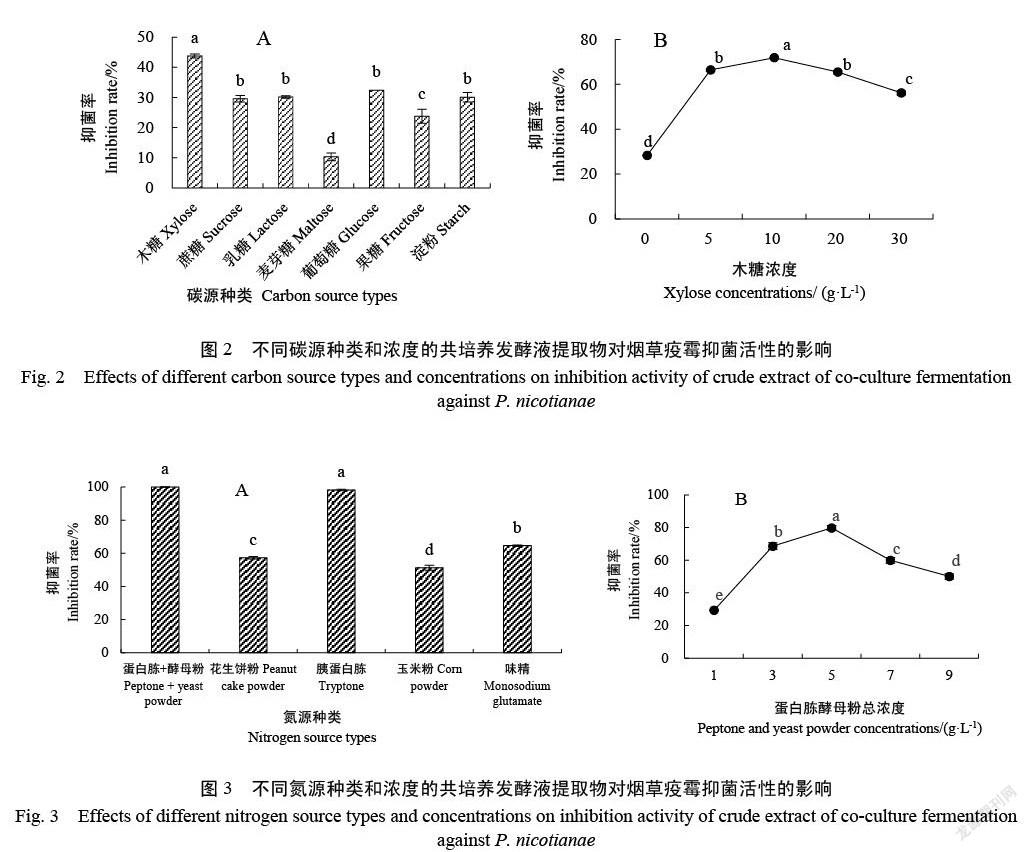
2.2.2 碳源优化 图2A表明,以木糖为碳源时的抑菌率为43.73%,显著高于其他供试碳源。以木糖作为唯一碳源,筛选合适的碳源浓度,结果如图2B所示,碳源浓度为10 g/L时,共培养发酵液提取物对烟草疫霉的抑制率最高,达到71.86%,显著优于其他浓度。因此,棘孢木霉HG1与枯草芽孢杆菌Tpb55共培养发酵培养基成分中最佳碳源是木糖,最优浓度为10 g/L。
2.2.3 氮源优化 如图3A所示,以蛋白胨+酵母粉
与胰蛋白胨作为氮源时,提取物对烟草疫霉的抑菌效果均显著高于其他氮源,蛋白胨和酵母粉的效果(24.48%)稍好于胰蛋白胨(23.71%)。因此,选用蛋白胨和酵母粉作为最佳氮源。筛选最优氮源浓度的结果如图3B所示,当蛋白胨和酵母粉浓度为5 g/L时,共培养发酵液提取物的抑烟草疫霉效果最好(79.75%)。因此,棘孢木霉HG1与枯草芽孢杆菌Tpb55共培养发酵培养基成分中最佳氮源是蛋白胨和酵母粉(2∶1),最优浓度为5 g/L。
2.3 共培养发酵条件的单因素筛选
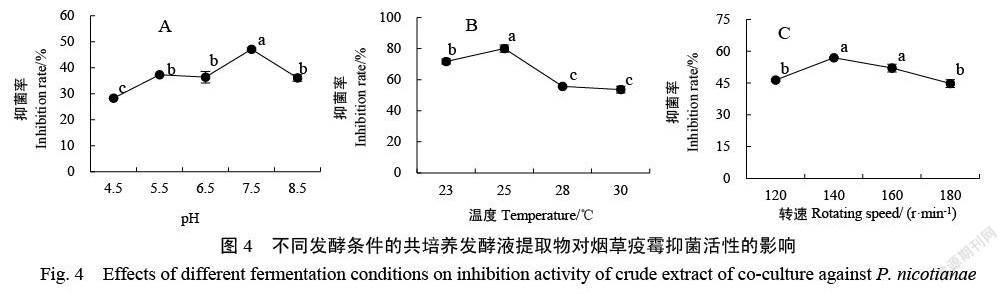
通过单因素试验筛选两种菌株共培养的最适发酵条件(图4)显示,当初始pH为7.5时,发酵液提取物的抗疫霉效果最显著,为47.11%(图4A)。当温度为25 ℃时,提取物的抑菌率为80.05%,显著高于其他温度处理(图4B)。当转速达到140 r/min时,共培养提取物的抑菌效果最好,达到56.88%(图4C)。
综上,棘孢木霉HG1与枯草芽孢杆菌Tpb55共培养体系单因素优化试验结果表明,发酵培养基的最佳碳源是10 g/L木糖,最适氮源是5 g/L的蛋白胨和酵母粉(其中蛋白胨∶酵母粉=2∶1)。培养基初始pH为7.5,接种棘孢木霉HG1和枯草芽孢杆菌Tpb55后以25 ℃、140 r/min条件下培养7 d后,共培养发酵液提取物对烟草疫霉的抑制率最高。
2.4 盆栽试验效果
盆栽试验证实了棘孢木霉HG1与枯草芽孢杆菌Tpb55共培养发酵液对烟草黑胫病有明显的防治效果。如表4所示,處理后第21天,各处理与对照组相比发病程度均显著降低。棘孢木霉HG1与枯草芽孢杆菌Tpb55共培养发酵液的防治效果显著好于单独发酵棘孢木霉HG1、枯草芽孢杆菌Tpb55以及两种发酵液的复配施用,其病情指数为22.47,防治效果为74.72%。
3 讨 论
将两种或者两种以上的生防菌株进行共培养,利用不同种群微生物的种间互作来刺激或者诱导活性代谢产物,进而防治植物病害或者促进其生长,已经被认为是一种有效的手段[16,26]。本试验通过改变两株菌的先后接种顺序及间隔接种时间,结果发现棘孢木霉HG1接种24 h后接种枯草芽孢杆菌Tpb55时两株菌均能生长良好且抑菌效果最好,这可能是菌株互相作用造成了抗菌代谢产物类型和产量的不同。KARUPPIAH等[26]基于联合共培养和序列共培养两种接种方式评估了菌体生长情况,结果表明联合共培养中解淀粉芽孢杆菌1841的快速生长导致棘孢木霉GDFS1009生长速率的下降,而先接种木霉后接种芽孢杆菌促进了两种微生物的生长,这与本研究的结果一致。
与单培养相比,多菌株共培养可以刺激菌株分泌更多种类和更高产量的次生代谢物,而菌株代谢产物往往与其抗菌活性有关。周丽梅等[28]通过分析对比Brevibacillus laterosporus BL-21和Bacillus subtilis HNDF两株菌共培养与单培养的抑菌效果和代谢产物差异,发现共培养液较B. laterosporus BL-21和B. subtilis HNDF2单培养液的抑菌活性分别提高了18.75%和83.90%。KARUPPIAH等[26-27]通过代谢组分析发现,相比单培养,共培养促进了新物质的产生和代谢物产量的提高,并且可以刺激与产孢、次生代谢、拮抗和植物促生相关酶以及抗氧化剂相关基因的表达。本研究将筛选出的棘孢木霉HG1与枯草芽孢杆菌Tpb55共培养后,其发酵滤液抑菌率为40.65%,显著优于单培养,推测共培养发酵液中抑菌活性物质种类和产量发生较大变化。
发酵过程中,生防菌株的生长状态及活性物质的种类和产量常受到培养基营养成分以及发酵条件的影响[28-29]。适宜菌株生长的营养条件和发酵条件可以提高菌量,使得活性代谢产物的产量和种类增加,从而提高其生防活性[30-31]。DUAN等[32]通过单因素试验和响应面实验优化后得出,0.5%蛋白胨、2.4%蔗糖、发酵62 h的枯草芽孢杆菌发酵液抑菌圈直径相比基础发酵液增加了12.65%。SORDE等[33]的研究表明优化温度、pH和转速后的环状芽孢杆菌产转谷氨酰胺酶活性得到显著性提升。本研究通过优化碳源、氮源的种类和浓度以及发酵体系中的温度、初始pH、转速,使发酵液的抗烟草疫霉活性得到显著提高,与前人结果基本一致。
4 结 论
本试验将筛选出的棘孢木霉HG1与枯草芽孢杆菌Tpb55构建共培养体系,证明其初始共培养条件下发酵液滤液对烟草疫霉抑菌活性为40.65%,显著优于单培养。通过单因素优化试验,确定的最优培养基成分为10 g/L木糖和5 g/L蛋白胨+酵母粉,最佳发酵条件温度25 ℃,初始pH 7.5,转速140 r/min。优化后的共培养发酵液对烟草黑胫病的盆栽防治效果为74.72%,显著高于其他处理。后续将进一步探索共培养发酵体系抑菌活性成分的分离提取及代谢通路差异等机制研究,为生防菌剂的产业化提供理论基础。
参考文献
[1]DAS A K, NERKAR S, GAWANDE N, et al. SCAR marker for Phytophthora nicotianae and a multiplex PCR assay for simultaneous detection of P. nicotianae and Candidatus Liberibacter asiaticus in citrus[J]. Journal of Applied Microbiology. 2019, 127(4): 1172-1183.
[2]GUO D, YUAN C, LUO Y, et al. Biocontrol of tobacco black shank disease (Phytophthora nicotianae) by Bacillus velezensis Ba168[J]. Pesticide Biochemistry and Physiology, 2020, 165: 104523.
[3]GALLUP C A, MCCORKLE K L, IVORS K L, et al. Characterization of the black shank pathogen, Phytophthora nicotianae, across North Carolina tobacco production areas[J]. Plant Disease, 2018, 102(6): 1108-1114.
[4]PANABIÈRES F, ALI G S, ALLAGUI M B, et al. Phytophthora nicotianae diseases worldwide: new knowledge of a long-recognised pathogen[J]. Phytopathologia Mediterranea, 2016, 55(1): 20-40.
[5]WANG Y, WEI K, HAN X, et al. The Antifungal Effect of Garlic Essential Oil on Phytophthora nicotianae and the Inhibitory Component Involved[J]. Biomolecules. 2019, 9(10): 632.
[6]李苗苗,王晓强,王东坤,等. 生防菌复配对烟草黑胫病的防治效果研究[J]. 中国烟草科学,2020,41(2):32-38.
LI M M, WANG X Q, WANG D K, et al. Effect of biocontrol agents mixture on control of tobacco black shank[J]. Chinese Tobacco Science, 2020, 41(2): 32-38.
[7]LA SPADA F, STRACQUADANIO C, RIOLO M, et al. Trichoderma counteracts the challenge of Phytophthora nicotianae infections on tomato by modulating plant defense mechanisms and the expression of crinkler, necrosis-inducing Phytophthora protein 1, and cellulose-binding elicitor lectin pathogenic effectors[J]. Frontiers in Plant Science. 2020, 11: 583539.
[8]ZHANG C S, GAO J M, HAN T et al. Integrated control of tobacco black shank by combined use of riboflavin and Bacillus subtilis strain Tpb55[J]. BioControl, 2017, 62(6): 835-845.
[9]李小杰,李成軍,姚晨虓,等. 拮抗烟草疫霉菌的木霉菌株筛选鉴定及防病促生作用研究[J]. 中国烟草科学,2020,41(3):65-70.
LI X J, LI C J, YAO C X, et al. Screening, identification of antagonistic Trichoderma spp. against tobacco black shank and its growth promotion effect on tobacco[J]. Chinese Tobacco Science, 2020, 41(3): 65-70.
[10]宋玉娟,韩雪莲,张安盛,等. 棘孢木霉T-6对烟草促生及对黑胫病和根黑腐病的抗病作用[J]. 中国烟草科学,2020,41(1):50-55.
SONG Y J, HAN X L, ZHANG A S, et al. Effects of Trichoderma asperellum T-6 on growth promotion, control of black shank and black Root rot in tobacco[J]. Chinese Tobacco Science, 2020, 41(1): 50-55.
[11]LIN C, TSAI C H, CHEN P Y, et al. Biological control of potato common scab by Bacillus amyloliquefaciens Ba01[J]. PLoS One, 2018, 13(4): e0196520.
[12]何明川,曾舒泉,王志江,等. 一株烟草疫霉拮抗菌MC4-2的鉴定、发酵条件优化及防效测定[J]. 微生物学通报,2021,48(12):4636-4648.
HE M C, ZENG S Q, WANG Z J, et al. Identification, fermentation condition optimization and control effect of an antagonistic strain MC4-2 against Phytophthora parasitica var. nicotianae[J]. Microbiology China, 2021, 48(12): 4636-4648.
[13]陆新莉,雷庭,邱克刚,等. 烟草黑胫病拮抗菌的筛选、鉴定和防病潜力[J]. 生物学杂志,2019,36(5):52-56.
LU X L, LEI T, QIU K G, er al. Screening,identification,biocontrol potential evaluation of strains against tobacco black shank[J]. Journal of Biology, 2019, 36(5): 52-56.
[14]SARMA B K, YADAV S K, SINGH S, et al. Microbial consortium-mediated plant defense against phytopathogens: readdressing for enhancing efficacy[J]. Soil Biology and Biochemistry, 2015, 87: 25-33.
[15]MA Q, CONG Y, FENG L, et al. Effects of mixed culture fermentation of Bacillus amyloliquefaciens and Trichoderma longibrachiatum on its constituent strains and the biocontrol of tomato Fusarium wilt[J]. Journal of Applied Microbiology. 2021, 132(1): 532-546.
[16]WU Q, NI M, DOU K, et al. Co-culture of Bacillus amyloliquefaciens ACCC11060 and Trichoderma asperellum GDFS1009 enhanced pathogen-inhibition and amino acid yield[J]. BioMed Central, 2018, 17(1): 155.
[17]丛韫喆. 生防菌混合发酵液对植物土传病害防治、土壤性质微生物区系和采后果实品质的影响[D]. 济南:山东大学,2020.
CONG W J. Mixed culture fermentation of biocontrol microorganism on the control of plant soil-borne diseases, the effects of soil properties, microbial flora and postharvest fruits[D]. Jinan: Shandong University, 2020.
[18]李兆防. 拮抗毛壳和木霉混用防治土传病害的初步研究[D]. 泰安:山东农业大学,2009.
LI Z F. Primary study on control efficacy of soil-borne plant diseases with mixtures of antagonistic Chaetomium and Trichoderma[D]. Tai’an: Shandong Agricultural University, 2009.
[19]张成省,孔凡玉,关小红,等. 烟草叶围细菌Tpb55菌株的鉴定及其抑菌活性[J]. 中国生物防治,2008(1):63-68.
ZHANG C S, KONG F Y, GUAN X H, et al. Identification and Antagonistic Activity of Tobacco Phyllosphere Bacteria Strain Tpb55[J]. Chinese Journal of Biological Control, 2008(1): 63-68.
[20]ZHANG C S, GAO J M, HAN T, et al. Integrated control of tobacco black shank by combined use of riboflavin and Bacillus subtilis strain Tpb55[J]. BioControl, 2017, 62(6): 835-845.
[21]黃瑞环,芶剑渝,韩小斌,等. 烟草主要病害拮抗菌的筛选鉴定及除草活性分析[J]. 烟草科技,2019,52(12):17-22.
HUANG R H, GOU J Y, HAN X B, et al. Screening and identificationof antagonistic Trichoderma sp. herbicidal activity against main tobacco diseases[J]. Tobacco Science & Technology, 2019, 52(12): 17-22.
[22]赵鹏鹏,雷淑珍,徐晓光,等. 培养基组成对贝莱斯芽孢杆菌产抑真菌成分的影响[J]. 食品与发酵工业,2020,46(5):147-151.
ZHAO P P, LEI S Z, XU X G, et al. Effect of medium compositions on the production of antifungal components by Bacillus velezensis[J]. Food and Fermentation Industries, 2020, 46(5): 147-151.
[23]周亚男,韩小斌,魏可可,等. 烟草根际可培养微生物多样性及防病促生菌的筛选[J]. 微生物学通报,2021,48(12):4649-4663.
ZHOU Y N, HAN X B, WEI K K, et al. The culturable microbial diversity in tobacco rhizosphere and their plant-growth promotion and biocontrol properties[J]. Microbiology China, 2021, 48(12): 4649-4663.
[24]许凯霞. 一株六放珊湖来源真菌Cochliobolus hawaiiensis次级代谢产物及其生物活性研究[D]. 青岛:中国海洋大学,2015.
XU K X. The secondary metabolites and their bioactivities of zoanthid Palythhoa haddoni-derived fungus Cochliobolus hawaiiensis[D]. Qingdao: Ocean University of China, 2015.
[25]吴娱,王开萍,唐正江,等. 米曲霉Aspergillus oryzae As-W.6对脱氧雪腐镰刀菌烯醇的降解效果[J]. 食品科学,2016,37(17):185-189.
WU Y, WANG K P, TANG Z J, et al. Degradation Efficiency of Deoxynivalenol by Aspergillus oryzae As-W.6[J]. Food Science, 2016, 37(17): 185-189.
[26]KARUPPIAH V, VALLIKKANNU M, LI T, et al. Simultaneous and sequential based co-fermentations of Trichoderma asperellum GDFS1009 and Bacillus amyloliquefaciens 1841: a strategy to enhance the gene expression and metabolites to improve the bio-control and plant growth promoting activity[J]. Microbial Cell Factories, 2019, 18(1): 185.
[27]KARUPPIAH V, SUN J, LI T, et al. Co-cultivation of Trichoderma asperellum GDFS1009 and Bacillus amyloliquefaciens 1841 causes differential gene expression and improvement in the wheat growth and biocontrol activity[J]. Frontiers in Microbiology, 2019, 10: 1068.
[28]周立梅,张淼,徐德阳,等. Brevibacillus laterosporus BL-21和Bacillus subtilis HNDF2共培养与纯培养抗菌代谢产物的对比分析[J]. 中国农学通报,2017,33(22):118-125.
ZHOU L M, ZHANG M, XU D Y, et al. Comparative Analysis of Co-culture and Pure Culture of Antibacterial Metabolites of Brevibacillus laterosporus BL-21 and Bacillus subtilis HNDF2[J]. Chinese Agricultural Science Bulletin, 2017, 33(22): 118-125
[29]LI T T, TANG J Q, KARUPPIAH V, et al. Co-culture of Trichoderma atroviride SG3403 and Bacillus subtilis 22 improves the production of antifungal secondary metabolites[J]. Biological Control, 2020, 140(C): 104122-104122.
[30]KHAN R A A, NAJEEB S, MAO Z, et al. Bioactive Secondary Metabolites from Trichoderma spp. against Phytopathogenic Bacteria and Root-Knot Nematode[J]. Microorganisms, 2020, 8(3): 401.
[31]李佳娣,趙劲捷,范海燕,等. 杀线虫解淀粉芽胞杆菌Sneb709与费氏中华根瘤菌Sneb183共培养发酵条件优化[J]. 中国生物防治学报,2021,37(4):771-784.
LI J D, ZHAO J J, FAN H Y, et al. Optimization of fermentation conditions for Co-culture of nematicidal Bacillus amyloliquefaciens Sneb709 and Sinorhizobium fredii Sneb183[J]. Chinese Journal of Biological Control, 2021, 37(4): 771-784.
[32]DUAN Y, CHEN J, HE W, et al. Fermentation optimization and disease suppression ability of a Streptomyces ma. FS-4 from banana rhizosphere soil[J]. BMC Microbiology, 2020, 20(1): 24.
[33]SORDE K L, ANANTHABARAYAN L. Isolation, screening, and optimization of bacterial strains for novel transglutaminase production[J]. Preparative Biochemistry and Biotechnology, 2019, 49(1): 64-73.
1099501186360
