双向等位基因特异性PCR技术在烟草SNP分型中的应用
2022-03-21林世锋王仁刚潘飞王自力元野李尊强任学良龙明锦张吉顺曾吉凡史跃伟
林世锋 王仁刚 潘飞 王自力 元野 李尊强 任学良 龙明锦 张吉顺 曾吉凡 史跃伟


摘 要:为提高抗PVY烟草品种的分子育种效率,本研究针对抗病种质资源半坤村晒烟中隐性抗病基因eIF4E1的SNP位点G149C建立一種简单快速的双向等位基因特异性PCR(Bi-directional PCR amplification of specific alleles,Bi-PASA)检测方法,并对该检测方法的特异性、准确度及实际应用效果进行验证。结果表明,建立的Bi-PASA检测方法能够在一个PCR反应中有效区分eIF4E1基因G149C位点3种基因型:野生型GG、杂合突变型GC、纯合突变型CC。利用Bi-PASA检测方法可以对K326×半坤村晒烟F2分离群体的基因型进行有效鉴别,且鉴定结果与普通的等位基因特异性PCR(allele-specific PCR,AS-PCR)以及直接测序法的鉴定结果一致。综上所述,本研究建立的Bi-PASA检测方法特异性强、准确度高、操作简便,可更好地应用于eIF4E1基因的分子标记辅助育种。
关键词:烟草;eIF4E1基因;双向等位基因特异性PCR;SNP分型
Abstract: In order to improve the efficiency of molecular marker assisted breeding for PVY-resistant tobacco varieties, we dedicated to establish a simple and rapid bi-directional PCR amplification of specific alleles (Bi-PASA) method for detecting the single nucleotide polymorphism (SNP) G149C of the recessive PVY resistance gene eIF4E1 of the resistant germplasm Bankuncunshaiyan, and to verify the specificity, accuracy and practicality of the established detection method. It turned out that the established Bi-PASA detection method can effectively distinguish the three different genotypes for the G149C SNP of the eIF4E1 gene in a single PCR reaction: wildtype (GG), heterozygous mutant (GC) and homozygous mutant (CC). The genotypes of eIF4E1 in the F2 population derived from K326/Bankuncunshaiyan were successfully identified by the Bi-PASA method. In addition, the genotypes of the F2 population identified by the established Bi-PASA method were all the same with that identified by the conventional allele-specific PCR (AS-PCR) and direct sequencing, which suggested that the established Bi-PASA method is characterized by strong specificity, high accuracy and simple operation. Therefore, it can be better applied in the eIF4E1 gene marker assisted breeding.
Keywords: tobacco; eIF4E1; bi-directional PCR amplification of specific alleles; SNP genotyping
由马铃薯Y病毒(Potato virus Y,PVY)引起的烟草马铃薯Y病毒病是烟草生产中的严重病害之一[1]。抗性基因的挖掘和利用是抗PVY育种的基础[2-3]。研究显示,在栽培烟草中,真核翻译起始因子4E1(eukaryotic translation initiation factor 4E1,elF4E1)基因为烟草PVY隐性抗病基因,即感PVY基因,该基因的缺失或突变使烟草获得PVY抗性[4]。2020年,本课题组[5]对抗PVY烟草品种半坤村晒烟中的PVY抗性基因进行等位性检测,结果显示半坤村晒烟的PVY抗性同样由eIF4E1基因控制。进一步序列分析表明,相较于感病品种,半坤村晒烟的eIF4E1基因编码区存在一个单核甘酸多态性(SNP)位点,即第149位碱基由G突变为C,属于错义突变,编码的氨基酸由色氨酸突变为丝氨酸,进而造成半坤村晒烟对PVY产生抗病性,该单碱基突变为进行eIF4E1等位基因分型提供了依据。
SNP基因分型是进行SNP分子标记辅助选择育种的首要条件[6]。目前,SNP基因分型的方法有基于PCR技术的传统分型方法和基于大型仪器的高通量检测方法[7]。基于PCR技术的传统分型方法,如限制性片段长度多态性(PCR-RFLP)、单链构象多态性(PCR-SSCP)、单核苷酸引物延伸法(single nucleotide primer extension,SNuPE)和等位基因特异性PCR(allele-specific PCR,AS-PCR)[7-8]。PCR-RFLP由于受限制性内切酶识别位点的影响,其应用具有很大的局限性;PCR-SSCP和SNuPE技术操作繁琐且重复性差。基于大型仪器的高通量检测方法,如高分辨率熔解曲线分析(high resolution melt,HRM)、变性高效液相色谱(denaturing high performance liquid chromatography,DHPLC)和基因芯片等技术[9-10],检测效率高,但仪器设备昂贵、成本高、较难普及。相比之下,利用AS-PCR技术对SNP进行分型快速、简便、成本低[8]。2020年,本课题组[11]针对半坤村晒烟eIF4E1基因SNP G149C位点建立起AS-PCR分子标记检测体系,利用该标记对K326×半坤村晒烟F2代抗感分离群体进行的基因分型结果与抗病表型鉴定结果完全一致,进一步说明半坤村晒烟的PVY抗性是由eIF4E1基因所控制,同样利用该标记可以对PVY抗性供体亲本回交转育后代的基因型进行准确选择,但每个单株基因型的检测需要进行2个单一PCR扩增,操作步骤较为复杂。
双向等位基因特异性PCR(bi-directional PCR amplification of specific alleles, Bi-PASA)是在等位基因特异性PCR的基础上发展出来的一种更为简捷的SNP分型方法,其依据的基本原理是:针对1个SNP位点设计2条延伸方向相反的内侧引物和2条外侧引物,用这4条引物在同一PCR反应中进行扩增,即通过1次PCR反应即可检测出已知突变位点的类型[12-13]。最近几年,双向等位基因特异性PCR技术在生命科学领域尤其是动植物遗传育种领域的应用已经越来越多地受到研究者的重视[14],其中在与植物抗病性状相关SNP研究中,研究者分别建立了辣椒[15]、水稻[16]、苦瓜[17]等抗病基因的双向等位基因特异性PCR检测方法。但双向等位基因特异性PCR要求在同一反应体系中同时对不同的基因类型进行特异性扩增,因而影响其扩增效果的因素较多,对退火温度差、引物配比、反应温度等参数均具有较高的要求[18]。
本文在半坤村晒烟eIF4E1基因序列分析检测到SNP G149C位点的基础上,研究利用双向等位基因特异性PCR技术进行eIF4E1基因SNP分型,为烟草抗PVY育种SNP标记的研究和应用提供一种更加省时、省力、经济有效的方法。
1 材料与方法
1.1 试验材料
本研究供试烟草材料均由贵州省烟草科学研究院新品种选育三组提供。以感PVY烟草品种K326、红花大金元、云烟87作母本和抗PVY烟草品种半坤村晒烟作父本进行杂交获得各自F1代杂交种材料,其中K326×半坤村晒烟组合F1代再通过自交产生F2及回交世代,经汁液摩擦接种法[19]进行抗性鉴定后,用于标记分析。
1.2 试验方法
1.2.1 烟草基因组DNA的提取 采用AxyPrep基因组DNA小量制备试剂盒(Axygen)提取烟草基因组DNA,并通过紫外分光光度法(Nanodrop)和琼脂糖凝胶电泳法初步检测基因组DNA的提取质量。
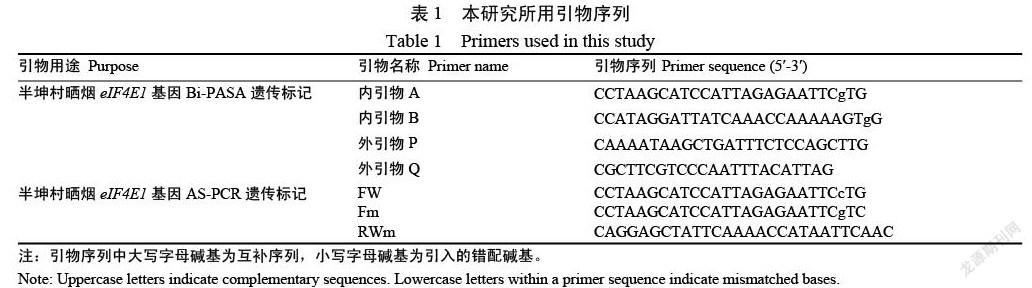
1.2.2 双向等位基因特异引物设计 针对课题组先前在半坤村晒烟eIF4E1基因上发现的SNP位点,设计适合双向等位基因特异性PCR擴增的4条引物(图1,表1)。设计方法如下:在SNP位点设计特异引物,包括外引物2条,内引物2条。先在SNP突变位点上下游200~500 bp处分别设计正、反向外引物(Outer primer),然后在所检测的变异位点处设计2个包含变异碱基的正、反向内引物(Inter primer),即2个内引物的3′末端碱基分别与SNP位点的1个碱基相同(或互补),同时还在内引物的3′末端倒数第2位(-2位)或第3位(-3位)人为引入了1个错配碱基(表1引物序列中小写字母是特别设计的错配碱基)以提高扩增反应的特异性。将4个引物链组成的3对引物在1个PCR反应中进行扩增,扩增产物用琼脂糖凝胶电泳检测,出现2条带的是纯合型(GG或CC),出现3条带的是杂合型(GC),如图1所示。
1.2.3 双向等位基因特异性PCR扩增及产物检测 双向等位基因特异性PCR反应体系为20 μL,包括Primix Taq酶(TaKaRa公司)10 μL,正、反向内、外引物(10 μmol/L)各0.4 μL,模板DNA 1 μL。PCR扩增程序:94 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s(30个循环),最后72 ℃延伸10 min。取5 μL扩增产物在2%的琼脂糖凝胶(含GelRed核酸染料)上电泳,自动凝胶成像仪观察结果并拍照测序。
1.2.4 F2单株的基因型鉴定及测序验证 分别使用Bi-PASA及普通的AS-PCR方法[5](引物序列见表1)对F2分离群体22个单株进行鉴定分型;同时,以22个单株的DNA为模板,使用Bi-PASA外侧引物P和Q进行PCR扩增(退火温度55 ℃),然后将扩增产物送至上海生工测序,验证Bi-PASA分型结果的准确性。
1.2.5 Bi-PASA分子标记在烟草种质资源中的有效性检测 选取24个已知抗性的烟草品种(表2)制备基因组DNA(方法同1.2.1);采用构建的Bi-PASA分子标记体系进行PCR扩增(方法同1.2.3);取5 μL扩增产物在2%的琼脂糖凝胶(含GelRed核酸染料)上电泳,自动凝胶成像仪观察结果并拍照分析。
2 结 果
2.1 烟草eIF4E1基因Bi-PASA遗传标记的建立
引物设计是Bi-PASA分子标记成功的关键,根据Bi-PASA引物设计的基本原则,对烟草eIF4E1基因的SNP突变位点进行引物设计,共设计出45组Bi-PASA引物,经PCR验证筛选出1组引物扩增效果最好,特异性条带最清晰、明亮,扩增产物含量最高(资料未列出)。从图2a可以看出,P/B引物对在突变纯合型个体(半坤村晒烟)和突变杂合型个体(K326×半坤村晒烟、红花大金元×半坤村晒烟、云烟87×半坤村晒烟)中扩增出1条441 bp的电泳条带,在野生纯合型个体(K326、红花大金元、云烟87)中没有扩增出电泳条带。从图2b可以看出,A/Q引物对在突变纯合型个体中没有扩增出电泳条带,在突变杂合型个体和野生纯合型个体中扩增出1条337 bp的电泳条带。图2c为加入A/Q/P/B引物组合的Bi-PASA遗传标记检测结果,在突变纯合型个体中扩增出441 bp和726 bp两条电泳条带,显示标记个体基因型为CC型;在突变杂合型个体中扩增出337、441和726 bp 三条电泳条带,显示标记个体基因型为GC型;在野生纯合型个体中扩增出1条337 bp的电泳条带,显示标记个体基因型为GG型,由于外引物组合扩增效率低(扩增不平衡)使外引物扩增产物电泳条带(726 bp)未显示,但并不影响SNP分型检测结果。
上述结果表明,单引物A/Q和P/B具有很好的特异性和稳定性,双重引物A/Q/P/B扩增结果是单引物扩增结果的叠加,且能通过1次PCR反应和1次凝胶电泳,便能区分供试材料的3种基因型,因此成功建立了检测烟草eIF4E1基因SNP位点基因型的Bi-PASA检测方法。
2.2 F2群体的AS-PCR分型结果
分别使用一对等位基因特异性(allele-specific,AS)的正向引物(FW和Fm)与共用反向引物(RWm)对F2分离群体的22个随机单株进行PCR扩增,通过电泳分析对应的PCR产物来判断eIF4E1基因型。结果如图3所示,4、6、10、14、21具有单一的ASM-m标记特异条带,是突变纯合型(CC)植株;3、7、11、16、17、18具有单一的ASM-W标记特异条带,是野生纯合型(GG)植株;其余单株同时具有ASM-m和ASM-W标记特异条带,是突变杂合型(GC)植株。
2.3 F2群体的Bi-PASA分型结果
利用Bi-PASA方法对F2分离群体的22个随机单株进行分型,结果如图4所示,1、2、5、8、9、12、13、15、19、20和22号单株扩增出337 bp、441 bp和726 bp三条电泳条带,为突变杂合型单株(GC);4、6、10、14和21号单株扩增出441 bp和726 bp两条电泳条带,为突变纯合型单株(CC);3、7、11、16、17和18号单株扩增出1条337 bp的电泳条带,为野生纯合型单株(GG)。所有单株的等位基因特征条带明亮、清晰,分型结果与AS-PCR法的结果一致,说明所建立的Bi-PASA方法完
全可以取代AS-PCR法,用于eIF4E1基因G149C多态性位点的分型检测。
2.4 测序结果
为了验证Bi-PASA分子标记检测到的F2代烟株基因型的正确性,对22个Bi-PASA分型单株进行测序,利用Chromas 2.3查看测序结果。测序结果表明(图5),Bi-PASA分型结果与测序结果的一致性达到100%,说明Bi-PASA方法准确、可靠。
2.5 Bi-PASA分子标记在烟草种质资源中的有效性检测
利用Bi-PASA分子标记引物组合对24个烟草品种进行PCR扩增(图6),在17个PVY感病品种中扩增出337 bp特异条带,而在半坤村晒烟中扩增出441 bp特异条带,与预期结果一致。除半坤村晒烟外,在其他PVY抗病品种中均未显示出任何电泳条带,这是因为在这些PVY抗病品种中eIF4E1基因发生了完全缺失,在此情况下,本研究所构建的Bi-PASA分子标记作为显性分子标记将这些抗病品种与半坤村晒烟及其他感病品种区分开来。
2.6 分子标记在烟草PVY抗性回交改良中的应用
为了使烟草PVY抗性回交改良子代鉴定工作简单高效可重复,并尽可能区分纯合、杂合基因型,采用Bi-PASA遗传标记引物组合对K326×半坤村晒烟杂交后代回交群体进行PCR扩增,并进行水平电泳,照相记录结果。然后按照如下标准判断烟草回交后代单株是否携带突变型PVY隐性抗病基因:电泳结果出现441 bp特异条带,初步判断该单株携带突变型PVY隐性抗病基因。如图7所示,回交后代单株有2种基因型:1、4、5、7、8、11、14、16、17、19、21、22单株为杂合突变型(GC),电泳结果出现337 bp和441 bp特异条带;其余单株为纯合野生型(GG),电泳结果只出现337 bp特异条带而没有出现441 bp特异条带。筛选出的杂合突变型单株可与受体亲本继续回交或供下一步育种利用,表明所构建的Bi-PASA分子标记可用于烟草PVY抗性回交改良。
3 讨 论
采用Bi-PASA技术进行SNP分型,仅需一次PCR扩增和一次琼脂糖电泳即可达到目的,是一种快速经济的SNP检测方法。本研究基于品种资源半坤村晒烟中隐性抗病基因eIF4E1序列上的SNP位点成功设计并开发了1个Bi-PASA标记,用于eIF4E1抗病等位基因的分子标记辅助选择,以期为烟草抗PVY分子标记辅助育种提供更加有力的技术支持。
目前烟草PVY抗病育种利用的抗源多数衍生自VAM,利用VAM及其衍生种育成的抗病品种往往围绕eIF4E1基因发生大片段缺失,带来的基因组变异尺度远远大于SNP或小片段缺失[20]。上述原因不仅造成上百个功能基因的缺失,而且由于无法获得缺失连接片段信息造成eIF4E1突变位点共显性分子标记无法开发,不利于隐性突变基因的连续回交定向转育。半坤村曬烟的PVY抗性是由eIF4E1基因发生SNP突变产生的,本研究针对该SNP位点建立了Bi-PASA分子标记作为共显性分子标记,能够快速区分纯合子和杂合子SNP分型,因此利用该标记在烟草PVY抗性分子标记辅助选择育种中能够缩短选择时间,对隐性突变基因可以进行不间断的回交转移,从而提高基因回交转移速度,加快育种进程。与其他分子检测方法相比,Bi-PASA还具有许多优点。Bi-PASA作为以普通PCR为基础的简单方法,实施过程中仅需一台PCR扩增仪、一套电泳设备和一些其他常用的PCR操作工具。与PCR-RFLP和传统的AS-PCR不同,Bi-PASA只需一次PCR扩增和一次琼脂糖电泳即可达到分型的目的[12-13]。此外,尽管目前出现的基于大型仪器的高通量检测方法比Bi-PASA效率高,如基因芯片技术、DHPLC、TaqMan MGB和高分辨溶解曲线分析法,但由于这些方法成本较高,无法常规使用[9-10]。
Bi-PASA引物设计是决定该技术检测灵敏度和准确性的关键。YE等[13]研究认为,在内引物的3′末端第2位引入错配碱基,并且通过选择错配碱基类型,可以提高扩增反应的特异性。卫波等[21]分别在第2位和第3位引入错配碱基,发现对于不同的SNP突变类型,加入错配碱基的位置和类型不同扩增效果不同。本研究在Bi-PASA引物设计时,在各个内引物3′末端的第2位或第3位分别引入不同类型错配碱基,然后通过PCR引物组合筛选获得1组引物扩增效果较好。结合已有研究报道和前期积累发现,在Bi-PASA内引物3′末端引入错配碱是增加SNP基因分型准确性的必要措施。
内外引物的浓度比是反应体系优化的重要内容,不同研究中优化结果差别比较大。王齐旭等[17]在苦瓜抗白粉病分子标记开发中优化内外引物浓度比为10∶1;郑炜佳等[22]在棉花SNP分型的研究中优化内外引物浓度比为4∶1;KOU等[23]在甘薯的研究中优化内外引物浓度比为2∶1;郝志明等[24]在小麦研究中,内外引物浓度比为3∶2;田孟祥等[25]、姚姝等[26]和陈国鑫等[27]在水稻的研究中均将内外引物的浓度比确定为1∶1,这与本试验的设置的内外引物浓度比一致。对于本试验烟草SNP的检测,在Bi-PASA反应体系中4条引物浓度比设置为1∶1∶1∶1便获得了满意的特异性条带,这可能还与引物的位置、Tm值和扩增片段大小等有关。
退火温度也是影响PCR特异性的重要因素,温度过高扩增不出特异性条带,过低则杂带多。本研究前期从大量引物组合中筛选出1组引物组合进行更加深入的PCR反应条件优化,通过不断提高退火温度,可以有效降低非特异性条带的扩增,当退火温度达到58 ℃时,等位基因特征条带清晰、明亮,扩增产物含量最高,尽管外侧引物扩增产物电泳条带减弱或消失(图2、4、5、6、7),但并不影响SNP分型检测结果。
4 结 论
本研究针对烟草PVY隐性抗病基因eIF4E1已知的G149C SNP位点建立了一种双向等位基因特异性PCR分型方法,同时与传统的等位基因特异性PCR方法进行了比较分析。研究结果表明,引物的合理设计和扩增条件的优化是成功建立双向等位基因特异性PCR检测方法的关键。相较于传统的等位基因特异性PCR方法,本研究建立的双向等位基因特异性PCR方法能够在1个PCR反应中检测出eIF4E1基因SNP位点的3种基因型(GG、GC、CC),操作简便,省时省力,可以更好地促进烟草抗PVY种质资源的利用和新品种选育。
参考文献
[1]TIAN Y P, LIU J L, ZHANG C L, et al. Genetic diversity of potato virus Y infecting tobacco crops in China[J]. Phytopathology, 2011, 101(35): 377-387.
[2]林奇英,谢联辉,黄如娟,等. 烟草品种对病毒病的抗性鉴定[J]. 中国烟草科学,1987(3):18-19.
LIN Q Y, XIE L H, HUANG R J, et al. Identification of the resistance of tobacco varieties to viruses[J]. Chinese tobacco science, 1987(3): 18-19.
[3]陈荣平,焦庆明,兰荣利,等. 烟草抗PVY育种材料的筛选与应用[J]. 中国烟草科学,2000,21(1):1-4.
CHEN R P, JIAO Q M, LAN R L, et al. Selection and utilization of resistant tobacco materials to PVY[J]. Chinese tobacco science, 2000, 21(1): 1-4.
[4]JULIO E, COTUCHEAU J, DECORPS C, et al. A eukaryotic translation initiation factor 4e (eif4e) is responsible for the “va” tobacco recessive resistance to potyviruses[J]. Plant Molecular Biology Reporter, 2015, 33(3): 609-623.
[5]林世锋,李尊强,元野,等. 与烟草PVY抗性紧密连锁的分子标记、引物及应用:CN112094942A[P]. 2020-12-18.
LIN S F, LI Z Q, YUAN Y, et al. Molecular marker closely linked with tobacco PVY resistance and primer and application: CN112094942A[P]. 2020-12-18.
[6]赵琼一,李信,周德贵,等. 后基因组时代下作物的SNP分型方法[J]. 分子植物育种,2010,8(1):125-133.
ZHAO Q Y, LI X, ZHOU D G, et al. SNP genotyping methods for crops in post-genomic era[J]. Molecular Plant Breeding, 2010, 8(1): 125-133.
[7]GANAL M W, ALTMANN T, RDER M S. SNP identification in crop plants[J]. Current Opinion in Plant Biology, 2009, 12(2): 211-217.
[8]陈吉宝,景蕊莲,员海燕,等. 等位基因特异PCR技术的研究与应用[J]. 植物遗传资源学报,2005,6(4):469-473.
CHEN J B, JING R L, YUAN H Y, et al. Development of allele-specific PCR[J]. Journal of Plant Genetic Resources, 2005, 6(4): 469-473.
[9]汪維鹏,倪坤仪,周国华,等. 单核苷酸多态性检测方法的研究进展[J]. 遗传,2006,28(1):117-126.
WANG W P, NI S Y, ZHOU G H, et al. Approaches for SNP genotyping[J]. Hereditas, 2006, 28(1): 117-126.
[10]ALKAN C, COEL B P, EICHLER E E. Genome structural variation discovery and genotyping[J]. Nature Reviews Genetics, 2011, 12(5): 363-376.
[11]林世锋,李尊强,元野,等. 与烟草PVY抗性紧密连锁的分子标记、引物及应用:CN112094942A[P]. 2020-12-18.
LIN S F, LI Z Q, YUAN Y, et al. Molecular marker closely linked with tobacco PVY resistance and primer and application: CN112094942A[P]. 2020-12-18.
[12]QIANG L, THORLAND E C, HEIT J A, et al. Overlapping PCR for bidirectional PCR amplification of specific alleles: a rapid one-tube method for simultaneously differentiating homozygotes and heterozygotes[J]. Genome Research, 1997, 7(4): 389-398.
[13]YE S, SAHAR D, KE X, et al. An efficient procedure for genotyping single nucleotide polymorphisms[J]. Nucleic Acids Research, 2001, 29(17): E88-8.
[14]余钧剑,迟美丽,贾永义,等. 四引物扩增受阻突变体系PCR技术及其在动植物遗传育种研究中的应用[J]. 生物技术通报,2020,36(5):32-38.
YU J J, CHI M L, JIA Y Y, et al. Tetra-primer amplification refractory mutation system PCR and its application in fauna and flora genetics and breeding research[J]. Biotechnology Bulletin, 2020, 36(5): 32-38.
[15]RUBIO M R, CARANTA C C, PALLOIX A P. Functional markers for selection of potyvirus resistance alleles at the pvr2-eIF4E locus in pepper using tetra-primer ARMS-PCR[J]. Genome, 2008, 51(9): 767-771.
[16]陳涛,孙旭超,张善磊,等. 稻瘟病广谱抗性基因Pigm特异性分子标记的开发和应用[J]. 中国水稻科学,2020,34(1):28-36.
CHEN T, SUN X C, ZHANG S L, et al. Development and verification of specific molecular markers for Pigm gene associated with broad-spectrum resistance to rice blast[J]. Chinese Journal of Rice Science, 2020, 34(1): 28-36.
[17]王齐旭,冯诚诚,梁家作,等. 四引物扩增受阻突变体系PCR在苦瓜抗白粉病分子标记开发中的应用[J]. 北方园艺,2018(5):39-46.
WANG Q X, FENG C C, LIANG J Z, et al. Application of tetra-primer ARMS PCR in development of molecular markers for powdery mildew resistance of bitter melon[J]. Northern Horticulture, 2018(5): 39-46.
[18]林世锋,王仁刚,任学良,等. 检测烟草eIF4E-1基因单碱基插入突变的Bi-PASA标记引物及方法:CN110129479A[P]. 2019-08-16.
LIN S F, WANG R G, REN X L, et al. Bi-PASA marker primer and method for detecting tobacco eIF4E-1 gene single base insertion mutation CN 110129479A [P]. 2019-08-16.
[19]田波,裴美云. 植物病毒研究方法[M]. 北京:科学出版社,1987:1-11.
TIAN B, PEI M Y. Research methods of plant virus[M]. Beijing: Science Press, 1987: 1-11.
[20]DLUGE K L, SONG Z B, WANG B W, et al. Characterization of Nicotiana tabacum genotypes possessing deletion mutations that affect potyvirus resistance and the production of trichome exudates[J]. BMC Genomics, 2018, 19(1): 484.
[21]卫波,景蕊莲,王成社,等. 用等位基因特异PCR检测普通小麦(Triticum aestivum L.)的单核苷酸多态性[J]. 中国农业科学,2006,39(7):1313-1320.
WEI B, JING R L, WANG C S, et al. Assaying single nucleotide polymorphism in wheat (Triticum aestivum L.) with allele-specific PCR[J]. Scientia Agricultura Sinica, 2006, 39(7): 1313-1320.
[22]郑炜佳,曲延英,谢元元,等. ARMS-PCR对棉花SNP分型的研究[J]. 新疆农业科学,2013,50(12):2182-2188.
ZHENG W J, QU Y Y, XIE Y Y, et al. Study on SNP genetic typing of sea-island cotton genome group[J]. Xinjiang Agricultural Sciences, 2013, 50(12): 2182-2188.
[23]KOU M, XU J L, LI Q, et al. Development of SNP markers using RNA-seq technology and tetra-primer ARMS-PCR in sweetpotato[J]. Journal of Integrative Agriculture, 2017, 16(2): 464-470.
[24]郝志明,章悦,张力菁,等. 小麦抗麦红吸浆虫候选基因TraesCS4A01G437800的四引物ARMS-PCR标记开发[J]. 河北农业大学学报,2020,3(2):5-14.
ZHENG Z M, ZHANG Y, ZHANG L J, et al. Development of tetra-primer ARMS-PCR marker of candidate gene TraesCS4A01G437800 for resistance to Sitodiplosis mosellana in bread wheat[J]. Journal of Agricultural University of Hebei, 2020, 3(2): 5-14.
[25]田孟祥,张时龙,余本勋,等. 基于四引物扩增受阻突变体系PCR快速鉴定水稻S5基因的籼粳属性[J]. 作物杂志,2015(6):48-53.
TIAN M X, ZHANG S L, YU B X, et al. Rapid detection of indica-japonica attribute of S5 gene based on tetra-primer amplification refractory mutation system PCR in rice[J]. Crops, 2015(6): 48-53.
[26]姚姝,陳涛,张亚东,等. 利用分子标记辅助选择聚合水稻Pi-ta、Pi-b和Wx-mq基因[J]. 作物学报,2017,43(11):1622-1631.
YAO S, CHEN T, ZHANG Y D, et al. Pyramiding Pi-ta, Pi-b, and Wx-mq genes by marker-assisted selection in rice (Oryza sativa L.)[J]. Acta Agronomica Sinica, 2017, 43(11): 1622-1631.
[27]陈国鑫,陈冰,李昊澍,等. 四引物分子标记鉴定水稻光合效率基因TAC1的不同基因型[J]. 分子植物育种,2020,18(7):163-170.
CHEN G X, CHEN B, LI H S, et al. Identification of different genotypes of TAC1, a photosynthesis efficiency related gene, by a Ttetra-primer marker[J]. Molecular Plant Breeding, 2020, 18(7): 163-170.
