羊弓形虫病间接ELISA诊断方法的建立
2022-03-14李迎迎李亚琼李明俊周艳琴赵俊龙
李迎迎,侯 伦,王 敏,李亚琼,李明俊,周艳琴,2,赵俊龙,2,申 邦,2
(1.华中农业大学动物医学院 农业微生物学国家重点实验室,武汉 430070;2.湖北省预防兽医学重点实验室,武汉 430070)
弓形虫是一种在世界范围内广泛分布的人兽共患寄生原虫,可以引起人和多种动物患病,据估计,全球约有1/3的人感染弓形虫[1]。我国农业动物中,猪的感染率很高,一般在20%以上,有的养殖场甚至高达100%[2]。羊是除小鼠以外对弓形虫最敏感的动物,羊感染弓形虫后容易引起流产、死胎、弱胎等,在有些国家,高达20%的羊流产由弓形虫感染引起[3-4],给畜牧业带来了很大的损失。在中国,羊群平均感染率在10%左右,而在北部和西北部达到了20%或更高[5]。目前国际上虽然有一个针对羊弓形虫病的商业疫苗(Toxovax),但安全风险较大[6],没有被大范围使用[7]。
羊弓形虫感染没有特征性的临床症状,因此鉴别诊断比较困难。目前实验室尝试过的弓形虫病检测方法有很多,包括病原学检测、分子生物学检测和血清学方法[8],但针对羊弓形虫病检测的方法或标准产品少之又少。在众多方法中,酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)具有敏感特异,可短时间内处理大量临床样品的优点,适用于现场调查和推广,因此受到广泛的关注。目前,ELISA方法诊断弓形虫病应用的抗原较多,在人的弓形虫病检测上主要有速殖子全虫抗原(Total Toxoplasma gondii tachyzoites antigens,TXA)、表面抗原1(Surface antigen 1,SAG1)[9]、致密颗粒蛋白8(Dense granule protein 8,GRA8)等,但是检测不同动物的感染可能需要不同的抗原。在本实验中,分别用全虫抗原(TXA)、微线体蛋白3(Microneme protein 3,MIC3)、致密颗粒蛋白1(Dense granule protein 1,GRA1)、缓殖子抗原1(Bradyzoite antigen 1,BAG1)、多表位抗原(Multi-epitope antigen,MAG)进行正交试验,通过对比P/N(阳性血清OD630值/阴性血清OD630值)值大小以及每种蛋白提纯的难易程度和刺激机体免疫力的情况等,比较并筛出诊断抗原。综合考虑抗原纯化的难易程度等多个因素选择分泌蛋白GRA1作为候选抗原,建立了检测羊弓形虫病的GRA1-iELISA(检测IgG抗体)方法,这些结果为羊弓形虫病ELISA试剂盒商品化生产提供了参考价值,对羊弓形虫病的临床诊断和疾病控制具有重要意义。
1 材料与方法
1.1 质粒、菌种与虫株 弓形虫RH虫株(本实验室保存)在HFF细胞(ATCC公司,美国)中扩大繁殖,HFF细胞培养在含2%FBS(胎牛血清)的DMEM中;BL21(DE3)表达菌株为本实验室保存;pGEX-KG-MIC3[10]、pGX6P-1-MAG[10]、pET-28a-BAG1[11]重组质粒为本实验室构建并保存。pE-SUMO-GRA1质粒的构建方式如下:提取弓形虫RH株速殖子的RNA,利用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa,日本)得到cDNA,并以此为模板利用GRA1(CDS)-F和GRA1(CDS)-R(表1)为引物扩增GRA1的编码区,然后用ClonExpess一步法无缝克隆试剂盒将GRA1-CDS片段连接到pE-SUMO载体上得到pE-SUMO-GRA1,经酶切鉴定测序验证无误后,将其转化到大肠杆菌BL21(DE3)中用于GRA1的诱导表达。
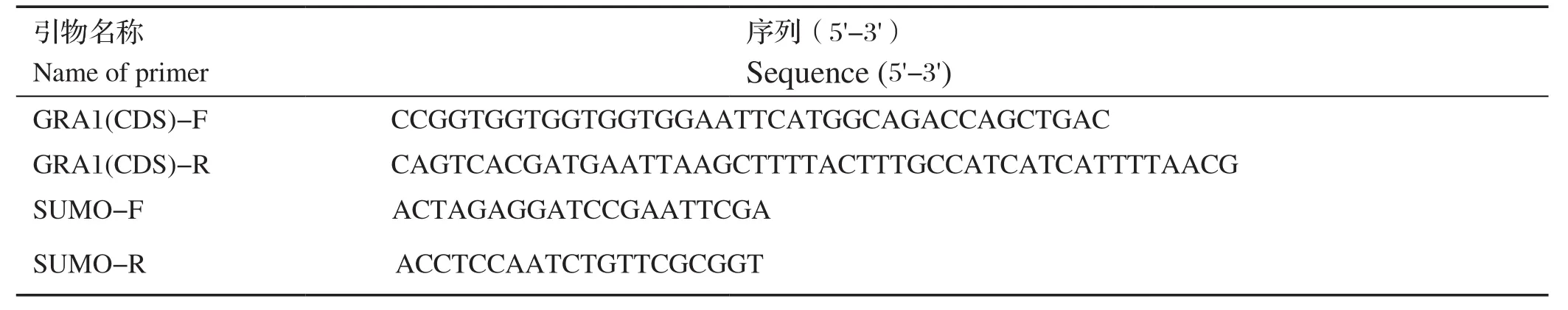
表1 构建pE-SUMO-GRA1质粒用到的引物序列Table 1 Primers used to construct the pE-SUMO-GRA1 plasmid
1.2 样本来源 80份黑山羊血清采自湖北省黄冈市某屠宰场;20份山羊弓形虫阴性血清采自湖北省农科院畜牧兽医研究所;弓形虫标准阴、阳性对照血清、山羊无浆体阳性血清、山羊莫氏巴贝斯虫阳性血清、山羊吕氏泰勒虫阳性血清均由中国农业科学院兰州兽医研究所朱兴全老师、关贵全老师惠赠。
1.3 5种抗原的制备 全虫抗原的制备:RH速殖子培养在T25细胞瓶中,待弓形虫速殖子(约107个)逸出后收集细胞,用注射器吹打以裂 解宿主细胞并释放虫体,用3 μm滤器过滤,1500 ×g离心收集虫体并用PBS洗涤3次,向沉淀中加入200 μL裂解液(RIPA),置于超声清洗机中裂解30 min至液体清亮,离心取上清液,利用BCA蛋白浓度测定试剂盒测得蛋白浓度,然后放在-80℃保存备用。制备MIC3、MAG、BAG1蛋白的具体操作参照文献中相应步骤[10-11]。GRA1的制备方法如下:将BL21(DE3)/pE-SUMO-GRA1表达菌株扩大培养至OD600为0.4,加入终浓度为1.0 mmol/L的IPTG诱导4 h,离心收集菌体,用压力破碎仪破碎菌体,4℃条件下12000 ×g离心10 min取上清液,将上清液用0.45 μm的滤器过滤,然后经亲和层析柱纯化。
1.4 以4种重组蛋白和全虫抗原为包被抗原的正交试验 将5种抗原分别按5、2.5、1.25、0.625、0.3125 μg/mL的梯度稀释,包被酶标条,每个浓度包被一纵列5孔。将阴、阳性对照血清分别按1∶25、1∶50、1∶100、1∶200、1∶400稀释,每个稀释度加到一横列5孔,二抗用Rabbit Anti-Goat IgG(HRP Conjugated)。按文献描述的方法[11]进行ELISA操作,比较各抗原对应的P/N值的大小,依次选择最优抗原。同时,选择正交实验中P/N值最大处对应的抗原包被浓度和血清稀释倍数作为最佳条件优化后续的iELISA方法。
1.5 GRA1-iELISA方法
1.5.1 各项反应条件优化 在正交试验结果基础上对封闭浓度(0.5%、1.0%、1.5%与2.0%的BSA)和时间(20、30、45、60 min)、待检血清作用时间(30、45、60、75 min)、二抗使用浓度(1∶3000、1∶4000、1∶5000、1∶6000)及时间(30、45、60、75 min)、底物反应作用时间(5、7.5、10、12.5 min)进行优化。上述试验重复3次以确定最佳条件。
1.5.2 重复性试验 批内重复试验采用同一批次包被的酶标板,分别在包被后第0、3、6、9、12 d对3份阳性血清和2份阴性血清按照已经优化好的条件进行检测,并计算其平均值、标准差和变异系数。批间重复试验分别取5个批次包被的酶标板在同一时间对3份阳性血清和2份阴性血清按照已经优化好的条件进行检测。
1.5.3 敏感性试验和特异性试验 敏感性试验:5份阳性血清各作1∶25、1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600稀释,然后用优化好的条件进行GRA1-iELISA检测,并设阳性、阴性、空白对照,寻找检测结果为阳性的最大血清稀释度作为敏感性试验的结果。特异性试验:用建立的方法对山羊莫氏巴贝斯虫阳性血清、山羊吕氏泰勒虫阳性血清、捻转血矛线虫阳性血清进行检测,检查是否有交叉反应。
1.5.4 检测临床样本 应用建立的方法对采集自湖北省某屠宰场的80份山羊血清进行检测,分别设置阳性、阴性和空白对照,计算阳性率。同时,应用改良凝集试验(MAT)对该批血清检测,计算阳性率,比较两种方法的符合率。
2 结果
2.1 5种抗原的SDS-PAGE凝胶电泳分析和Western blot验证 本研究选定弓形虫速殖子全虫抗原(TXA)以及4个重组蛋白(GRA1、MIC3、MAG、BAG1)作为羊弓形虫病诊断的候选抗原。为检查抗原的表达情况,对纯化后的4个蛋白以及全虫抗原进行SDS-PAGE凝胶电泳分析,结果见图1。重组His-SUMO-GRA1、GST-MIC3、GST-MAG、His-BAG1大小分别约为39、68、43、42 kDa,目的条带大小与预期相符(图1)。
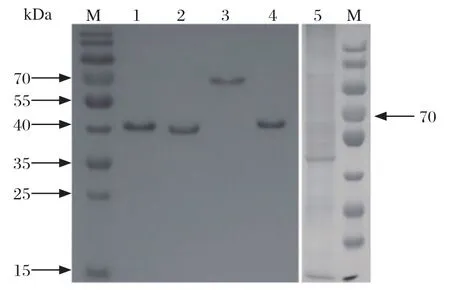
图1 5种抗原的SDS-PAGE鉴定Fig.1 SDS-PAGE analysis of five antigens
同时,为验证候选抗原的免疫反应性,对5种抗原进行Western blot分析,结果见图2。Western blot显示,5种抗原均能被山羊弓形虫特异的阳性血清识别,与阴性血清不反应(图2),说明免疫反应性良好。
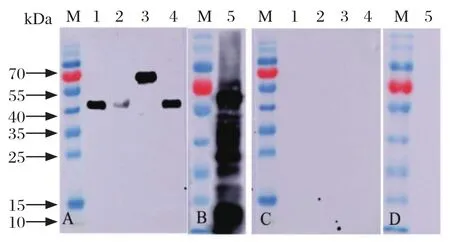
图2 5种抗原的Western blot分析Fig.2 Western blot analysis of 5 different antigens
2.2 确定诊断抗原 将上述5种蛋白包被ELISA酶标板,用阴(N)、阳性(P)对照血清进行间接ELISA试验,整合数次方阵滴定结果,发现以GRA1为包被抗原的滴定试验对应的OD630P/N值最大,说明GRA1适合作为建立羊弓形虫病诊断方法的候选抗原。同时,GRA1重组蛋白能够以可溶形式大量表达,易纯化,因此我们选定GRA1作为羊弓形虫病iELISA诊断方法的最佳抗原。方阵滴定的结果还表明,GRA1-iELISA OD630P/N值最大值处对应的蛋白包被浓度是1.25 μg/mL,血清稀释度是1∶100。
2.3 反应条件优化 在正交试验结果的基础上,以GRA1为包被抗原,对后续反应条件进行筛选,根据P/N值大小明确了最佳封闭时间是30 min,最佳封闭浓度是1%的BSA(牛血清白蛋白),血清最佳作用时间是60 min,酶标二抗最佳稀释比是1∶5000,二抗最佳作用时间是45 min,显色时间是10 min。
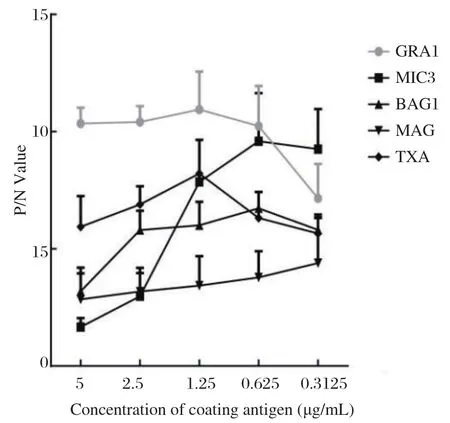
图3 方阵滴定试验确定最佳诊断抗原Fig.3 Titration test to identify the best antigen
2.4 阴、阳性临界点的判定 按照以上优化的反应条件,对20份阴性血清(经改良凝集试验MAT验证)用建立的间接ELISA方法进行检测,结果如表2所示。根据表中数据,经统计学处理,求得20份阴性血清样品的S(样本OD630值)/N(标准阴性血清OD630值)的平均值x为1.4815,标准方差SD为0.2742,根据统计学原理x+3SD置信区间为99%,计算出ELISA阴阳性的临界值是x+3SD=2.304,因此待测样品的S/N值≥2.3为阳性,反之,则判断为阴性。
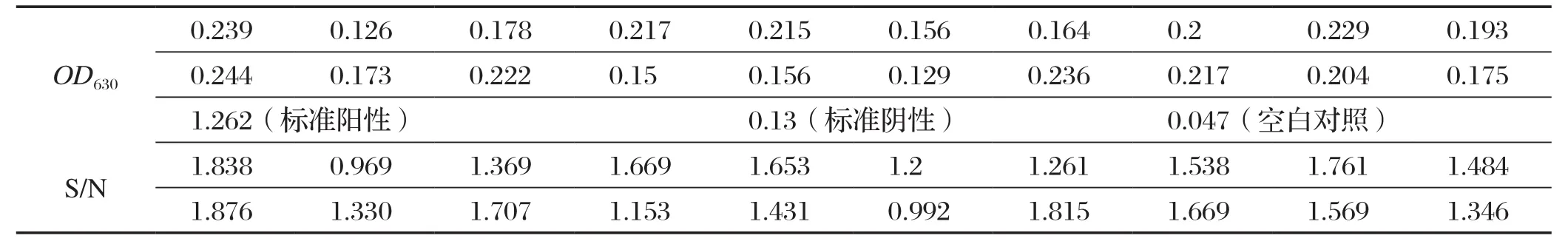
表2 20份阴性血清检测结果Table 2 Detection results of 20 negative sera
2.5 重复性试验结果 以优化后的间接ELISA检测方法分别对批内、批间(5个)各5份样品重复5次进行检测。结果显示,重复试验的变异系数均小于7%,说明建立的ELISA方法具有良好的重复性。结果见表3和表4。
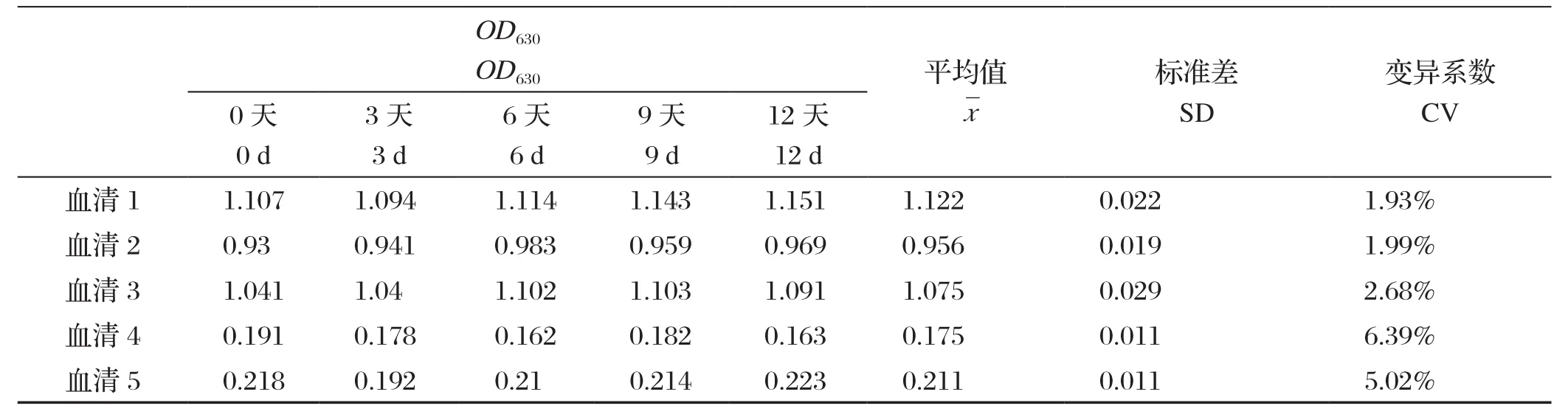
表3 批内重复试验结果Table 3 Reproducibility of intra-batch test of the GRA1-iELISA
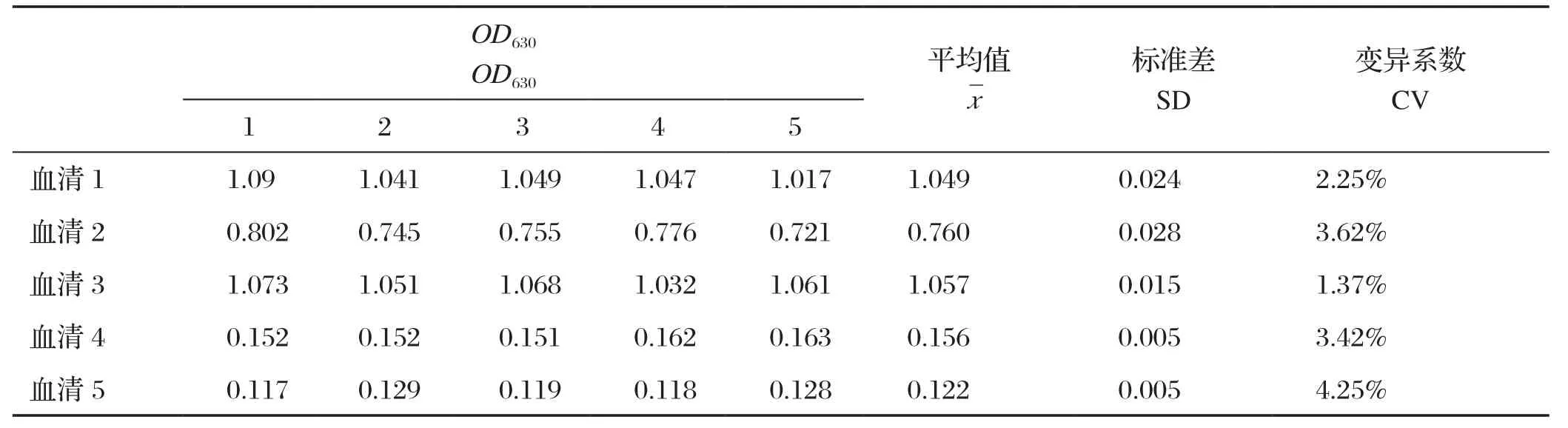
表4 批间重复试验结果Table 4 Reproducibility of GRA1-iELISA between batches
2.6 敏感性试验和特异性试验结果 为评估本研究所建立方法的敏感性,对5份阳性血清各作1∶25、1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600稀释进行检测,并设阳性、阴性、空白对照,结果见表5。在本次检测中,所以血清稀释100倍以后还能被检为阳性,说明本方法敏感性大于1∶100。
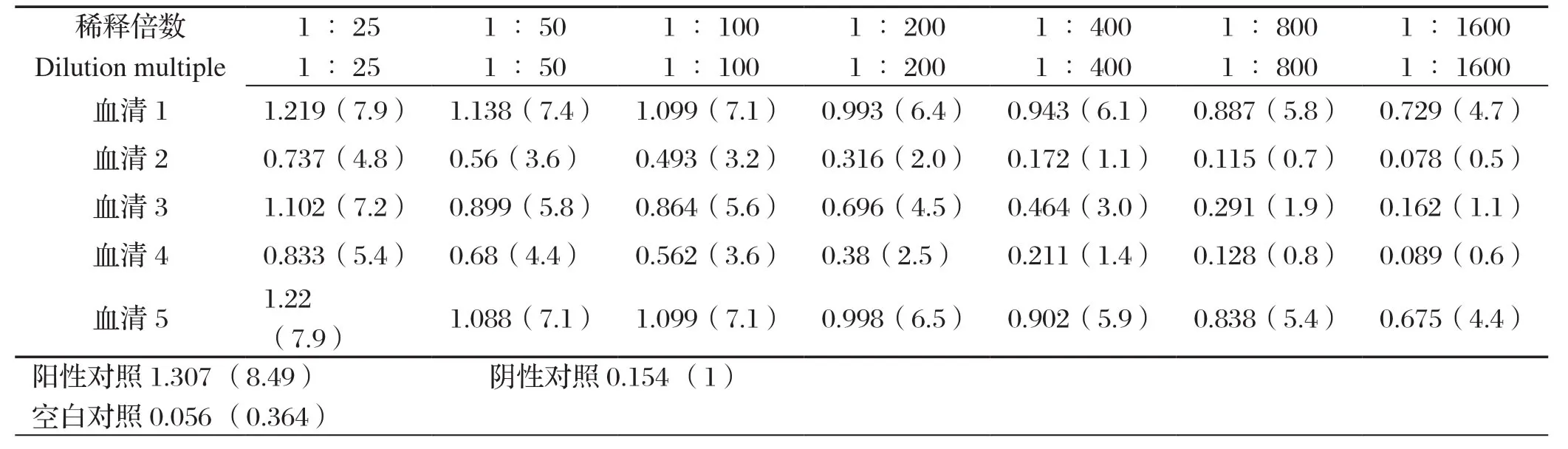
表5 敏感性试验结果Table 5 Sensitivity test of GRA1-iELISA
为评估本研究所建立方法的特异性,用建立的方法对山羊莫氏巴贝斯虫阳性血清、山羊吕氏泰勒虫阳性血清、捻转血矛线虫阳性血清进行检测,并设阳性、阴性、空白对照,结果见表6。该方法不与羊莫氏巴贝斯虫、羊吕氏泰勒虫、捻转血矛线虫阳性血清发生交叉反应(表6),说明特异性良好。

表6 特异性试验结果Table 6 Specificity test of GRA1-iELISA
2.7 临床样本检测结果 应用本研究优化后的GRA1-iELISA方法,对采自湖北省黄冈市罗田县某屠宰场的80份黑山羊血清进行检测,结果发现该批山羊群体中弓形虫抗体阳性率为28.75%(23/80)。将该结果与改良凝集试验MAT检测结果比较,二者的符合率为82.5%(66/80),见表7。
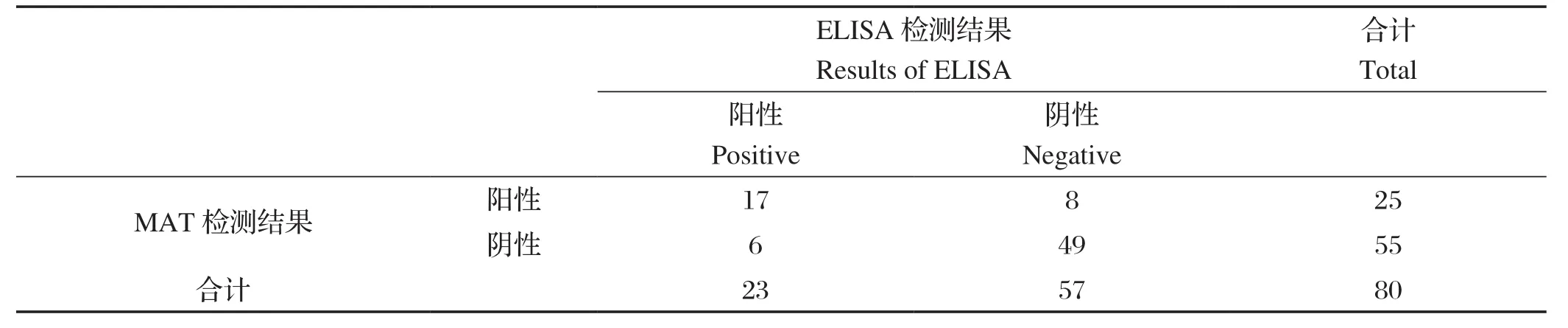
表7 MAT和ELISA检测结果对比Table 7 Comparison analysis of MAT and ELISA
3 讨论
弓形虫病是一种世界范围内的人畜共患病,羊弓形虫病对畜牧业发展以及公共卫生安全均有重大威胁,因此,建立准确、有效的羊弓形虫病现场诊断方法非常必要。目前,弓形虫病的检测方法在实验室内有很多尝试,但是针对羊弓形虫病,国际上尚无十分完善的快速诊断方法,国内也缺少标准的商业化试剂盒。ELISA方法灵敏、特异、微量高效,无需昂贵设备和特殊技术,可在短时间内检测大量样本,能够满足兽医基层批量检测的需要。
在本实验中,我们表达纯化了与弓形虫相关的5种蛋白,通过一系列试验,筛选出了各方面均比较突出的致密颗粒蛋白GRA1作为诊断抗原建立检测方法。GRA1蛋白作为弓形虫的分泌蛋白[12],在弓形虫生活史的各个时期均有表达,并且可溶性好,表达量高,易提纯,经济成本低,是建立诊断方法的优秀抗原[13]。建立本方法的不足之处是进行特异性试验的样本较少,仅选用了两种原虫和一种蠕虫阳性样品,原因是临床上较难找到无特定病原体的山羊血清。本研究中以GRA1为诊断抗原的羊弓形虫病间接ELISA方法灵敏度适中、特异性较好,适合养殖和屠宰现场的快速和高通量检测,为后续商业化试剂盒的生产提供了参考价值,为羊弓形虫病的流行病学调查以及免疫效果的监测提供了技术支持,对羊弓形虫病的防控具有重要意义。
