稳定表达PRRSV N蛋白的Marc-145细胞系的构建
2022-03-14任同伟全东群王玉旭欧阳康黄伟坚韦祖樟
任同伟,覃 念,全东群,谢 欣,王 豪,王玉旭,陈 樱,欧阳康,黄伟坚,韦祖樟
(广西大学动物科学技术学院 动物传染病与分子免疫学实验室,南宁 530005)
猪繁殖与呼吸综合症(porcine reproductive and respiratory syndrome,PRRS),俗称“蓝耳病”,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的怀孕母猪流产,尤其是怀孕后期母猪流产、产死胎、木乃伊胎、弱仔,还引起各阶段猪呼吸道疾病的一种接触性传染病[1-4]。PRRSV是一种不分节段的单股正链RNA病毒,属于套式病毒目动脉炎病毒科动脉炎病毒属成员。PRRSV基因组全长约15 000 bp,含有至少10个开放阅读框(open reading frame,ORF)[5],从5′端到3′端,依次为ORF1a、ORF1b、ORF2a、ORF2b、ORFs3-7,以及最新发现的ORF5a。5′端占基因组全长3/4的ORF1a和ORF1b编码病毒基因组复制和转录相关的酶复合物,基因组3′端至少有8个ORFs(ORF2~ORF7)来编码病毒结构蛋白。
PRRSV N蛋白为病毒的核衣壳蛋白,由ORF7基因编码,相对分子质量为14~15 kDa。N蛋白免疫原性强,是PRRSV的主要免疫原蛋白,感染宿主主要产生抗N蛋白抗体[6]。N蛋白的主要作用是包装病毒基因组RNA,N蛋白在细胞浆中合成后,通过共价和非共价的连接形式与自身结合,这是病毒核衣壳蛋白组装的基础[7],当N蛋白转运到内质网腔和高尔基体,N-N之间通过二硫键连接形成同源二聚体N蛋白,从而形成直径在20~30 nm的球状核衣壳[8-9]。在PRRSV复制过程中,部分N蛋白可进入易感细胞如肺泡巨噬细胞(pulmonary macrophages,PAM)和Marc-145细胞的核仁中[10],研究表明N蛋白核定位与PRRSV致病性有关[11]。本研究通过构建稳定表达PRRSV N蛋白的Marc-145细胞系,为以后PRRSV N蛋白在细胞内包装病毒粒子相关研究奠定基础。
1 材料和方法
1.1 质粒和细胞 Marc-145细胞、293T细胞、慢病毒载体pLenti-CMV-EGFP-Hygro质粒、VSVG质粒、psPAX2质粒均由广西大学动物科学技术学院动物传染病与分子免疫学实验室保存,DH5α感受态细胞购自CWBIO公司。
1.2 主要试剂 LA Taq®购自TaKaRa公司;限制性内切酶、T4 DNA Ligase购自NEB公司;Plasmid Mini Kit、Gel Extraction Kit、Viral RNA Kit、HP Total RNA Kit购自OMEGA公司;Lipofectamine 2000购自Invitrogen公司;Anti His-Tag Mouse Monoclonal Antibody、eEC Western blot Kit购自CWBIO公司;HRP标记山羊抗小鼠IgG(H+L)购自Beyotime公司;NaHCO3粉剂、细胞培养基MEM、DMEM粉剂购自Sigma公司;新生胎牛血清FBS购自Biological Industries;0.25%胰酶、0.05%胰酶购自Gibco公司。
1.3 重组慢病毒质粒的构建 根据PRRSV感染性克隆pGXAM和慢病毒载体pLenti-CMV-EGFP-Hygro的基因组序列设计一对特异性引物,N-XbaⅠ-F:5′-tgcTCTAGAtcatgctgagggtgat-3′,N-his-SalⅠ-R:5′-agtGTCGACtcaATGGTGATGGTGATGATGtg ctgagggtgatgc-3′,下划线为内切酶识别位点。以pGXAM为模板,通过PCR扩增在3′端含有His标签的PRRSV N蛋白序列。PCR反应条件:94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸45 s,35个循环;72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳鉴定正确后纯化回收。将回收产物及慢病毒载体pLenti-CMV-GFP-Hygro分别用XbaⅠ和SalⅠ双酶切后纯化回收,用T4 DNA连接酶连接后,转化DH5α感受态细胞,涂布于氨苄抗性的LA平板,挑取单个菌落测序,将测序正确的菌液扩大培养提取质粒。将构建正确的质粒命名为pLenti-CMV-N。
1.4 慢病毒包装 以约1×106个/孔的密度将293T细胞接种于6孔板培养,待细胞密度达到90%时,按照Lipfection 2000的说明,将构建好的质粒pLenti-CMV-N以及阳性对照pLenti-CMV-GFP-Hygro(5 µg)分别与VSVG(1.25 µg)、psPAX2(3.5 µg)共转染293T细胞,观察24 h,收集细胞上清液后添加新鲜的2%FBS DMEM培养基,观察48 h后并收取细胞上清液,将细胞上清液3000 ×g离心10 min,于-80℃保存。
1.5 慢病毒转导和细胞筛选 将Marc-145细胞接种于6孔板,细胞密度达到90%时,取1.4中48 h慢病毒包装的细胞上清液感染细胞,孵育1 h后,弃去感染液,加入新鲜的含有一定药物浓度的10%FBS MEM培养基,于37℃、5%CO2培养箱培养,分别于感染后24、48、72 h进行观察。对慢病毒感染后的细胞进行药物筛选前,将潮霉素B以100~1000 µg/μL的浓度分别配制于10%FBS MEM培养基中,确定药物筛选浓度为200 µg/μL。感染72 h后弃去原培养基,在6孔板中加入新鲜的含有潮霉素B的10%FBS MEM培养,每天观察,待阴性对照全部死亡,终止筛选,初步筛选出阳性细胞。用终点稀释法将药物筛选后的细胞以1个/100 μL的密度接种于96孔板中培养。10 d左右挑取状态良好的单一克隆细胞株移至24孔细胞培养板培养,待细胞长满后对孔中部分细胞进行鉴定。
1.6 细胞系的PCR鉴定 裂解筛选后的部分细胞,用Universal Genomic DNA Kit直接提取细胞DNA,PCR扩增N蛋白序列;用哺乳动物细胞RNA提取试剂盒提取细胞总RNA,反转录为cDNA后,PCR扩增N蛋白序列。PCR反应条件参考1.3。将PCR产物用1.5%琼脂糖凝胶进行电泳,凝胶成像系统分析结果。两种方法分别设立没有转染慢病毒包装上清液的Marc-145细胞作为阴性对照。
1.7 间接免疫荧光(indirect immunoinfluscent assay,IFA) 将PCR鉴定后初步筛选出的细胞传至10代接种于6孔细胞培养板,待细胞单层长满后,PBS洗3次,冰甲醇固定15 min,PBS洗3次,0.1%的BSA室温封闭30 min,弃掉BSA上清液,PBS洗3次,1∶2500倍稀释后的一抗(SDOW-17,PRRSV的抗N蛋白单克隆抗体,鼠单克隆抗体)37℃孵育2 h,PBS洗5次,1∶500倍稀释二抗(Alexa Fluor568标记羊抗鼠IgG)室温避光孵育1 h,PBS润洗5次,置于荧光显微镜避光观察结果。设置空载转染细胞及正常细胞作为对照。
1.8 蛋白免疫印迹 将PCR鉴定后初步筛选出的细胞传至10代收集部分细胞,用RAPI裂解,经5×上样缓冲液处理后进行15%的SDS-PAGE电泳,转移至PVDF膜,5%BSA室温封闭2 h,1∶2000倍稀释的一抗(Anti His-Tag Mouse Monoclonal Antibody),37℃孵育2 h,1∶1000倍稀释的二抗(HRP标记山羊抗小鼠IgG(H+L)),37℃孵育45 min,用ECL化学发光试剂盒显色后观察结果。设置空载转染细胞及正常细胞作为对照。
2 结果
2.1 重组慢病毒质粒的构建和包装 以PRRSV感染性克隆pGXAM为模板,经PCR扩增出含酶切位点及His标签的N蛋白基因序列,长度为384 bp。用XbaⅠ和SalⅠ内切酶酶切后的PCR纯化产物并克隆至pLenti-CMV-Hygro载体上。经过酶切、测序鉴定后得到表达N蛋白的慢病毒质粒pLenti-CMV-N。将慢病毒表达质粒pLenti-CMV-N与VSVG和psPAX2共转染293T细胞,并设置阳性对照pLenti-CMV-GFPHygro。24 h后,阳性对照可以观察到荧光,表明慢病毒载体中GFP表达,病毒包装成功。
2.2 慢病毒转导后细胞系的筛选与鉴定 将包装好的病毒液转导Marc-145细胞,用潮霉素B筛选后,经终点稀释法将筛选后的细胞以1个/100μL稀释到96孔板中,10 d左右可以明显观察到细胞克隆聚集成团,筛选得到具有抗性的细胞株。抽提细胞DNA及RNA,分别用PCR扩增N蛋白基因序列,经凝胶电泳显示在380 bp左右处有特异性条带(图1)。将细胞传至10代,间接免疫荧光(indirect immunoinfluscent assay,IFA)试验可以观察到筛选的细胞中有红色的荧光信号(图2)。提取细胞总蛋白,蛋白免疫印迹试验检测筛选细胞在15 kDa左右处有目的条带(图3)。这些结果表明我们成功筛选出稳定表达PRRSV N蛋白的Marc-145细胞系。
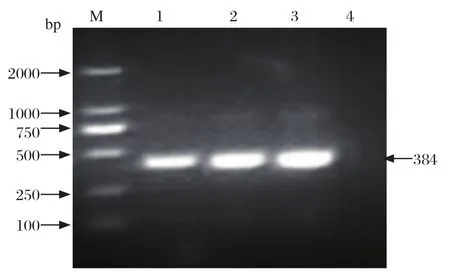
图1 PCR检测细胞系中N基因Fig.1 PCR amplification of N gene in cell lines
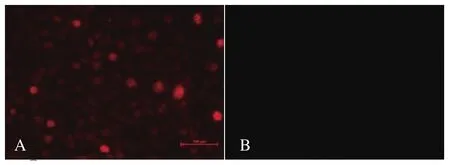
图2 免疫荧光鉴定细胞系N蛋白的表达Fig.2 Indirect immunoinfluscent assay identification of N protein expression in cell lines
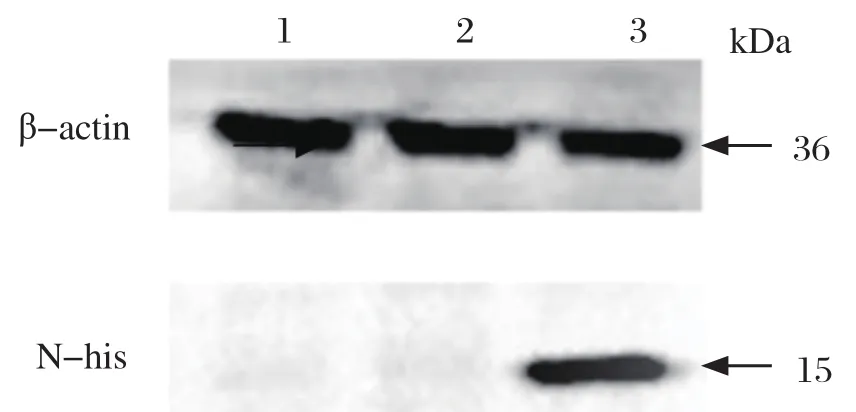
图3 Western blot 检测细胞系N蛋白上标签的表达Fig.3 Western blot identification of N protein expression in cell lines
3 讨论
目前,建立稳定表达外源蛋白的细胞系有多种方法,相对于质粒转染目的细胞筛选获得稳定细胞系的方法,慢病毒包装具有高效的表达特性[12]。外源基因是否表达,以及目的蛋白是否具有活性,是鉴定稳定转染细胞系是否构建成功的重要标志[13]。相关研究表明,绿色荧光蛋白(green fluorescent pntein,GFP)性质比较稳定、荧光强度高,并且对多数宿主细胞没有明显的毒害作用,被广泛地用作载体报告基因[14]。因此本试验中,慢病毒包装以及转染时以pLenti-CMV-GFP-Hygro作为阳性对照。当GFP基因整合进入宿主DNA基因组并表达时,在倒置荧光显微镜下会观察到GFP荧光,而没有转染或整合成功的细胞在倒置荧光显微镜下不会观察到GFP荧光,根据GFP荧光表达情况,确定慢病毒的包装及转染是否成功。His-tag是由6个组氨酸组成的短肽,由于其相对分子质量小,利用His标签可以建立一个基于融合蛋白的高效检测和纯化系统[15]。本试验中,在N蛋白基因序列3′端加上His-tag,通过检验标签的表达从而确定细胞中N蛋白表达情况。
目前所应用的慢病毒属于复制缺陷型病毒,对分裂中和非分裂的细胞都有很高的感染效率,具有很好的生物安全性,是一种理想的用于筛选稳定细胞系的基因转移载体。建立稳定的细胞系,在基因功能研究、药物开发等生物研究中具有重要作用。针对PRRSV的研究,Pujhari等[16]借助构建表达PRRSV GP2的Marc-145细胞系发现GP2蛋白可能有抑制细胞凋亡的作用,其激活的转录因子可能是通过激活抗凋亡基因和抑制促凋亡基因的表达。Song等[17]构建缺失部分ORF7的PRRSV感染性克隆,同时构建稳定表达PRRSV N蛋白的BHK-21细胞系,将体外转录的有复制能力但缺乏繁殖能力的PRRSV病毒样颗粒转染该细胞系,通过反式互补系统,成功拯救出单轮复制的PRRSV病毒。在这之前,Welch等[18]通过反向遗传操作技术分别将PRRSV基因组序中的ORF2和ORF4基因起始密码子敲除,并将ORF2和ORF4起始密码子敲除的突变克隆转染在稳定表达PRRSV GP2和GP4蛋白的细胞系中,拯救出的病毒均在相应的互补细胞中传代40~50代。虽然拯救的病毒在正常的Marc-145细胞存在复制缺陷,但这些复制缺陷病毒可以进入Marc-145和PAM细胞并表达病毒蛋白,并且对猪的攻毒试验也表明具有很好的生物安全性。本试验构建了稳定表达PRRSV N蛋白的Marc-145细胞系,为研究PRRSV蛋白的结构功能和探索新型疫苗提供新思路。
