体外TLR3配体增强鸭坦布苏病毒灭活苗效果的免疫机制研究
2022-03-14提金凤李志杰王海燕王莉莉
提金凤,李志杰,王海燕,王莉莉
(1山东畜牧兽医职业学院,潍坊 261061;2寿光市纪台镇畜牧兽医工作站,寿光 262722;3青岛市黄岛区农业农村局,青岛 266400)
鸭坦布苏病毒(Tembusu virus,TMUV)感染是2010年以来我国东南养鸭地区最先出现的一种病毒性传染病,该病传播速度快,波及范围广[1-3],主要引起产蛋鸭产蛋率急剧下降,卵泡出血、萎缩、变形,病程可持续1个月左右,之后产蛋率逐渐恢复[4-6]。该病毒也可感染雏鸭,主要表现为震颤、站立不稳等症状。到目前为止,该病在我国主要养鸭地区依然发生,常呈地方性流行,给养鸭业造成严重危害和经济损失[7]。
DTMUV弱毒苗和灭活疫苗的成功研制为临床上有效防控该病奠定基础,但弱毒苗存在散毒、毒力易返强、易污染等风险;灭活苗虽然安全性好,但难以诱发良好的细胞免疫[8-9],与弱毒苗相比免疫效果较差。因此,如何增强DTMUV灭活疫苗免疫效果,揭示其免疫增强机制,可为临床上DTMUV感染的有效防控提供新思路、新方法,在该病的早期防控中意义重大。
Toll样受体(TLRs)活化后可诱导机体天然免疫应答,尤其是TLR3、TLR7、TLR8、TLR9等在机体抗病毒免疫中发挥重要作用[10-11]。TLR3的配体主要是双链RNA,RNA病毒(病毒复制过程中天会产生双链RNA)和人工合成的双链RNA,如poly(I:C),均可激活TLR3,启动天然免疫应答,进而激活机体的特异性免疫,发挥抗病毒作用[12-15]。本研究采用TLR3配体和灭活DTMUV作用雏鸭外周血单个核细胞(PBMC),检测不同时间点TLR3、相关信号蛋白及细胞因子水平,初步明确TLR3配体对DTMUV灭活疫苗免疫应答的增强作用。通过以上研究,旨在阐明TLR3配体对DTMUV灭活疫苗的免疫增强机制,从而揭示TLR3配体在机体免疫应答方面的作用机制,为临床新型疫苗佐剂的研制提供新思路。
1 材料与方法
1.1 试验动物及病毒 SPF鸭胚购自中国农业科学院哈尔滨兽医研究所。SPF鸭胚在孵化箱中孵化出雏鸭,饲养雏鸭生长至1周龄。鸭坦布苏病毒SDSG株由山东农业大学禽病研究所分离保存,该毒株(GenBank登录号:KJ740746)是2013年从山东省某发病鸭场分离,鸡胚半数致死量为104.8ELD50/0.2 mL。
1.2 试剂 鸭IL-6、α-IFN、β-IFN、γ-IFN ELISA检测试剂盒购自上海朗顿生物科技有限公司,TLR3配体Poly(I:C)购自购自InvivoGen 公司,雏鸭外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离试剂盒购自碧云天生物技术有限公司,DH5α购自北京康为世纪生物科技有限公司,β-丙内酯购自Ferak 公司,RNAsimple 总RNA提取试剂盒(DP419)购自天根生化科技(北京)有限公司,pMD18-T试剂盒、SYBR Premix Ex Taq、PrimeScriptTMRT reagent Kit with gDNA Eraser、DNA凝胶纯化试剂盒等购自宝生物工程(大连)限公司,ddH2O、PCR mix购自北京索莱宝科技有限公司,RPMI-1640 培养基和胎牛血清购自Invitrogen公司,FITC标记的山羊抗小鼠IgG(H+L)购自北京全仕金生物技术有限公司。其他试剂均为国产分析纯。
1.3 雏鸭外周血单个核细胞(PBMC)的制备及培养 无菌采集1周龄SPF雏鸭的外周抗凝血与等量Hank′s液混匀,加到淋巴细胞分离液的液面上,2000×g水平离心20 min。离心后分为三层,在上、中层界面处有一层以单个核细胞为主的白色云雾层,即为外周血单个核细胞,吸取后用Hank′s液洗涤两次。用含有10%小牛血清的RPMI1640重悬细胞,调整细胞密度为1×106个/mL,分装至6孔细胞培养板,放置于5%CO2的细胞培养箱37℃孵育2 h,备用。
1.4 病毒灭活及试验分组 将1mL DTMUV(1×104.8ELD50/0.2 mL)经0.05%β-丙内酯4℃作用12 h,再经37℃ 孵育2 h,DEF细胞中传三代,没有细胞病变且RT-PCR检测为阴性即病毒灭活成功。TLR3配体poly(I:C)与灭活DTMUV共同孵育雏鸭PBMC,试验分4组:a.po ly(I:C)(20 μg/mL,100 μL/孔)与灭活DTMUV(100 μL/孔)共同孵育雏鸭PBMC,b.poly(I:C)(20 μg/mL)(100 μL/孔)单独孵育雏鸭PBMC,c.灭活DTMUV(100 μL/孔)单独孵育雏鸭PBMC,d.RP MI-1640 对照组。分别收集作用4、8、12 h后各组样品,离心,取上清液和细胞沉淀,-20℃备用。每组样品做3个重复。
1.5 SYBR GreenⅠ荧光定量PCR方法的建立 根据GenBank上发布的鸭细胞因子IL-6(XM 027450925)、鸭α-IFN(EF053034)、鸭β-IFN(KM035791)、鸭γ-IFN(AF087134)、TLR3(KU949327)、MyD88(KP729184)、T R I F(K J 4 6 6 0 5 1)以及内参基因G A P D H(XM038180584)的基因序列,利用Primier Premier 5.0软件设计引物,引物由生工生物工程(上海)有限公司合成。PCR扩增片段与pMD18-T载体连接,构建IL-6、α-IFN、β-IFN、γ-IFN、TLR3、MyD88、TRIF、GAPDH8的阳性重组质粒,作为荧光定量PCR的阳性标准品。利用阳性标准品建立以GAPDH 为内参的SYBR GreenⅠ荧光定量PCR,建立标准曲线。

表1 引物序列Table 1 The primer sequence
1.6 TLR3相关细胞因子和信号蛋白转录水平的检测分别收集试验组和对照组作用4、8、12 h后的PBMC样品,12 000×g离心5 min,收集离心后的PBMC沉淀,用无菌PBS洗涤3次,采用RNA提取试剂盒提取细胞总RNA,分光光度计测定其纯度和浓度。利用反转录试剂盒,采用20 μL体系合成1000 ng RNA的cDNA。利用建立的SYBR GreenⅠ实时荧光PCR测定各PBMC样品中IL-6、α-IFN、β-IFN、γ-IFN以及信号蛋白TLR3、TRIF、MyD88、NF-κB的mRNA转录水平。反应体系按照SYBR® Premix Ex Taq™kit说明书进行配制:SYBR® Premix Ex Taq™(2×)12.5 μL,上、下游引物(10 μmol/L)各1 μL,RNA模板1000 ng,ddH2O补充至25 μL。每组样品做3个重复。
1.7 雏鸭PBMC细胞上清液中细胞因子和干扰素含量的检测 分别收集试验组和对照组作用4、8、12 h后的PBMC样品,12 000× g离心5 min,收集离心后的细胞上清液,通过商品化的ELISA 试剂盒检测IL-6、α-IFN、β-IFN、γ-IFN的含量,测定方法依据检测试剂盒说明书的步骤。
1.8 NF-κB 对雏鸭PBMC分泌细胞因子和干扰素影响的检测 为了研究NF-κB对雏鸭PBMC分泌细胞因子和干扰素的影响,用浓度为5 μmol/L的 NF-κB 抑制剂BAY11-7082和DMSO分别预处理雏鸭PBMC 2 h,再用poly(I:C)和灭活DTMUV的不同组合孵育雏鸭PBMC 8 h,收集细胞样品,12 000×g离心5 min,收集离心后的PBMC沉淀,提取细胞总RNA,荧光定量PCR检测细胞因子mRNA的转录水平。
2 结果
2.1 SYBR GreenⅠ荧光定量PCR方法的建立 构建8个重组质粒T-IL-6、T-α-IFN、T-β-IFN、T-γ-IFN、T-TLR3、T-MyD88、T-TRIF、T-GAPDH,PCR对其进行鉴定,分别获得IL-6基因136 bp,α-IFN基因230 bp、β-IFN基因201 bp、γ-IFN基因247 bp,TLR3基因201 bp,TRIF基因101 bp,MyD88基因187 bp以及GAPDH基因176 bp,如图1所示。以上重组质粒的测序结果与 GenBank 中发布的核酸序列比对,同源性均为100%。优化试验确定了实时荧光定量PCR反应的最佳退火温度、引物浓度、循环次数、循环条件等指标。优化后的实时荧光定量PCR反应体系为:2×SYBR GreenⅠPremix 12.5 μL,模板1000 ng,上、下游引物(10 μmol/L)各1.0 μL,加ddH2O至25 μL。反应条件优化后为:94℃预变性4 min;94℃变性15 s,59℃退火45 s,反应40个循环。
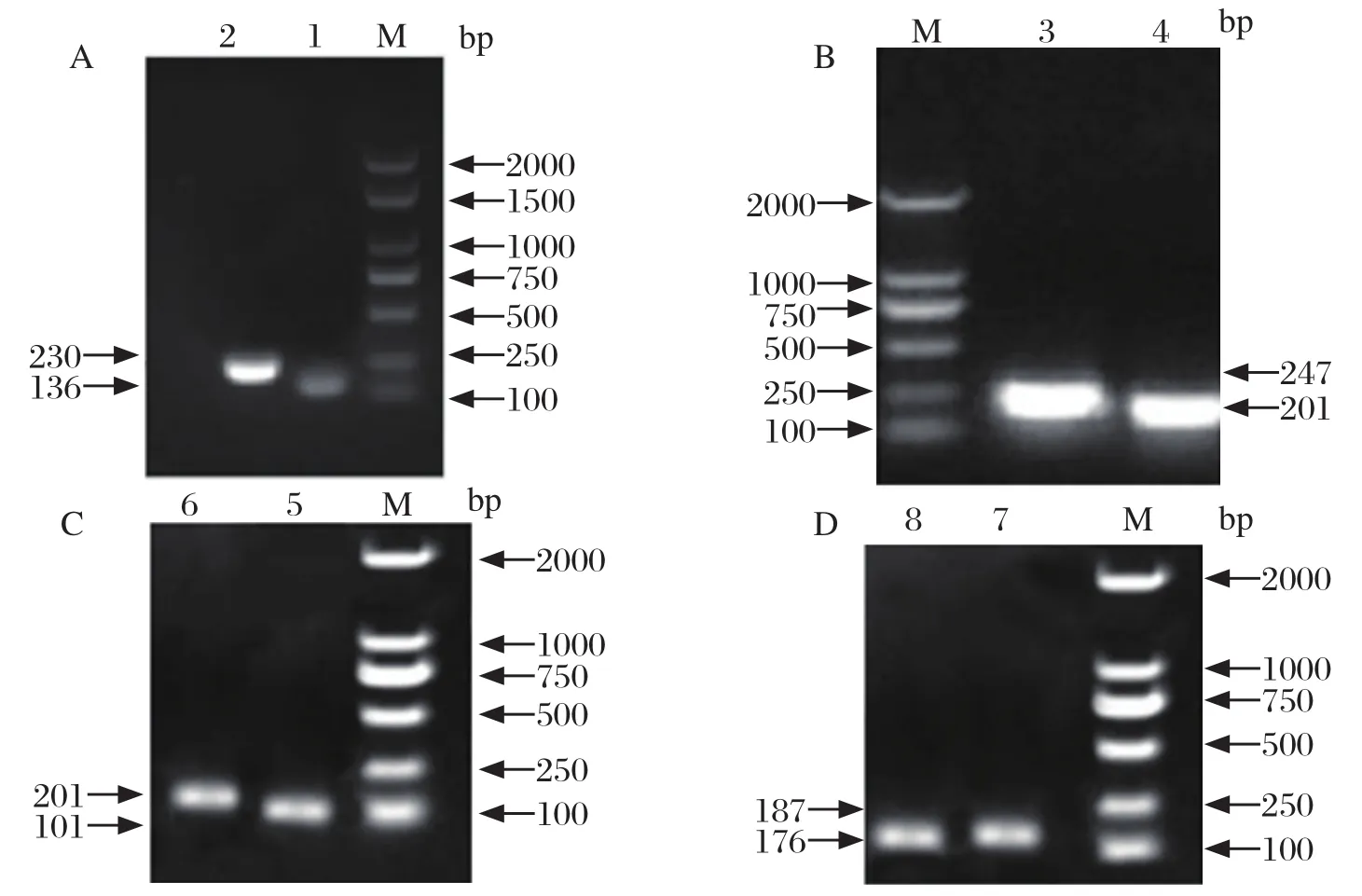
图1 阳性标准品的PCR鉴定Fig.1 PCR identification of the standard plasmids
2.2 不同时间雏鸭PBMC中细胞因子转录水平的检测TLR3 配体poly(I:C)与DTMUV 灭活抗原共同孵育雏鸭PBMC 4、8、12 h后,分别收集细胞沉淀,提取细胞总RNA,荧光定量PCR检测不同组相关细胞因子(IL-6)和干扰素(α-IFN、β-IFN、γ-IFN)的mRNA转录水平,结果如图2所示。灭活DTMUV孵育组与RPMI-1640对照组,细胞因子和干扰素mRNA的表达量维持在本底水平;与灭活DTMUV孵育组、RPMI-1640对照组相比,poly(I:C)+灭活DTMUV孵育组中细胞因子和干扰素mRNA 的表达水平从孵育后4 h开始升高,4、8、12 h表达水平均差异显著(P<0.05)。与灭活DTMUV孵育组、RPMI-1640对照组相比,poly(I:C)组在孵育4 h后,细胞因子和干扰素mRNA 的表达水平开始升高,但差异不显著;孵育12 h后,IL-6及干扰素mRNA 的表达水平升高显著(P<0.05);尤其是β-IFN和γ-IFN,孵育8h后转录水平开始升高,且差异显著(P<0.05)。poly(I:C)组与poly(I:C)+灭活DTMUV孵育组相比,IL-6及干扰素mRNA 的转录水平低,且差异显著(P<0.05)。
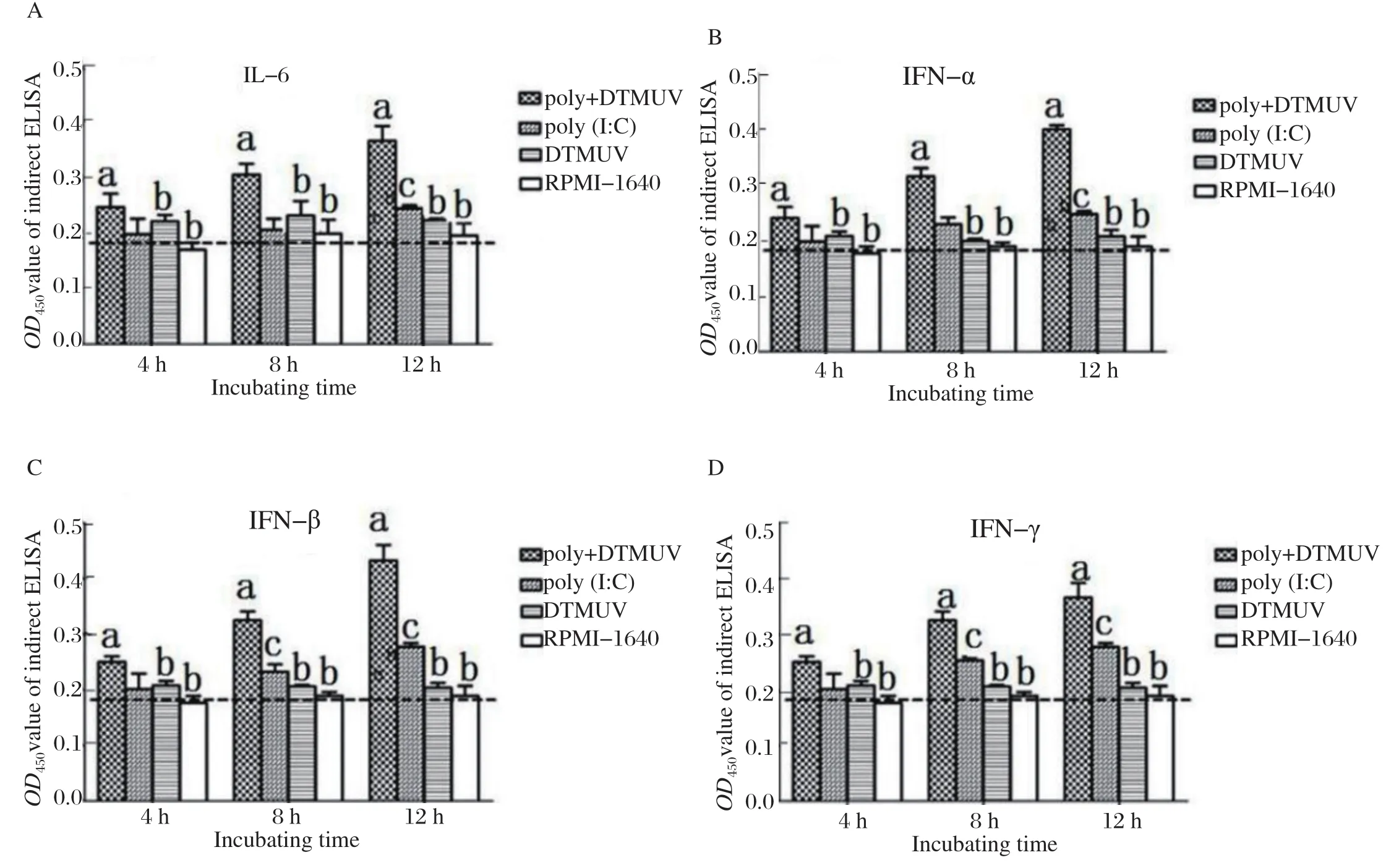
图2 不同时间细胞因子的转录水平Fig.2 Transcription levels of cytokines at different times
2.3 雏鸭PBMC中细胞因子表达水平的检测 TLR3配体poly(I:C)与灭活DTMUV的不同组合分别孵育雏鸭PBMC 4、8、12 h后,收集细胞上清液,采用商品化ELISA试剂盒进行细胞因子蛋白表达水平的检测。按照说明书的步骤,检测不同试验组雏鸭PBMC上清中细胞因子(IL-6)和干扰素(α-I FN)的含量,结果 如 图3所示。灭活DTMUV孵育组与RPMI-1640对照组,细胞因子和干扰素的蛋白表达水平始终较低,没有升高趋势。与灭活DTMUV孵育组和对照组相比,poly(I:C)+灭活DTMUV组中细胞因子和干扰素的含量从孵育后4 h开始升高,孵育8 h后细胞因子含量升高显著(P<0.05),孵育12 h后各细胞因子含量持续升高,且差异显著(P<0.05)。poly(I:C)组在孵育12 h后,细胞因子和干扰素蛋白表达量升高明显,分别与灭活DTMUV孵育组和RPMI-1640对照组相比,差异显著。但与poly(I:C)+灭活DTMUV孵育组相比,各细胞因子和干扰素表达水平较低,且差异显著(P<0.05)。可见,细胞因子(IL-6)和干扰素(α-IFN、β-IFN、γ-IFN)蛋白含量水平与转录水平的检测结果是一致的。
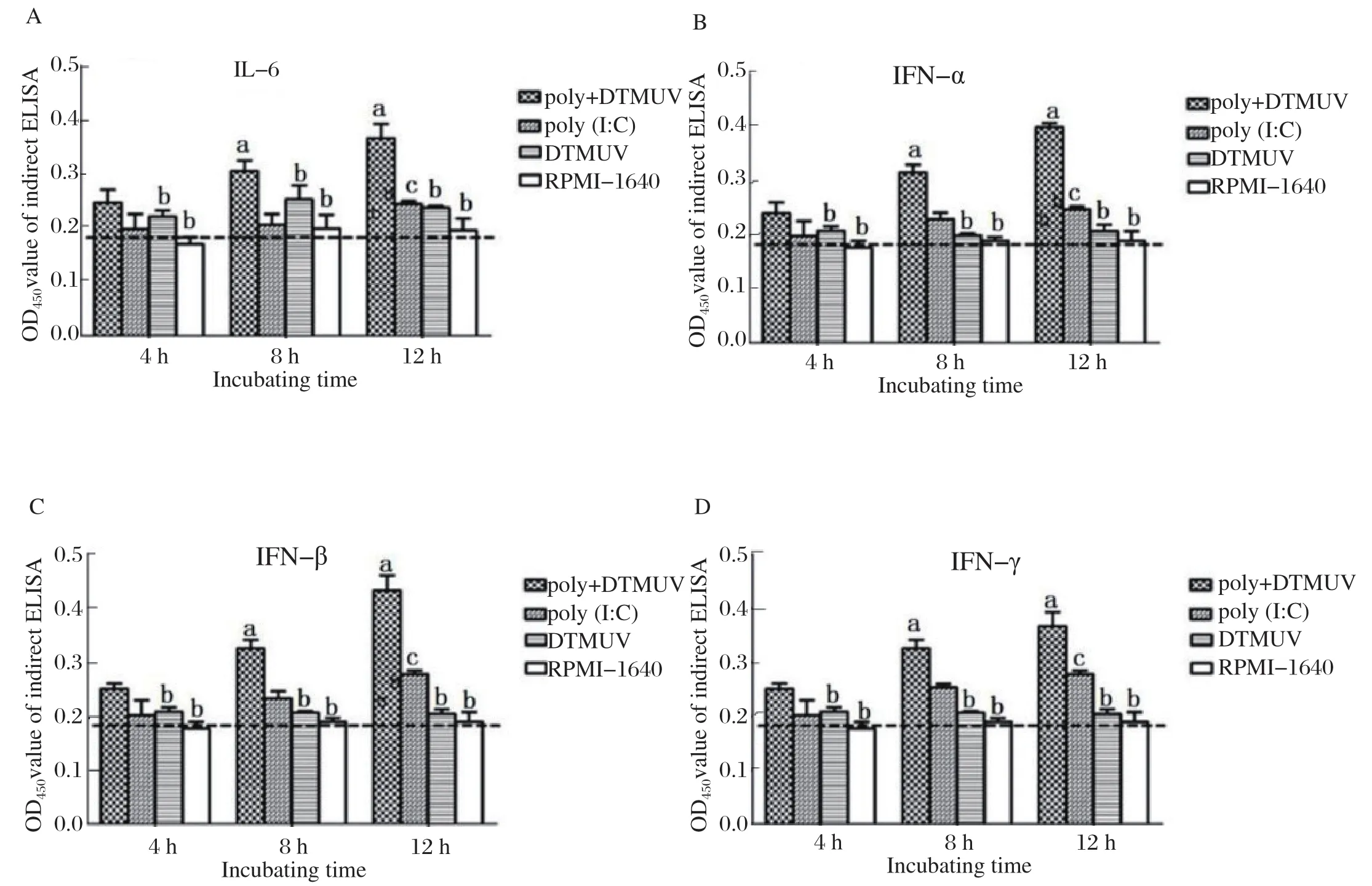
图3 不同时间细胞因子的蛋白表达水平Fig.3 Protein expression levels of different cytokines at different times
2.4 鸭PBMC中信号蛋白TLR3、TRIF、MyD88和NF-κB转录水平的检测 TLR3配体poly(I:C)与灭活DTMUV的不同组合分别与雏鸭PBMC作用4、8、12 h,荧光定量PCR检测各组TLR3、TRIF、MyD88及NF-κB的转录水平,结果如图4所示。灭活DTMUV孵育 组和RPMI-1640对照组,TLR3、TRIF、MyD8 8及NF- κB的转录水 平,即mRNA的表达量始终保持在本底水平。与灭活DTMUV孵育组、RPMI-1640对照组相比,poly(I:C)+灭活DTMUV孵育组中,TLR3、TRIF的mRNA转录水平在8 h和12 h升高显著(P<0.05);MyD88 mRNA转录水平升高不明显;NF-κB的mRNA的转录水平8 h明显升高,12 h升高显著(P<0.05)。poly(I:C)孵育组中,TLR3和TRIF的mRNA转录水平从8 h开始升高,12 h升高显著(P<0.05),但转录水平均低于poly(I:C)+DTMUV灭活抗原孵育组;MyD88的mRNA转录水平基本没有升高;NF-κB的mRNA转录水平升高不显著。

图4 不同时间信号蛋白的转录水平Fig.4 Transcription levels of different signaling protein at different times
2.5 NF-κB对雏鸭PBMC细胞因子分泌的影响 先用浓度为5 μM的 N F-κB抑制剂BAY11-7082和DMSO分别作用雏鸭PBMC 2 h,再用poly(I:C)与灭活DTMUV的不同组合分别孵育雏鸭PBMC,荧光定量PCR检测细胞因子(IL-6)和干扰素(α-IFN、β-IFN、γ-IFN)mRNA的相对表达量,结果如图5所示。poly(I:C)+灭活DTMUV组和poly(I:C)组,NF-κB抑制剂作用组,各细胞因子mRNA的转录水平较未作用组下降显著(P<0.05)。而灭活DTMUV孵育组和RPMI-1640对照组,NF-κB抑制剂作用组和未作用组,各细胞因子mRNA的转录水平始终处于较低水平。以上结果表明,NF-κB对poly(I:C)+灭活DTMUV孵育组细胞因子和干扰素的产生发挥重要的调节作用。
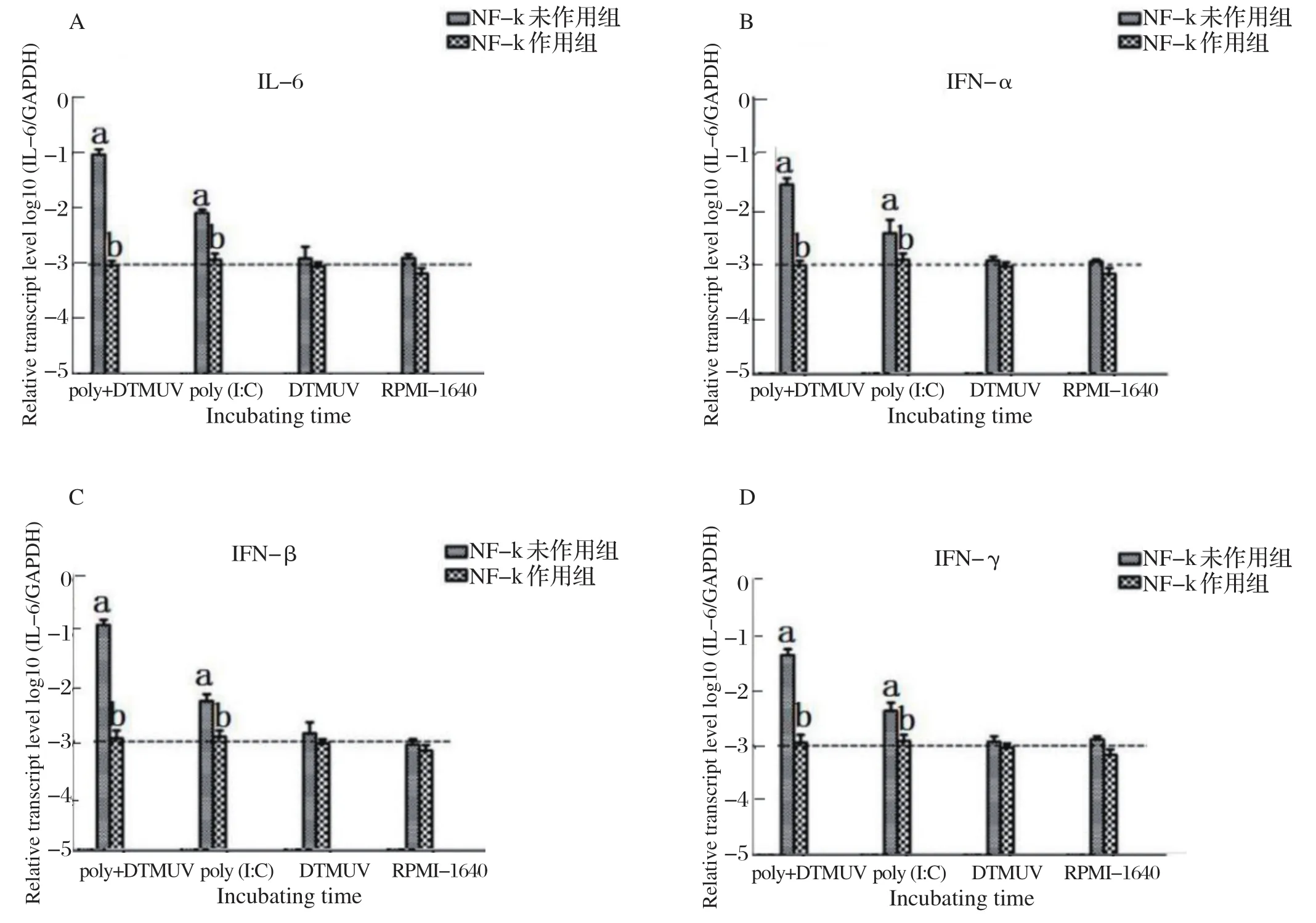
图5 NF-κB抑制后细胞因子的转录水平Fig.5 Transcription levels of different cytokines after the inhibition of NF-κB
3 讨论
DTMUV感染是近年来我国出现的一种水禽病毒性传染病,其他禽类偶尔也能感染。由于该病传播快,肉鸭、蛋鸭均可感染,尤其是肉鸭感染后易继发细菌病,造成的死淘率高,蛋鸭感染后对产蛋率和蛋的品质影响大,给养鸭业造成严重危害[16]。DTMUV灭活疫苗的成功研制为临床上有效防控该病奠定基础,灭活苗具备安全性好,使用方便,而且免疫保护力维持时间长等优势;但灭活苗也存在难以诱发良好的细胞免疫,诱发免疫保护力较迟等缺点。因此,增强DTMUV灭活苗的免疫水平,诱导更持久和水平更高的免疫保护力,可通过选择免疫佐剂或免疫增强剂来实现。据报道,TLR3配体Poly(I:C)作为佐剂与火鸡疱疹病毒疫苗一同免疫鸡群后,机体对马立克病的抵抗力显著增强[17]。对禽流感病毒来说,Poly(I:C)能抑制其脱壳,上调1型干扰素、IL-8等表达的作用[18]。这些研究结果均表明TLR3配体具有增强宿主免疫力的作用,可作为禽类病毒疫苗的备选佐剂。本研究通过利用TLR3配体poly(I:C)与灭活DTMUV共同孵育雏鸭PBMC,揭示TLR3配体的免疫增强机制,可为临床上DTMUV灭活苗免疫增强剂的选择提供依据,为有效预防DTMUV感染及该病的早期防控奠定基础。
病原体感染后,TLRs在控制先天性免疫和获得性免疫中发挥重要的作用。TLRs受体能激活TLRs,从而增强抗原递呈细胞如树突状细胞的成熟,树突状细胞(DCs)与T细胞相互作用后,可以促进T细胞的免疫应答,引起不同细胞因子的大量表达[19]。作为TLR3的受体poly(I:C),可以激活TLR3,募集TRIF与TLR3结合,激活下游信号通路,引起细胞因子和干扰素的表达。由于TLRS主要在单核细胞、淋巴细胞、巨噬细胞、树突状细胞等表面表达,因此本研究中选择雏鸭PBMC作为研究对象。TLR3配体poly(I:C)与灭活DTMUV共同孵育雏鸭PBMC 4、8、12 h后,细胞因子IL-6和干扰素IFN-α、IFN-β、IFN-γ的mRNA转录水平和蛋白表达均升高。虽然poly(I:C)组的IL-6及干扰素mRNA的表达水平从孵育4 h后也开始升高,但与poly(I:C)+灭活DTMUV孵育组相比,转录水平低,且差异显著(P<0.05)。而灭活DTMUV组和RPMI-1640对照组,各细胞因子和干扰素mRNA的转录水平始终维持在本底水平。可见,poly(I:C)可以增强雏鸭PBMC对DTMUV的抗原递呈能力和免疫反应,对灭活的DTMUV有免疫增强效果。
在TLRs家族中,只有TLR3的信号传导是不依赖髓样细胞分化因子(MyD88)途径[20]。TLR3通过胞浆内的接头蛋白TRIF,激活三种转录因子IRF-3、NF-κB和AP-1的表达,从而诱导Ⅰ型干扰素、细胞因子的产生及DC细胞的成熟[21]。为进一步研究TLR3配体poly(I:C)与灭活DTMUV孵育雏鸭PBMC后细胞因子和干扰素的产生机制,将TLR3配体与灭活DTMUV的不同组合与雏鸭PBMC分别孵育4、8、12 h,荧光定量PCR检测各组细胞的TLR3、TRIF、MyD88及NF-κB的转录水平。poly(I:C)+灭活DTMUV孵育组中,TLR3、TRIF的mRNA转录水平升高显著(P<0.05);MyD88m的mRNA转录水平升高不明显;NF-κB的mRNA的转录水平升高明显。poly(I:C)孵育组中,TLR3和TRIF的mRNA转录水平也升高,但均低于poly(I:C)+灭活DTMUV孵育组。可见,TLR3配体poly(I:C)通过与TLR3结合,激活了TRIF-NF-κB通路,从而引起细胞因子和Ⅰ型干扰素的产生。
如果NF-κB的磷酸化受到抑制,也就抑制了NF-κB信号通路的激活。本研究中,经BAY11-7082 抑制后的poly(I:C)+灭活DTMUV组的雏鸭PBMC,细胞因子和干扰素mRNA的转录水平显著降低,可见NF-κB对poly(I:C)+灭活DTMUV孵育组细胞因子和干扰素的产生发挥重要的调节作用。这也表明TLR3配体poly(I:C)通过NF-κB依赖性的信号通路引起相关细胞因子和Ⅰ型干扰素的产生。总之,TLR3配体通过激活雏鸭PBMC中TRIF-NF-κB信号通路显著提高了细胞因子和Ⅰ型干扰素的表达,TLR3配体增强了雏鸭PBMC捕获灭活DTMUV的能力,增强了PBMC的免疫功能,可作为DTMUV灭活疫苗的新型候选佐剂。
