野猪源奇异变形杆菌的分离鉴定及致病性分析
2022-03-14刘妍罕曾茂芹程振涛粟海军
刘妍罕,曾茂芹,张 飘,杨 霞,杨 颖,2,程振涛,2,粟海军,文 明,2
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省动物生物制品工程技术研究中心,贵阳 550025;3.贵州大学林学院,贵阳 550025)
野猪属国家二级保护动物,是受国家保护的有益的或者有重要经济、科学研究价值的陆生野生动物之一,主要集中分布于黑龙江省、辽宁省、吉林省、福建省、广东省、云南省、贵州省等省份。贵州属亚热带地区,高海拔,低纬度,冬无严寒,夏无酷暑,是野猪生存的绝佳之地。由于野猪食谱较为复杂,在野外环境中可食用野草、昆虫、鸟蛋、腐肉等,也可捕食老鼠、蝎子、蛇等,因此能够携带或感染多种病原微生物[1-4]。
奇异变形杆菌(Proteus mirabilis)是一种革兰氏阴性杆菌,为肠杆菌科变形杆菌属成员,广泛存在于水、土壤和粪便中,是人兽共患的条件致病菌。奇异变形杆菌具有显著的周期性群集运动(swarming motility,SM)能力,附着固体表面能力强,极易传播[5-6]。奇异变形杆菌感染可引起人体中枢系统疾病和尿路综合症,也是诱发儿童脑膜炎和慢性中耳炎的重要病原体,同时还会导致成人和婴幼儿严重腹泻,是引起食物中毒的主要病原菌之一。2019年9月至2020年2月,在贵州省林业与草原局安排和指导下,本研究室开展了贵州野猪资源调查及其携带病原微生物种类的分析。本文对采集的15份野猪肝脏样本进行了细菌分离鉴定,并发现奇异变形杆菌是野猪携带的重要优势菌,本研究为贵州地区野猪流行病学调查提供科学依据。
1 材料与方法
1.1 样本来源 从贵州省毕节市七星关区、黔东南州雷山县、遵义市道真县等地捕获野猪,无菌采集肝脏组织样本15份,冷藏保存,及时送到贵州省动物疫病研究室备用。
1.2 主要试剂及试验动物 普通琼脂培养基、鲜血琼脂培养基等由贵州省动物疫病研究室自制;麦康凯琼脂培养基、BHI培养基、微量生化鉴定管、药敏纸片等购自杭州微生物试剂有限公司;革兰氏染色液购自北京索莱宝科技有限公司;2× Taq PCR MasterMix、 细菌基因组提取试剂盒等,购自天根生化科技(北京)有限公司;DL2000 DNA marker,购自宝生物工程(大连)有限公司;清洁级昆明小鼠,雄性,5~6周龄,每只23 g左右,购自贵州医科大学动物试验中心。
1.3 细菌分离培养与生化鉴定 用接种环无菌挑取野猪肝脏组织样本,划线接种鲜血培养基,37℃恒温培养18~24 h,观察细菌生长情况;若有细菌生长,挑取单个菌落,革兰氏染色镜检,同时划线接种鲜血培养基、麦康凯培养基和普通培养基上,观察细菌的生长特性;将菌液接种于各细菌微量生化鉴定管,37℃恒温培养24~48 h,观察和判定结果。
1.4 16S rRNA基因的PCR扩增及序列分析 提取分离细菌基因组作为DNA模板,采用细菌16S rRNA序列通用引物27F/1492R(27F:5′-AGAGTTT GATCATGGCTCAG-3′;1492R:5′-TACGGTTACC TTGTTACGACTT-3′)进行PCR扩增,PCR产物纯化回收后由生工生物工程(上海)股份有限公司测序,将测序成功的16S rRNA基因序列运用BLAST程序进行检索,选取4株核苷酸同源性较高的序列与测序结果进行分析。
1.5 药敏试验 参照美国临床和试验室标准协会(Clinical and laboratory standards institute,CLSI)2018标准,采用K-B纸片扩散法测定分离菌对临床常用抗生素的敏感性。
1.6 毒力基因检测 参照Sun等[7,16]方法,分别合成10种毒力因子的特异性引物,即:MPR菌毛主要结构亚单位(mrpA)、编码尿素酶的功能亚单位(ureC)、金属蛋白酶的主要功能亚单位(zapA)、溶血素基因(hpmA)、尿道上皮粘附素结构亚单位(ucaA)、Pmf菌毛主要结构亚单位(pmfA)、适温菌毛结构亚单位(atfA)、代谢调控基因(rsmA)、鞭毛基因(FiiL)和“雾蔓”迁徙能力调节因子(rsbA),毒力基因引物由生工生物工程(上海)有限公司合成,引物序列及其扩增片段大小(见表1)。提取分离菌株基因组,采用毒力基因引物进行PCR扩增,凝胶成像系统观察结果。

表1 奇异变形杆菌毒力基因引物序列Table 1 Primer sequence of Proteus mirabilis virulence gene
1.8 动物致病性试验 将健康小鼠分为7组,每组5只,其中6组为感染组,一组为对照组,6株菌分别对应6个感染组,感染组腹腔注射0.4 mL菌悬液(1×107CFU/mL),对照组腹腔注射0.4 mL生理盐水;接种12 h后观察小鼠发病死亡情况,并从死亡小鼠的心脏、肝脏、脾脏、肾脏中再次分离病原菌,同时对发病小鼠的肝脏和肠道做病理组织切片。
2 结果
2.1 细菌的分离及形态特征 经鲜血培养基分离培养后,分离菌的菌落呈圆形、中间隆起、四周湿润、半透明状、出现扩散性生长;普通琼脂平板上培养后,菌落呈圆形,大小不一;麦康凯培养基上菌落无扩散性生长现象,有强烈腐臭味。革兰氏染色镜检可见短杆状或球杆状的革兰氏阴性小杆菌(图1)。
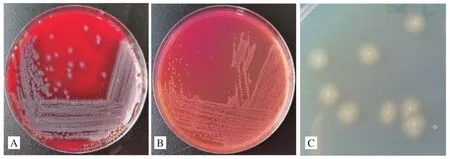
图1 分离菌株菌落形态Fig.1 Colony morphology of isolated strains
2.2 生化试验结果 对分离菌株进行生化试验,结果显示:6株菌株对硫化氢、葡萄糖酸盐、MR、枸橼酸盐、尿素、葡萄糖、赖氨酸、鸟氨酸、木糖和氨基酸呈阳性反应,而对苯丙氨酸、蛋白胨水、棉子糖、山梨醇和侧金盏花醇呈阴性反应,对半固体琼脂动力反应不定。经比对后发现,6株分离菌株的生化特性与奇异变形杆菌基本一致(表2)。
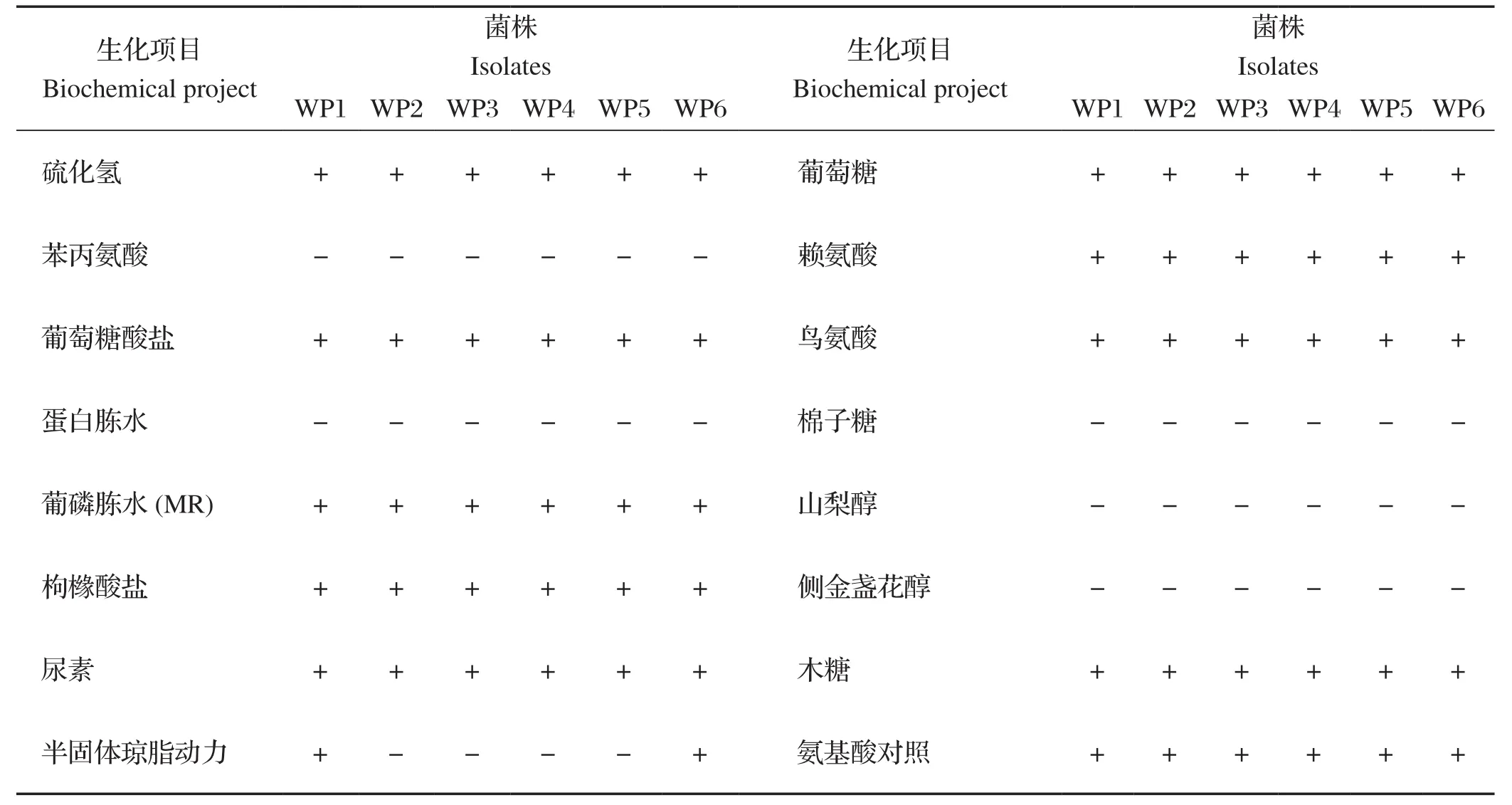
表2 分离菌株生化鉴定结果Table 2 Biochemical identification results of isolated strains
2.3 16S rRNA 基因的PCR扩增及同源性和遗传进化分析结果 经细菌16S rRNA通用引物PCR扩增,6株分离菌均可得到与预期大小相一致的DNA片段(图2),测序显示扩增片段均为1435 bp;经Blastn比对显示,6株分离株16S rRNA 基因片段与家猪来源的奇异变形杆菌菌株同源性均在98%以上,经构建系统发育树发现,6株分离菌株与奇异变形杆菌聚为同一分支,而与大肠杆菌亲缘关系较远(图3)。结合生化鉴定结果,判定6株分离菌均为奇异变形杆菌,命名为WP1、WP2、WP3、WP4、WP5、WP6。
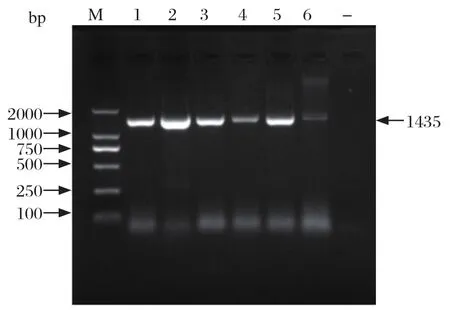
图2 分离菌株16S rRNA基因的PCR扩增结果Fig.2 PCR amplification results of 16S rRNA gene of isolated strains
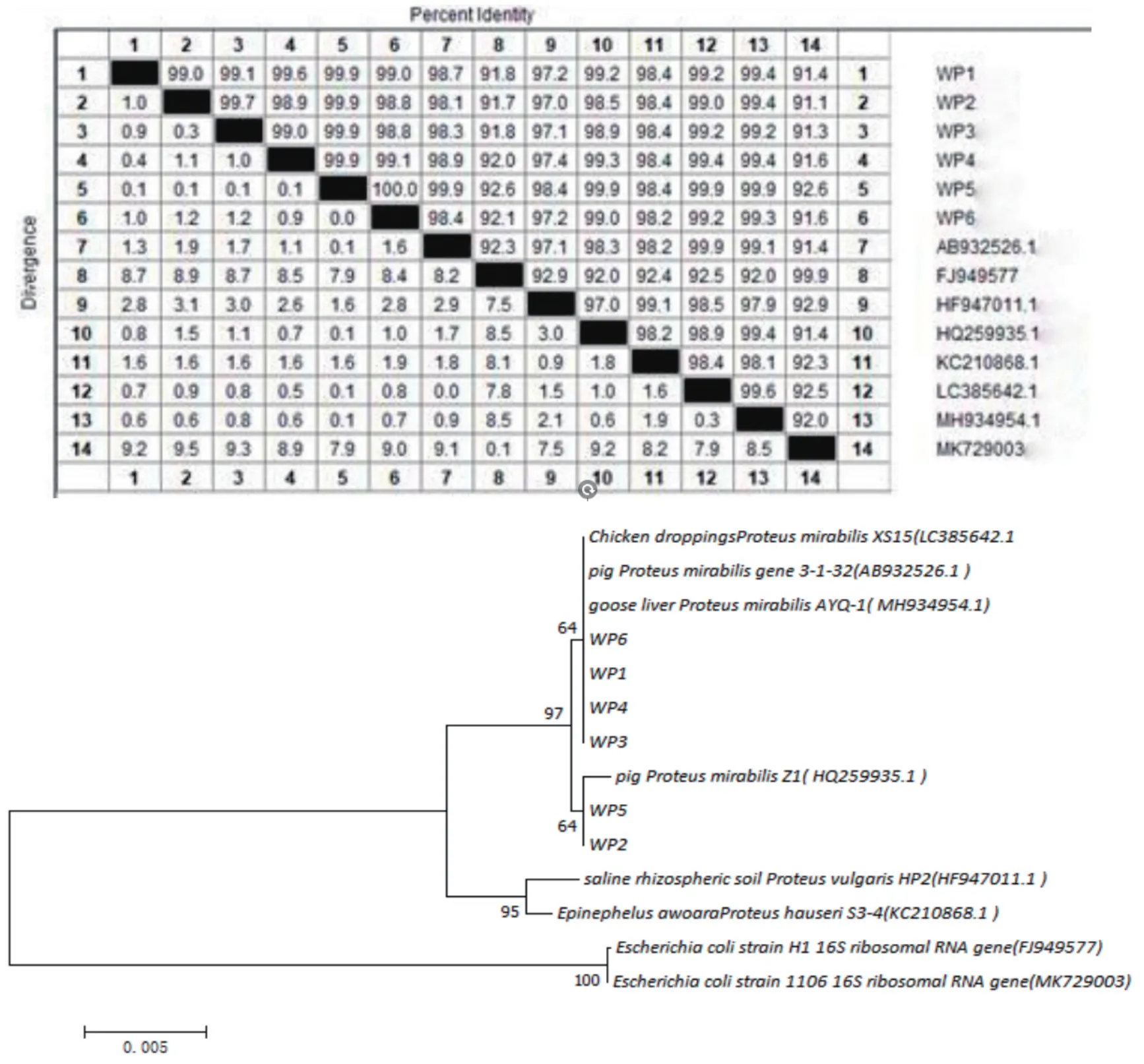
图3 分离菌株16S rRNA基因遗传进化树Fig.3 Genetic evolutionary tree of isolated strain 16S rRNA gene
2.4 药敏试验结果 通过K-B纸片扩散法测定结果显示:6株奇异变形杆菌分离株对诺氟沙星、头孢他啶、氧氟沙星、丁胺卡那和氟苯尼考高度敏感,对环丙沙星和头孢曲松中介,而对多西环素、头孢氨苄、复方新诺明等16种药物呈耐药,表明分离菌有多重耐药性(表3)。
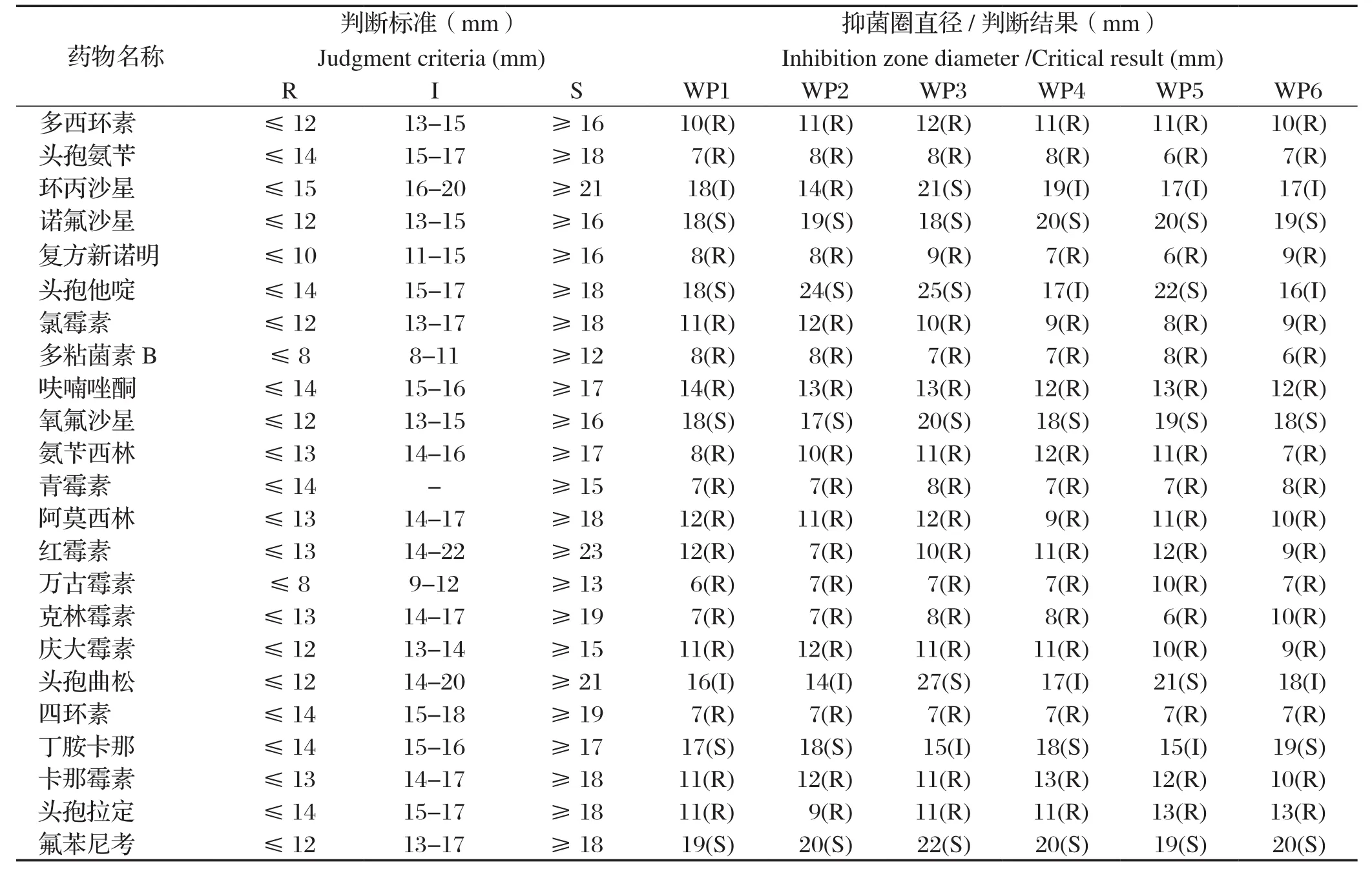
表3 6株奇异变形杆菌分离株药敏试验结果Table 3 Drug susceptibility test results of 6 strains of Proteus mirabilis
2.5 毒力基因PCR鉴定结果 毒力基因检测结果显示:有4株分离菌同时携带mrpA、rsbA、ureC、zapA、rsmA、hpmA、FIiL、ucaA、pmfA和atfA 10种毒力基因,扩增片段分别为550 bp、425 bp、310 bp、525 bp、545 bp、635 bp、770 bp、580 bp、618 bp和385 bp(图4),与预期结果相符;其余2株分离菌未检出rsmA和rsbA毒力基因,结果表明该分离菌携带多种毒力因子。
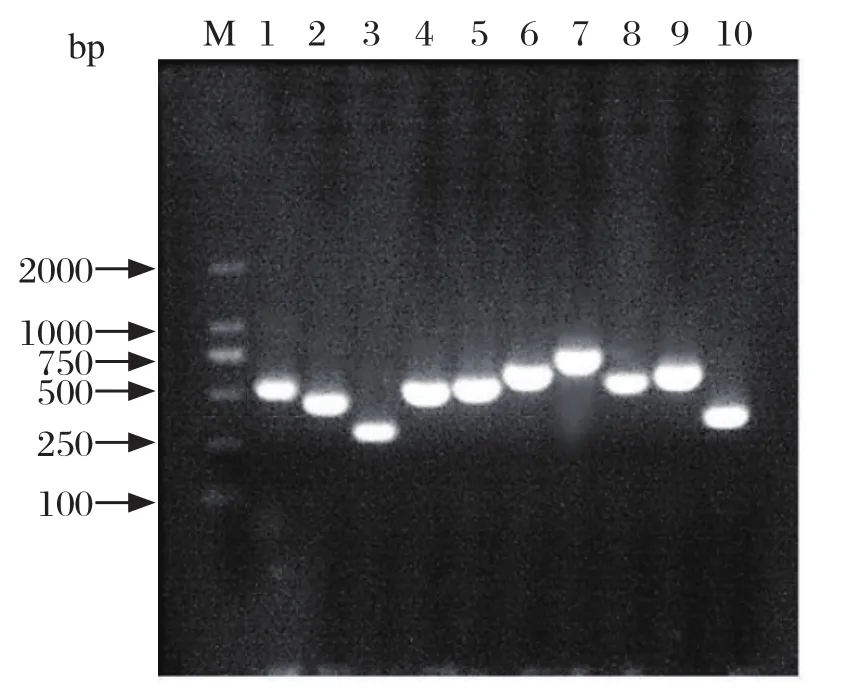
图4 6株奇异变形杆菌分离株毒力基因PCR扩增结果Fig.4 PCR amplification results of virulence genes of 6 Proteus mirabilis isolates
2.6 动物致病性试验 6组感染组的小鼠在3 h后均出现扎堆、精神沉郁、反应迟钝、眼有分泌物等症状,接种后12~24 h小鼠全部死亡;对照组小鼠无任何症状,全部存活。解剖死亡小鼠可见肝脏淤血肿大、肠鼓气、肠道充血等病理变化。取死亡小鼠肝脏和肠道组织制作切片,经HE染色可见死亡小鼠大肠肠绒毛脱落(图6-A)、有炎性细胞浸润(图6-B)、肠绒毛断裂(图6-C)等;肝细胞核破碎和溶解(图6-D),肝细胞脂肪变性(图6-E),肝小叶窦状间隙扩张,充满血液(图6-F)等;对照组小鼠肝脏被膜完整,肝细胞分叶不明显,肠黏膜上皮未见明显病理变化及炎性细胞浸润(图6-G、6-H、6-I)。经分离培养和鉴定,均可从死亡小鼠的心脏和肝脏组织中分离得到奇异变形杆菌。上述结果表明该菌有一定的致病性。
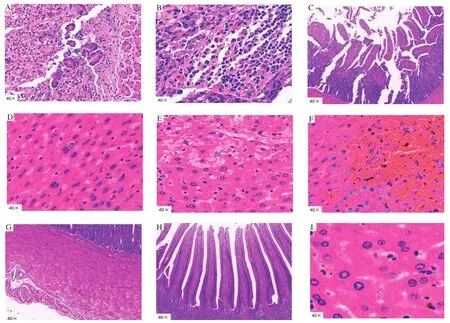
图6 感染小鼠病理切片观察结果Fig.6 Observation results of pathological sections of infected mice
3 讨论
奇异变形杆菌(Proteus mirabilis)为肠杆菌科(Enterobacteriaceae)变形杆菌属(proteus species)成员,同属还有普通变形杆菌、莫根变形杆菌、雷极变形杆菌和无恒变形杆菌等,其中奇异变形杆菌和普通变形杆菌是动物肠道中仅次于大肠埃希氏菌的条件致病菌,可引起败血症、腹膜炎、食物中毒等多种病症。由于奇异变形杆菌具有明显多形性的革兰氏阴性小杆菌,一般仅依靠形态学观察很难鉴定,必须通过生化鉴定、基因分子鉴定和动物感染试验等才能判定[7-9]。奇异变形杆菌除了存在于人和动物肠道中外,在土壤和水环境中广泛存在,并能从饲养的猪、牛、鹅、山羊、兔、水貂、狐狸等动物中分离得到奇异变形杆菌[10-13],但目前很少见到有关野猪体内奇异变形杆菌分离鉴定的报道。
本试验通过分离培养、生化鉴定和16S rRNA序列测定分析,证实从贵州各地捕获的野猪体内普遍存在奇异变形杆菌,并且分离菌株普遍存在mrpA、rsbA、ureC、zapA、rsmA、hpmA、FIiL、ucaA、pmfA和atfA等毒力基因,这与相关研究资料报道的奇异变形杆菌分离株携带毒力基因情况相似[14-17];小鼠感染试验显示,野猪源奇异变形杆菌分离株能在12~24 h内致死小鼠,说明野猪源奇异变形杆菌分离株具有较强的致病性。尹有琴[17-18]报道的番鸭源奇异变形杆菌分离株和牛源奇异变形杆菌分离株均具有较强的致病性。由此可见,不同动物来源的奇异变形杆菌分离株都有致病力。近年来,随着生态环境的不断改善,全国各地野猪数量不断增加,野猪觅食范围不断扩大,并时有野猪危害庄稼和攻击村民的报道,野猪与家养畜禽和人类的联系不断加大,增加了野猪携带的病原微生物特别是奇异变形杆菌感染畜禽和人的风险。因此,必须加强野猪疾病特别是奇异变形杆菌病的预防与控制,减少野猪携带病原微生物的传播与流行,避免造成较大的经济损失和潜在的卫生安全。
本次试验检测发现,分离得到的野猪源奇异变形杆菌分离株对多西环素、头孢氨苄、复方新诺明、氯霉素等10多种抗生素具有明显的耐药性,这与相关研究报道的鹅源、牛源和猪源奇异变形杆菌分离株的耐药情况基本一致[19-25],但本次分离菌株均来自捕获得到的野猪体内,而野猪生活在野外环境中,未服用过抗生素类药物,这说明贵州省野猪生存环境与人们生活环境界限模糊。野猪体内携带的奇异变形杆菌耐药性来源可能是人和畜禽,特别是生态养殖畜禽携带具有一定耐药性的病原菌排出体外,通过污水和土壤污染周围环境,野猪间接接触而感染到具有耐药性的病原菌。由此可见,应加强对畜禽抗生素的使用管理,减少耐药菌株的产生和传播,同时注意做好畜禽养殖环境污染控制,这对保护野生动物资源具有重要的意义。
本研究通过对野生野猪源奇异变形杆菌的分离鉴定、药敏试验、毒力基因进行研究,在野生野猪肝脏中分离出6株多重耐药奇异变形杆菌,为野猪源病原菌的致病性及耐药性研究奠定基础。
