胸腔积液LPS、IL-35、RORα表达在结核性胸膜炎、恶性胸膜炎鉴别诊断中的价值
2022-03-05雷朝君蒋晨春高妩媚
雷朝君 蒋晨春 高妩媚
胸膜炎是由于炎症、肿瘤等各种因素刺激胸膜所产生的胸膜炎症,其主要病因为结核和恶性肿瘤[1]。对于结核性胸膜炎和恶性胸膜炎早期做出鉴别,对于临床采取针对性干预措施改善预后具有重要意义,目前对于结核性胸膜炎和恶性胸膜炎的鉴别,多依赖于结核分枝杆菌检测或胸膜组织活检,但胸腔积液中结核分枝杆菌较少,常规检测方法难以检测出来;胸膜穿刺活检会对患者带来一定创伤,且标本采集困难,可重复性差[2]。近年来生物标志物逐渐应用于胸膜炎的诊断,虽然目前国内外尚未发现单一、有效的鉴别良恶性胸膜炎的生物学标志物,但多种生物标志物联合检测有望大幅度提高良恶性胸膜炎的鉴别诊断准确性[3]。脂多糖(Lipopolysaccharide,LPS)是构成革兰氏阴性菌细胞壁的主要成分,在结核局部免疫炎症反应中发挥重要作用[4];维甲酸相关孤儿受体α(retinoic acid related orphan receptor α, RORα ) 也是一种与结核病的发生密切相关的小分子调控蛋白,可对机体的多种生理过程发挥调节作用[5];白细胞介素(Interleukin,IL)-35是一种对炎症反应、细胞增殖具有抑制作用的细胞因子,与感染性疾病、自身免疫性疾病的病情发展有一定关系[6]。近年来国内研究表明,胸腔积液中LPS、IL-35、RORα与结核性胸膜炎病情密切相关[7-8]。但三种生物标志物能否用于结核性胸膜炎与恶性胸膜炎鉴别诊断尚不得而知。本研究对比分析结核性胸膜炎、恶性胸膜炎患者胸腔积液中LPS、IL-35、RORα表达情况,探讨三种生物标志物单独和联合检测,在结核性胸膜炎和恶性胸膜炎鉴别诊断中的价值。
资料与方法
一、 一般资料
前瞻性纳入本院2017年1月至2020年12月收治的结核性胸膜炎患者126例(良性组),男性72例,女性54例,年龄最小19岁,最大77岁,平均(57.32±9.79)岁。并选择同期与本院接受诊治的恶性胸膜炎患者88例(恶性组),其中男51例,女37例,年龄最小20岁,最大78岁,平均(57.86±9.73)岁,致病原因:肺癌胸腔转移47例,胃癌胸腔转移16例,胸膜间皮瘤11例,子宫内膜癌胸腔转移8例,卵巢癌胸腔转移6例。纳入标准:①年龄>18岁;②胸腔积液为渗出液;③良性组符合《肺结核诊断和治疗指南(2001年订)》[9]中结核性胸膜炎的诊断标准,并由结核分枝杆菌细菌学检查或病理检查确诊;④恶性组经细胞学或病理学检查确诊;⑤初次接受诊治;⑥自愿参加本研究,并签署协议书。排除标准:①未获得明确诊断;②入组前曾接受相关治疗;③合并肺炎、肺脓肿等其他感染性疾病;④合并凝血系统疾病;⑤合并心肝肾严重器质性疾病或内分泌疾病、自身免疫性疾病、代谢性疾病、精神类疾病等。⑥妊娠或哺乳期女性。
二、方法
两组患者均于无菌条件下进行胸腔穿刺术,术前经超声定位引导,常规消毒、铺单,局麻下将穿刺针穿入胸腔,抽取胸腔积液约10mL,试管肝素抗凝,以3000r/min转速离心10min,离心半径r=12cm,室温下静置60min,分离上清液置于-80℃冰箱内待测,免疫荧光法测定胸水腺苷脱氨酶(Adenosine deaminase, ADA)含量,应用酶联免疫法测定胸水LPS、IL-35、RORα、鳞癌抗原(squamouse cell carcinoma antigen、SCC)神经源特异性烯醇化酶(neuron-specific enolase,NSE)含量,具体操作:在微孔酶标板上设10个标准孔,将稀释的标准品按照浓度顺序依次加样,稀释后各孔加入待测样品50μl,37℃下孵育30min,缓冲液洗涤5次,之后每孔加入酶标试剂50μl,再次按上述过程进行孵育、洗涤,先后加入显色剂A和显色剂B各50μl,混匀后避光显色15min,每孔各加入终止液50μl,终止反应后以450nm波长测量各孔吸光度。LPS、RORα试剂盒由南京森贝伽生物科技有限公司提供, IL-35、CA125、SCC、NSE试剂盒由深圳晶美生物制品有限公司提供,实验过程均严格按照试剂盒说明书进行。并测定两组胸腔积液中白蛋白、乳酸脱氢酶(LDH)含量及白细胞计数和单核细胞计数。
三、观察指标
比较良性组、恶性组年龄、性别、体质量指数、吸烟史、饮酒史、胸腔积液的实验室检查等临床资料,将上述组间比较有统计学意义的资料带入logistic回归模型,采用多因素logistic回归分析良性胸膜炎发生的影响因素。绘制受试者工作特征(ROC)曲线,评价胸水LPS、IL-35、RORα单独和联合应用对结核性胸膜炎和恶性胸膜炎鉴别诊断价值。
四、 统计学方法
应用SPSS23.0软件分析统计数据,计量资料以均数±标准差表示,组间比较应用t检验,计数资料以频数表示,组间比较应用χ2检验,良性胸膜炎发生的影响因素应用多因素logistic回归分析,ROC曲线评价胸水LPS、IL-35、RORα对结核性胸膜炎和恶性胸膜炎的鉴别诊断价值,三项指标联合应用与各项指标单独应用ROC曲线面积的比较应用Z检验,P<0.05为差异有统计学意义。
结 果
一、两组临床资料比较
良性组胸水ADA、LDH、LPS、IL-35、RORα含量及白细胞计数、单核细胞计数均显著高于恶性组,差异有统计学意义(P<0.05),两组性别、年龄、体质量指数、吸烟史、饮酒史、胸水SCC、NSE含量差异均无统计学意义(P>0.05)(见表1)。
二、结核性胸膜炎发生影响因素分析
以发生结核性胸膜炎为因变量,以表1中具有统计学意义的变量为自变量,将正常值作为分界点分别赋值1和0(见表2)。多因素logistic回归分析显示胸水中LPS、IL-35、RORα是结核性胸膜炎的影响因素(见表3)。

表1 良性组和恶性组临床资料比较

表2 表1中自变量的赋值表
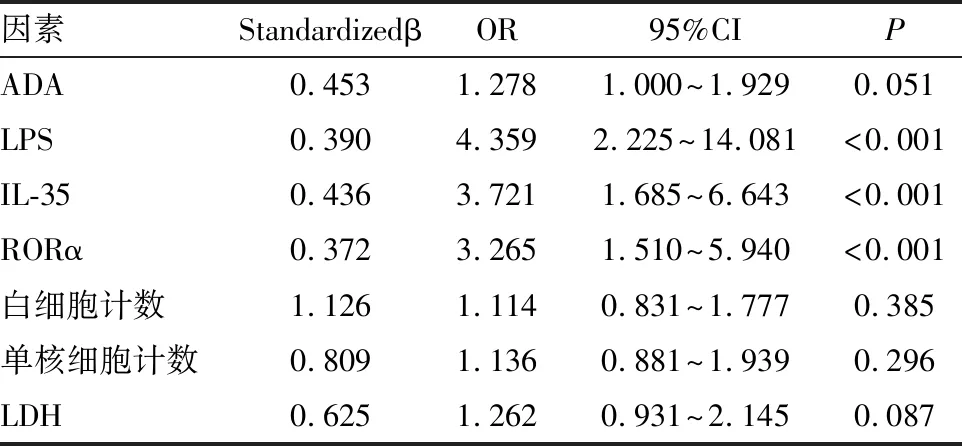
表3 良性胸膜炎多因素logistic回归分析结果
三、胸水LPS、IL-35、RORα在结核性胸膜炎和恶性胸膜炎鉴别诊断中的价值
绘制受试者工作特征曲线,显示胸水LPS、IL-35、RORα鉴别结核性胸膜炎和恶性胸膜炎的ROC曲线下面积分别为0.683、0.602、0.647,三项指标联合应用ROC曲线下面积为0.903,三项指标联合应用鉴别结核性胸膜炎和恶性胸膜炎价值均高于各指标单独应用(P<0.05),差异均有统计学意义(见图1、表4、5)。

表4 胸水LPS、IL-35、RORα单独和联合应用鉴别结核性胸膜炎和恶性胸膜炎的价值

图1 胸水LPS、IL-35、RORα单独和联合应用鉴别结核性胸膜炎和恶性胸膜炎的ROC曲线
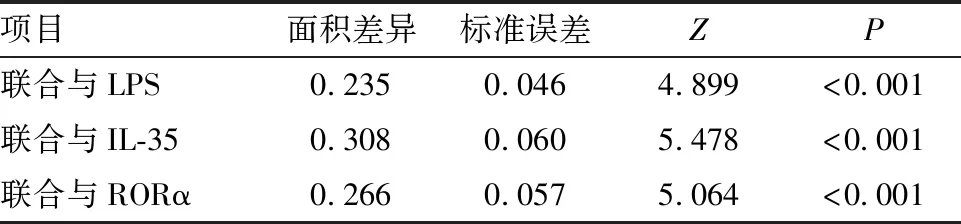
表5 胸水LPS、IL-35、RORα单独和联合应用鉴别结核性胸膜炎和恶性胸膜炎的价值比较结果
讨 论
胸膜积液是胸部多种疾病的并发症,肺部、胃肠道、女性生殖系统、乳腺等多部位的恶性肿瘤及结核性胸膜炎、肺炎等多种良性炎症性疾病均可导致胸腔积液的发生[10]。结核性胸腔积液和恶性胸腔积液(包括转移瘤、间皮瘤)是渗出性胸腔积液的最为常见原因。且两种原因所致胸膜炎性反应的临床特点、影像学检查及实验室检查结果相似,鉴别诊断存在一定困难[11-13]。结核性胸膜炎是由结核分枝杆菌入侵胸膜腔所致的胸膜炎性反应性疾病,是丙类法定传染病;而恶性胸膜炎是由恶性肿瘤细胞刺激胸膜所产生的胸膜炎症,是恶性肿瘤进展至晚期的常见并发症,恶性胸膜炎的发生往往提示机体存在全身转移,患者生存期缩短[14],结核性和恶性胸膜炎对机体产生的影响不同,其治疗方法也存在很大差异,因此对于结核性和恶性胸膜炎早期鉴别诊断对于临床治疗方案的选择至关重要。目前临床医师对于结核性和恶性胸膜炎的鉴别主要结核分枝杆菌检出或胸膜组织穿刺活检,但胸腔积液中结核分枝杆菌检出率较低,且细菌培养时间较长;胸膜穿刺存在一定创伤,可重复性差,且多数检测结果特异性较差[15]。寻求敏感、特异性好的生物学指标或几种生物学治疗联合应用对于结核性和恶性胸膜炎的鉴别诊断具有重要意义。
LPS是革兰氏阴性菌细胞壁的重要组成部分,其主要成分为脂质和多糖,也是革兰氏阴性细菌主要的致病物质。LPS可与细胞膜表面的Toll样受体4结合,并通过特定的信号传导通路激活丝裂原活化蛋白酶信号途径和转录因子κB信号途径,促进炎症介质的大量合成和释放;并可促进血管平滑肌细胞释放IL-8,对中性粒细胞发挥趋化作用;LPS还可刺激动脉外膜的成纤维细胞,使之产生IL-8、调节活化蛋白等多种趋化因子,促进炎症反应的发生和发展[16]。本研究发现良性组胸水LPS含量显著高于恶性组,LPS可能参与了胸膜结核的局部炎症反应和免疫反应,促进了结核性胸腔积液的形成。IL-35是IL-12家族重要组成部分,也是一种具有炎症抑制作用的细胞因子;由调节性T细胞分泌的Ebi3和IL-12的P35亚基组成,可诱导传统的T淋巴细胞分化为抑制性的CD4+Foxp3的调节性T细胞[17]。IL-35可诱导Th1细胞分化免疫病原体的清除,同时还对Th17细胞的增殖具有较强的抑制作用,从而抑制机体过度的免疫应答。Kong等[18]的研究发现活动性肺结核患者机体内IL-35呈现高表达,提示IL-35与肺结核病灶的活动性相关,血液中IL-35含量有望成为活动性肺结核免疫状态、预后评估的有效的生物指标。目前关于IL-35与胸腔积液的相关性研究不多,本研究发现良性组胸水IL-35含量显著高于恶性组,提示IL-35可能在结核性胸膜炎发生机制中发挥了重要的免疫调节作用。RORα是维甲酸相关孤儿受体的重要组成部分,在肾脏、肝脏、脑组织、肺脏等多种脏器中广泛表达,可调控脑组织、淋巴组织的发育等生理过程。研究表明,RORα是参与Th17细胞分化的重要物质之一,RORα激动剂逐渐成为抗炎治疗的重要靶点,研究表明,敲除RORα基因的小鼠对于卵白蛋白诱导的肺部炎症易感性明显降低[19],另有文献报道结核性胸腔积液中RORαmRNA含量显著高于非结核性胸腔积液[20]。本研究结果显示结核性胸膜炎患者胸水中RORα含量高于恶性组,与文献报道一致,表明RORα可能在结核性胸腔积液的形成中发挥了积极的作用。
结核病是一种迟发型过敏反应,胸膜的炎症反应使血管通透性增加,进而大量淋巴细胞和蛋白质进入胸腔积液,本研究发现胸水中LPS、IL-35、RORα含量升高是结核性胸膜炎发生的影响因素,上述3项指标联合检测对于结核性、恶性胸膜炎的鉴别具有较高的临床价值。根据ROC曲线分析结果,胸腔积液同时满足LPS含量>274.34μg/L、IL-35含量>188.48ng/L和RORα含量>147.63μg/L时,诊断为结核性胸膜炎的可能性较大,籍此可与恶性胸膜炎鉴别。
综上所述,结核性胸膜炎胸腔积液中,LPS、IL-35、RORα呈高表达,胸腔积液LPS、IL-35、RORα在结核性和恶性胸膜炎的鉴别诊断中具有较高的临床价值,但具体机制尚需要进一步探讨。
