干扰长链非编码RNA TUG1缓解卵清蛋白诱导的哮喘小鼠肺功能损伤和纤维化以及免疫紊乱
2022-03-05任彦红张凌云赵少聪张广超孙晓敏
任彦红 张凌云 赵少聪 张广超 孙晓敏
哮喘是一种以中性粒细胞等免疫细胞介导的炎症状态,随病程的延长可产生气道不可逆性缩窄和气道重塑,严重影响患者的健康[1],长链非编码RNA(long non-coding RNA, lncRNA)在人类生理与病理中发挥重要作用,与多种疾病密切相关[2]。其中,调节lncRNA TUG1能缓解缺血-再灌注诱导的肾小管上皮细胞炎症和凋亡[3],减轻子宫内膜纤维化和炎症[4],抑制大鼠脊髓缺血再灌注后的炎症损伤[5]。此外,基于前期lncRNA TUG1通过海绵miR-590-5p/FGF1促进哮喘患者气道平滑肌细胞的增殖和迁移的研究[6],提示干扰长链非编码RNA TUG1对治疗哮喘有巨大的潜力及重要的意义。因此,本实验探讨干扰长链非编码RNA TUG1对卵清蛋白诱导的哮喘小鼠肺功能损伤、纤维化以及免疫紊乱的影响,以期为哮喘的临床治疗提供数据参考。
资料与方法
一、材料与仪器
1 实验动物 SPF级Wistar小鼠,四周龄,雄性,体质量25~30 g,动物购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0011。
2 药物与试剂 卵清蛋白,美国Sigma-Aldrich公司;PCR试剂盒、SDS-PAGE蛋白凝胶、细胞裂解液、Trizol试剂,北京索莱宝科技有限公司;总蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、羟脯氨酸(HYP)试剂盒、英国Abcam公司;PBS磷酸缓冲液、生理盐水、多聚甲醛,北京万佳首化生物科技有限公司;Masson胶原染色试剂、苏木精-伊红染色试剂、瑞氏-吉姆萨染色,北京雷根生物技术有限公司;α-SMA、FN、TGF-β1相关抗体,赛默飞世尔科技(中国)有限公司;IFN-γ、IL-4等引物,引物设计参考序列均来源于NCBI及Ensembl数据库,合肥知恩生物技术有限公司;诱导型一氧化氮合酶(iNOS)试剂盒、γ干扰素(IFN-γ)试剂盒、白介素-4(IL-4)试剂盒、白介素-10(IL-10)试剂盒,武汉默沙克生物科技有限公司;AKT等相关抗体,上海碧云天生物技术有限公司。
3 主要仪器 Rt2100c酶标仪,美国BioTeK公司;430c雾化吸入器,上海鱼跃医疗设备有限公司;C100自动细胞计数仪,深圳市瑞沃德生命科技有限公司;KL-B2型石蜡包埋机、S700A石蜡切片机,湖北康龙电子科技有限责任公司;ICX41倒置显微镜,舜宇光学科技有限公司;Microfuge 20低温高速离心机,美国BECKMAN公司;HS1800H-U/W超净工作台,成都市苏净科学器材有限公司;AniRes2005动物肺功能分析系统,北京贝兰博科技公司;SY00992大小鼠体描箱,双玉仪器设备有限公司。
二、方法
1 动物与处理 将小鼠随机分为四组,正常对照组(Control)、模型组(OVA)、阴性对照组(OVA+shRNA-NC)、干扰组(OVA+sh-TUG1)。参考文献建模[7],除正常组注射及雾化吸入相同体积生理盐水外,各组小鼠分腹腔注射0.2mL 1% OVA致敏液, 1周/次,共3次;致敏完成后进行激发,将小鼠置于密闭容器中,5 mL 5% OVA溶液雾化吸入30 min/d,共7 d,建立哮喘动物模型,其中阴性对照组及干扰组小鼠每次在激发前分别腹腔给予2.5 mg/kg shRNA-NC及sh-TUG1,正常对照组及模型组给予相应体积生理盐水。
2 肺功能指标检测 各组小鼠在麻醉状态下进行气管插管,在体描箱内记录静息状态下呼吸通气量,并检测气道阻力改变、肺容积变换指标。
3 支气管肺泡灌洗液、血清、肺组织的收集 各组小鼠在麻醉状态下,用1 mL注射器将预冷的PBS缓冲液通过气管插管缓慢的灌注至双肺,反复冲洗3次,保证灌洗液回吸收率在90%以上。将收集的支气管肺泡灌洗液(bronchoalveolar fluid,BALF)进行离心(4 ℃、1200 r/mim、10 min)并冻存;眼球取血,离心收集上清液;及时解剖,取肺组织,一部分进行蜡块包埋,用于病理形态学观察,剩余部分冻存,用于后续组织蛋白的提取。
4 HE染色观察肺组织 取出包埋处理的组织,用刀片修蜡,组织切片机切片。经水浴展平、将蜡带贴在载玻片上进行烘干。二甲苯脱蜡后,进行苏木精-伊红染色,封片后在显微镜下观察结果。
5 Masson染色观察肺纤维化 取出包埋处理的组织,进行组织切片,二甲苯脱蜡,高浓度到低浓度酒精脱水,Masson胶原染色试剂染色,二甲苯浸泡5 min,封片后在显微镜下观察结果。
6 WB检测肺纤维化指标水平 剩余肝组织制备成匀浆,提取总蛋白。BCA试剂盒进行总蛋白定量,电泳、转膜、脱脂奶粉封闭,加入一抗,4℃孵育过夜,TBST冲洗,加入二抗,TBST冲洗3次,ECL显影后分析灰度值,实验重复3次。
7 试剂盒检测肺组织中HYP含量 取小鼠肝组织剪碎,加入提取液在110℃烘箱内消化6 h ,离心过滤后调节PH为7左右,将标准品梯度稀释,按照HYP含量检测试剂盒进行操作,混匀后水浴20 min,再静置至室温,取溶液在96孔板中,调节波长560nm,酶标仪检测。
8 哮喘小鼠肺组织炎症评分 炎症评分表评估肺组织的炎症程度,参考Underwood标准[8]。
9 检测BALF液中炎症细胞计数情况 BALF液离心后,用PBS重悬。采用血细胞计数板检测总的炎症细胞,取重悬液滴于防脱载玻片上根据试剂盒说明书采用瑞氏-吉姆萨染色来分类,计算各细胞数量。
10 ELISA检测BALF液中炎症因子含量 分别按照iNOS 、IFN-γ 、IL-4 、IL-10试剂盒说明书操作,用酶标仪进行检测。
11 RT-PCR检测BALF液中炎症因子水平 BALF液离心后,用PBS重悬后,用Trizol法提取总的RNA,并测定浓度,按照PrimeScriptTM 1st Strand cDNA Synthesis kit 逆转录试剂盒的说明进行操作,加入相应引物及样品,每组设置三个复孔。用2-△△Ct法计算iNOS mRNA、IFN-γ mRNA、IL-4 mRNA、IL-10 mRNA的相对表达水平。
12 WB检测肺组织中AKT/NF-κB通路的相关蛋白表达 采用AKT、p65等相关一抗,根据2.6的操作进行。
三、统计学分析

结 果
一、干扰lncRNA TUG1对OVA小鼠肺功能损伤的影响
与Control组相比,OVA模型组小鼠的肺容积、静息通气量、气道阻力均显著降低(P<0.05,见图1);与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠的肺容积、静息通气量、气道阻力均显著升高(P<0.05,见图1)。结果提示,干扰lncRNA TUG1能缓解OVA小鼠肺功能损伤。
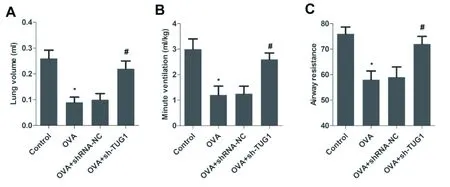
图1 各组对OVA小鼠肺功能损伤的影响与Control组比较,*P<0.05;与OVA组比较,#P<0.05
二、干扰lncRNA TUG1对OVA小鼠肺组织HE染色的影响
Control组小鼠肺组织结构清晰,未见病理形态变化,支气管壁胶原层较薄;OVA模型组肺组织结构明显破坏,肺泡壁结构紊乱,肺泡间隔增厚,肺泡腔缩小,炎性浸润明显;OVA+shRNA-NC组的病理程度与OVA模型组接近;OVA+sh-TUG1组对上述病理状态有一定的缓解,小鼠的肺组织炎性细胞浸润区域较少,肺组织结构完整(见图2)。结果提示:干扰lncRNA TUG1能改善OVA小鼠肺组织的病变程度,缓解OVA小鼠肺部损伤,与3.1结果吻合。
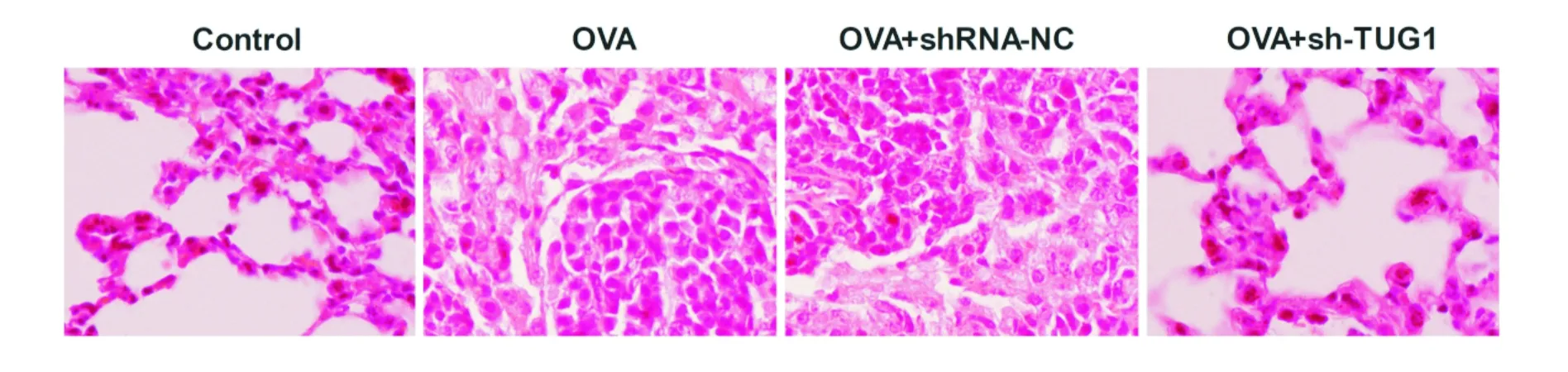
图2 各组对OVA小鼠肺组织HE染色的影响(×100)
三、干扰lncRNA TUG1对OVA小鼠肺纤维化的影响
Control组小鼠肺组织仅有少量胶原,肺泡结构完整,无肺泡内出血;OVA模型组小鼠肺泡内肺泡结构消失,胶原蛋白围绕气管和肺泡大量增殖,导致正常肺泡结构消失或黏连;OVA+shRNA-NC组的纤维化程度与OVA模型组接近;OVA+sh-TUG1组对上述胶原蛋白异常增殖状态有一定的缓解(见图3A)。
与Control组相比,OVA模型组小鼠的α-SMA、FN、TGF-β1蛋白表达显著升高(P<0.05,见图3B-C);与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠的α-SMA、FN、TGF-β1蛋白表达均显著降低,P<0.05。(见图3B-C)。结果提示,干扰lncRNA TUG1能降低OVA小鼠肺纤维化程度。
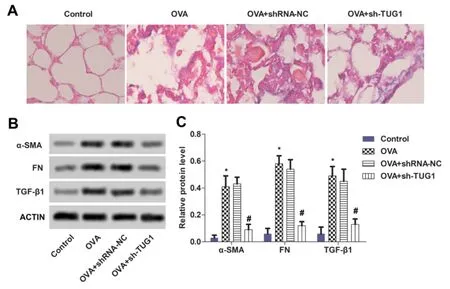
图3 各组对OVA小鼠肺纤维化的影响(×100)与Control组比较,*P<0.05;与OVA组比较,#P<0.05
四、干扰lncRNA TUG1对OVA小鼠肺组织羟脯氨酸(HYP)含量的影响
HYP是机体胶原蛋白主要成分之一,其含量反映胶原组织代谢及纤维化程度。与Control组相比,OVA模型组小鼠的HYP含量显著升高,P<0.05(见图4);与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠的HYP含量均显著降低(P<0.05)(见图4)。结果提示,干扰lncRNA TUG1能减少HYP代谢,降低OVA小鼠肺纤维化程度,与3.3结果吻合。

图4 各组对OVA小鼠肺组织HYP含量的影响与Control组比较,*P<0.05;与OVA组比较,#P<0.05
五、干扰lncRNA TUG1对OVA小鼠肺组织炎症评分的影响
与Control组相比,OVA模型组小鼠的肺组织炎症评分显著升高(P<0.05)(见图5)。与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠肺组织炎症评分显著降低(P<0.05,见图5)。结果提示,干扰lncRNA TUG1能明显缓解OVA小鼠的炎症损伤。

图5 各组对OVA小鼠肺组织炎症评分的影响与Control组比较,*P<0.05;与OVA组比较,#P<0.05
六、干扰lncRNA TUG1对OVA小鼠BALF液中各项细胞指标计数情况
与Control组相比,OVA模型组小鼠的炎症细胞总数、中性粒细胞、淋巴细胞、嗜酸性粒细胞数目显著增加(P<0.05)(见图6)。与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠以上各项炎症细胞数目均显著减少(P<0.05)(见图6)。结果提示,干扰lncRNA TUG1能明显缓解OVA小鼠的炎症损伤,与3.5结果吻合。

图6 各组对OVA小鼠BALF液中各项细胞指标计数的影响与Control组比较,*P<0.05;与OVA组比较,#P<0.05
七、干扰lncRNA TUG1对OVA小鼠BALF液中炎症指标含量的影响
与Control组相比,OVA模型组小鼠的iNOS、IFN-γ、IL-4、IL-10含量均显著升高(P<0.05)(见图7)。与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠的促炎因子iNOS 、IFN-γ含量均显著降低(P<0.05)(见图7A)。抗炎因子IL-4、IL-10含量均显著升高(P<0.05)(见图7B)。结果提示,干扰lncRNA TUG1能明显改善OVA小鼠的炎症程度,与3.5、3.6结果吻合。

图7 各组对OVA小鼠BALF液中炎症指标含量的影响与Control组比较,*P<0.05;与OVA组比较,#P<0.05
八、干扰lncRNA TUG1对OVA小鼠BALF液中炎症指标mRNA表达的影响
与Control组相比,OVA模型组小鼠的iNOS mRNA、IFN-γ mRNA、IL-4 mRNA、IL-10 mRNA表达均显著升高(P<0.05)(见图8)。与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠的促炎因子iNOS mRNA、IFN-γ mRNA表达均显著降低(P<0.05)(见图8A)。抗炎因子IL-4 mRNA、IL-10 mRNA表达均显著升高(P<0.05)(见图8B)。结果提示,干扰lncRNA TUG1能明显改善OVA小鼠的炎症程度,与3.5、3.6、3.7结果吻合。

图8 各组对OVA小鼠BALF液中炎症指标mRNA表达的影响与Control组比较,*P<0.05;与OVA组比较,#P<0.05
九、干扰lncRNA TUG1对OVA小鼠肝脏中AKT/NF-κB通路相关蛋白的影响
与Control组相比,OVA模型组小鼠的p-AKT/AKT、p-P65/P65相对蛋白的表达显著升高;与OVA模型组相比,OVA+shRNA-NC组差异无统计学意义,OVA+sh-TUG1组小鼠p-AKT/AKT、p-P65/P65相对蛋白表达均显著降低(P<0.05)(见图9)。结果提示,干扰lncRNA TUG1能降低OVA小鼠肺纤维化程度,其机制可能与调控AKT/NF-κB通路的相关蛋白有关。

图9 各组对OVA小鼠肝脏中AKT/NF-κB通路相关蛋白的影响与Control组比较,*P<0.05;与OVA组比较,#P<0.05
讨 论
近年来研究显示,lncRNA是研究呼吸系统疾病中的热门方向,具有参与基因调控,阻断或促进疾病发展的潜力,其中lncRNA与哮喘的研究密切相关[9],可作为临床判断、评估预后的生物学指标以及后期治疗的靶点[10]。Fan等[11]发现lncRNA TCF7通过靶向TIMMDC1/Akt参与哮喘气道平滑肌细胞的生长和迁移;Zhang等[12]的研究表明干扰lncRNA-AK149641的会缓解OVA诱发的哮喘小鼠模型中的气道炎症反应,这可能与NF-κB信号通路的调节有关。此外,基于前期lncRNA TUG1对哮喘患者气道平滑肌细胞的增殖和迁移的研究。本实验探讨干扰长链非编码RNA TUG1对卵清蛋白诱导的哮喘小鼠肺功能损伤、纤维化以及免疫紊乱的影响。
肺功能检查是呼吸系统疾病的不可或缺的检查,广泛用于疾病诊断、病情分级、疾病发展、预后评估、治疗方案选择、疗效评估等,具有重要的临床意义[13]。HE染色是观察肺组织细胞成分与病变形态结构的常用方法。Zhang等[14]指出干扰lncRNA BCYRN1增加了OVA大鼠的肺容积、静息通气量,缓解肺组织的病变程度,减轻了哮喘对肺的损害。Hu等[15]发现LncRNA TUG1逆转LPS诱导肺损伤,HE检测显示肺组织的病理程度减轻。本实验显示,OVA+sh-TUG1组小鼠的肺容积、静息通气量、气道阻力均显著升高,小鼠炎性细胞浸润区域较少,肺组织的病变程度减轻,提示干扰lncRNA TUG1能缓解OVA小鼠肺功能损伤,与上述研究一致。
哮喘常见的肺部免疫介导性疾病。具有气道高反应性、嗜酸性粒细胞增多、炎性因子增强、细胞浸润,杯状细胞及黏液增加等特征。长期反复慢性哮喘会导致皮下肺纤维化[16]。大量研究已证明,香草素受体4型瞬时感受器电位通道(transient receptor potential vanilloid 4 channel, TRPV4)的相关蛋白会诱导肌成纤维细胞生成,即α-平滑肌动蛋白(Smooth muscle actin,α-SMA)、纤维粘连蛋白(fibronectin, FN)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)等促进肺纤维化的发生发展[17]。Huang等[18]指出lncRNA FENDRR主要通过下调TGF-β1表达,抑制肺成纤维细胞活化,从而减少肺纤维化,改善肺功能。Zhang等[19]的报道,显示干扰lncRNA NEAT1可增强E-钙粘蛋白的表达,并降低TGF-β1、p-Smad2、α-SMA的表达,通过调节miR-9-5p和TGF-β信号来抑制上皮细胞-间充质转化,从而缓解肺纤维化。HYP是机体胶原蛋白主要成分之一,目前测定肺脏羟脯氨酸的含量是评价肺纤维化程度的常用方法,是反映胶原组织代谢及纤维化程度的一项重要指标[20]。Qu等[21]研究表明肺纤维化程度与HYP含量呈负相关。本实验显示,OVA+sh-TUG1组小鼠的α-SMA、FN、TGF-β1蛋白表达均显著降低、HYP含量显著减少,提示,干扰lncRNA TUG1能降低OVA小鼠肺纤维化程度,与上述研究一致。
统计肺泡灌洗液(BALF)中淋巴细胞(lymphocyte,LYM)、中性粒细胞 (Neutrophils, NEU) 、 嗜酸性粒细胞(Eosinophils, EOS)等免疫细胞数目是检查呼吸系统疾病的常用方法。其中,Wang等[22]指出肺组织中的免疫细胞(NK细胞、单核细胞、中性粒细胞等)可以反映疾病的严重程度并参与肺纤维化的发展。Zhang等[12]的研究表明OVA小鼠的总细胞数和嗜酸性粒细胞数显著增加,而lncRNA AK149641的下调显著降低了炎症细胞的浸润。Nakagome等[23]研究显示体内IL-10基因传递通过抑制肺中TGF-β的生成和激活,减弱博莱霉素诱导的肺纤维化。Liu等[24]指出LncRNA-CASC7通过靶向miR-21抑制PI3K/AKT信号通路,抑制相关炎性因子表达,缓解哮喘的发生。本实验显示,OVA+sh-TUG1组小鼠肺组织炎症评分降低、各项炎症细胞数目减少、促炎因子表达降低、抗炎因子表达升高。结果提示,干扰lncRNA TUG1能明显缓解OVA小鼠的免疫紊乱,与上述研究一致。
哮喘的特征在于气道的炎症反应。山奈酚通过抑制p65、IκB、AKT的磷酸化以及HO-1的表达,调节 AKT/NF-κB信号通路,在哮喘中发挥抗炎作用的分子机制[25]。本实验显示OVA+sh-TUG1组小鼠p-AKT/AKT、p-P65/P65相对蛋白表达均显著降低。与上述研究一致,结果提示,干扰lncRNA TUG1能降低OVA小鼠肺纤维化程度,其机制可能与调控AKT/NF-κB通路有关。
综上,干扰lncRNA TUG1能缓解OVA小鼠肺功能损伤、肺纤维化程度及免疫紊乱,具有靶向治疗哮喘的潜力,其机制可能与调控AKT/NF-κB通路的相关蛋白有关。
