灵芝麦角硫因高通量检测方法研究
2022-02-19徐晴元游俊健林俊芳薛玲娜余颖豪郭丽琼
徐晴元,游俊健,林俊芳,2,薛玲娜,余颖豪,郭丽琼,2*
1华南农业大学食品学院生物工程系;2广东省微生态制剂工程技术研究中心,广州 510640
麦角硫因(ergothioneine,EGT)又名为2-硫基-L-组氨酸三甲基内盐,是存在于很多动植物体内含量丰富的天然氨基酸[1],仅在部分微生物(放线菌、链霉菌)、蕈菌、某些蓝细菌中合成,不能由动物机体自身合成EGT[2],人体只能从食物中摄入并通过高特异性的有机阳离子转运蛋白1型(organic cation transporter novel type-1,OCTN1)[3]在各种细胞和组织中积累高浓度EGT[4]。EGT被认为是一种很强的抗氧化剂,Servillo等[5]对其抗氧化机理进行了探讨,认为其拥有独特的氧化还原机制,并提出了一种EGT在细胞中的独特抗氧化作用。EGT的标准氧化还原电位是-0.06 V,其它硫醇的电势一般在-0.32 V~-0.2V之间,因此EGT在生理pH环境下比其他抗氧化剂更稳定,不易自发氧化[6]。研究表明,EGT具有多种重要的生理功能,如抗炎作用[7];通过保护DNA实现的细胞保护功能[8];通过促进神经细胞分化作用促进神经新生达到的抗抑郁功能[9];通过抵抗氧化应激实现的眼睛保护功能[10];通过中断与动脉粥样硬化发生相关的黏附分子表达实现的心脑血管保护功能[11];通过抑制毒性达到的对神经退行性疾病的预防和治疗作用[12]等,且本身具有安全性[13,14],因此,EGT在医药、食品和化妆品等行业具有广泛的应用前景。
EGT生产方式有化学合成、食用菌提取及微生物发酵等,由于前两者成本较高,工序复杂,因此食用菌菌丝的深层发酵是目前EGT工业化生产的主流模式[15],但自然菌株EGT产量低,需要通过育种技术培育EGT高产工业化菌种,培育工业食用菌菌种的方法有诱变育种[16]、杂交育种[17]、基因工程育种[18]及原生质体融合育种[19]等,但每种育种方法都需要进行多次、大样本量EGT含量检测,需说明的是,育种过程中EGT含量检测的意义更多在于比较样本间含量高低。目前EGT的检测方法有高效液相色谱法[20,21]、高效毛细管电泳法[22]和薄层电泳法[23]等。使用最为广泛的是高效液相色谱法,该方法可以从物质复杂的体系中准确检测出EGT的含量,但高效液相色谱法有其明显缺陷,即需探索针对不同样品不同的检测条件,且由于EGT出峰时间晚,标品昂贵,在育种需从大量样本中筛选出高产样本的情况下会导致检测耗时过长,成本过高,极大地阻碍了EGT的开发与应用研究,因此,急需建立一种可准确测定样本间EGT浓度的高通量快速检测方法。
由于EGT具有强抗氧化性,2价铁离子还原性适中(既不会受空气中氧气接触干扰,也不会因为还原性太弱导致指示性降低),EGT能与2价铁离子反应生成无色螯合物,同时硫氰酸根离子与二价铁离子反应生成红色络合物,根据以上特点,本研究选用硫氰酸铁为还原剂,使用麦角硫因标准品与硫氰酸铁反应,旨在建立一种麦角硫因的高通量检测体系。同时以不同灵芝菌株EGT产量不同对该高通量检测体系进行验证。本研究结果将为高产EGT微生物的筛选及高产EGT新菌株的选育提供了新的方法和思路。
1 材料与方法
1.1 材料
1.1.1实验材料
灵芝菌株NH8(元宝灵芝,Ganodermalucidum)、NH11(盆景3号,Ganodermalucidum)、NH12(美国大灵芝,Ganodermaresinaceum)、NH13(黑芝,Ganodermasinense)购于山东省寿光食用菌研究所; FQ16(硫因灵芝,Ganodermasessile)为野外采集并由本实验室(华南农业大学食品学院精准营养与健康实验室)分离纯化菌株;灵芝融合子菌株RS10、RS11、RS12、RS13、RS14、RS15、RS16为本实验室培育。
1.1.2试剂
硫氰酸铁Fe(SCN)3(CAS登录号4119-52-2)购自湖北广奥生物科技有限公司。麦角硫因标准品纯品购自天津诺信公司,纯度99%。
1.1.3仪器
本实验所用主要仪器如下:高效液相色谱仪LC-2030(日本,株式会社岛津制作所);酶标分析仪SAF-680T(上海巴玖实业有限公司);冷冻干燥机FD-10-50(博医康);氮吹仪NAI-DCY-12Y(上海那艾仪器有限公司)。
1.2 方法
1.2.1麦角硫因标准品配制
使用分析天平准确称取麦角硫因标准品,使用一级水溶解并配置成5个质量浓度梯度溶液:0.022、0.011、0.005 5、0.002 7、0.002 2 mg/mL。每个质量浓度设置3个平行。
硫氰酸铁试剂按照固液比(g/mL)0.1∶10 加入无水乙醇溶解,过膜0.22 μm,制得硫氰酸铁溶液(现配现用)。
先加入10 μL硫氰酸铁溶液于96孔板中,再加入100 μL麦角硫因标准品梯度溶液,吹打混合。使用酶标仪记录吸光度,酶标仪所用波长为450 nm。
1.2.2灵芝菌丝体EGT的提取
配置PSB培养基(马铃薯200 g/L(煮汁),蔗糖25 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,NH4Cl 2 g/L,自然pH),250 mL容量三角瓶分装100 mL,加入约20颗玻璃珠,115 ℃高压湿热灭菌30 min。从菌株平板上切取大小约为0.5 cm×0.5 cm的菌丝块,接种至PSB培养基中,控制接种量为5 %,置于摇床,28 ℃,150 rpm培养4天,获得种子液。
从种子液中吸取菌液至新的已分装好的无玻璃珠PSB培养基中,控制接种量为5%,置于摇床,28 ℃,150 rpm培养10天,每个菌株设置3平行。
预处理大孔树脂:称取大孔树脂NKA-9适量,使用无水乙醇浸泡4 h以上。使用一级水冲洗大孔树脂至无明显醇味,同时静置后水呈澄清透明,抽滤收集大孔树脂,使用1 M HCl浸泡大孔树脂4 h以上。使用一级水冲洗大孔树脂至冲洗液pH呈中性,抽滤收集大孔树脂,使用1 M NaOH浸泡大孔树脂4 h以上。使用一级水冲洗大孔树脂至冲洗液pH呈中性,抽滤收集大孔树脂,加入一级水,于4 ℃保存。
10天后收取菌丝,过滤以将发酵液与菌丝分离,收集菌丝用50 mL蒸馏水冲洗,将菌丝移至培养皿中,-45 ℃急速冷冻干燥36 h。称取干燥后菌丝体0.1 g,研磨粉碎,加入一级水10 mL,300 W超声提取10 min。提取后置于65 ℃水浴30 min,使用过滤法收集上清液4 mL,加入70 %乙醇8 mL和1 % SDS溶液2 mL,4 ℃静置12 h。
将静置后溶液常温离心8 000 rpm,15 min,取上清。使用氮吹仪,85 ℃,氮吹至4 mL以下,使用一级水定容样品至4 mL,添加1 g预处理大孔树脂(抽滤收集),置于摇床,30 ℃、150 rpm震荡4 h,取1 mL样品加入1 mL氯仿混匀,30 ℃水浴30 min,吸取上层液体至新的离心管中,加入等体积一级水进行稀释,使用HCl调节pH至2,即为待测样品液。
1.2.3EGT-硫氰酸铁体系对不同灵芝菌株的测验
选择麦角硫因产量不同的灵芝菌株(见表1),按“1.2.2”中的培养和提取方法获得的待测样品100 μL,加入已预先加入10 μL硫氰酸铁溶液的96孔板中,静置等待30 min,观察颜色变化。麦角硫因含量越高的样品,显色越浅。在450 nm波长下检测吸光度,麦角硫因含量越高的样品,吸光度越小。每株灵芝菌株设置3个平行。

表1 应用于EGT-硫氰酸铁体系的灵芝菌株
1.2.4 高效液相色谱法验证
高效液相色谱(high performance liquid chromatography,HPLC)检测条件:仪器使用岛津LC-2030高效液相色谱仪进行麦角硫因高效液相色谱检测,色谱柱为:Welch Ultimate HILIC Amphion II 色谱柱,检测波长为257 nm,流动相为乙腈∶水(85∶15),流速0.8 mL/min,进样量为20 μL,柱温30 ℃。麦角硫因标准曲线制作参考Hu等[24]报道方法,采用上述HPLC检测条件进行检测,以EGT质量浓度(mg/g)为横坐标,HPLC检测峰面积为纵坐标,绘制标准曲线。
取1 mL经“1.2.2”方法取纯化后的菌丝提取液,经0.22 μm水系微孔滤膜过滤后,进行HPLC检测,每株灵芝菌株设置3个平行。得到样品中代表麦角硫因含量的峰面积,将峰面积代入上述麦角硫因标准曲线方程得到相应样品中麦角硫因含量,然后通过下式换算。
EGT(mg/g DW)=C×40
式中:C代表通过麦角硫因标准曲线换算得到的麦角硫因质量浓度值(mg/mL),EGT为每克干重菌丝中麦角硫因含量。
1.2.5 EGT-硫氰酸铁体系应用于高产EGT灵芝新菌株的筛选
为检验EGT-硫氰酸铁体系在育种实验中的实用性,将本实验室通过基因组重组技术获得的灵芝融合子新菌株RS10、RS11、RS12、RS13、RS14、RS15、RS16使用EGT-硫氰酸铁体系进行高产EGT菌株的筛选。
2 结果与分析
2.1 EGT-硫氰酸铁体系的建立
使用不同浓度的EGT标准品溶液加入到硫氰酸铁的溶液中,结果表明硫氰酸铁的显色反应与EGT的浓度呈线性依赖关系,EGT浓度越高颜色越浅,各处理浓度之间显色差异显著(见图1A)。测定各样品450 nm处的吸光值,利用GraphPad Prism软件绘制其散点图(见图1B),线性回归方程为y=-18.40x+ 1.002,R2值为0.979 1,说明体系A450 nm值随着样品EGT浓度的增加而减少,趋势稳定,因此可以推论各处理间通过A450 nm值测定判断样品中的EGT含量的稳定性是可行的。
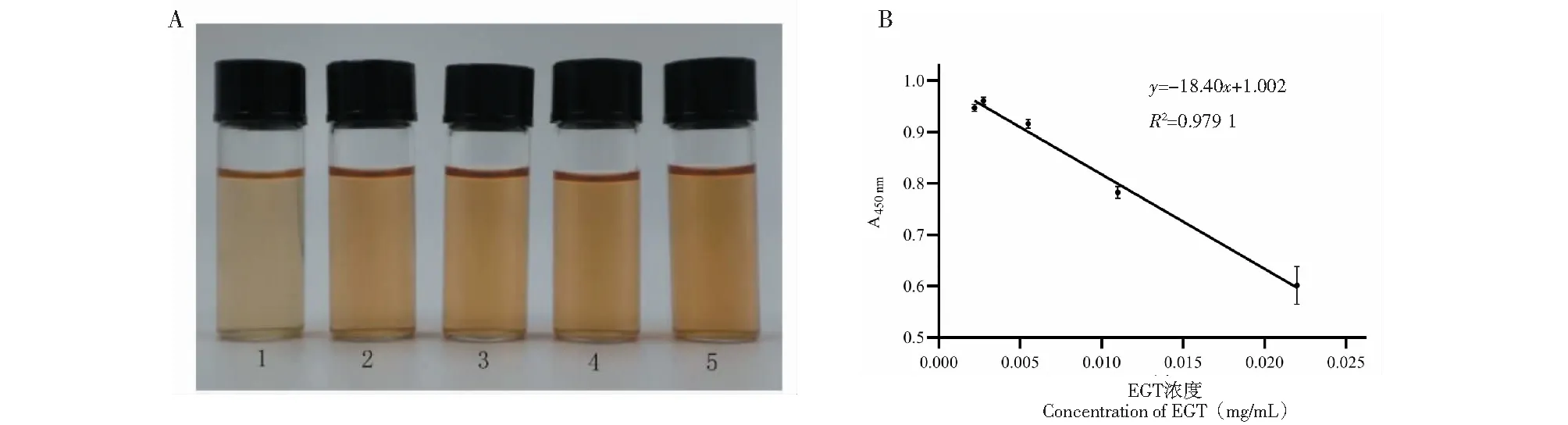
图1 不同质量浓度EGT与硫氰酸铁反应后的吸光值A450nmFig.1 Absorbance of EGT with different contents reacted with ferric thiocyanate注:A:1~5分别为0.022、0.011、0.005 5、0.002 75、0.002 2 mg/mL EGT标准品的EGT-硫氰酸铁反应体系;B:EGT标准品溶液浓度-体系A450 nm值线性拟合图。Note:A:1-5 are the EGT ferric thiocyanate reaction system of 0.022,0.011,0.005 5,0.002 75,0.002 2 mg/mL EGT standard respectively.B:The linear fitting diagram of solution concentration-system A450 nm value of EGT standard.
2.2 EGT-硫氰酸铁体系检测不同灵芝菌株中的EGT含量
为确定EGT-硫氰酸铁体系的实际应用的可行性,将表1中灵芝菌株按照“1.2.2”方法进行处理,按照“1.2.3”方法应用本体系进行检测,得到表1各灵芝菌株对应的450 nm处吸光值显著性差异图(见图2),图中显示,除了FQ16和NH12EGT产量差异不显著外,其余均有显著差异,而且吸光值大小与EGT含量呈负相关。可见所测菌株A450 nm值组间存在显著性差异(P<0.05),组内样本间差异较小。证明本方法可实际应用于菌株EGT浓度判断,能灵敏明确区分菌株EGT浓度的高低,体系稳定。
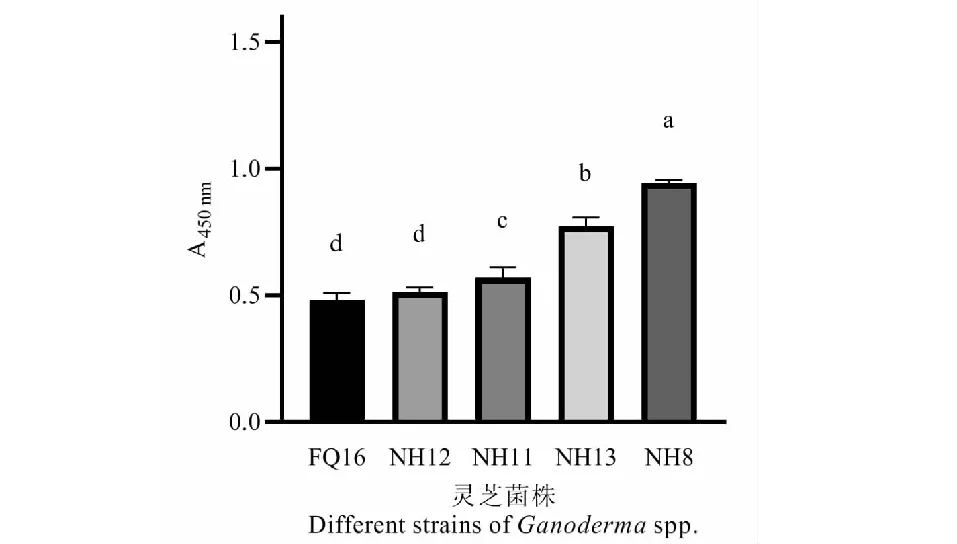
图2 EGT-硫氰酸铁体系检测不同灵芝菌株的EGT含量吸光值A450 nmFig.2 Detection of EGT content and absorbance of different Ganoderma spp.strains by EGT- ferric thiocyanate system注:图中a~d为样本间显著性差异标识,字母不同表示样本间P<0.05。Note:a-d are the mark of significant difference between samples,different letters indicate P < 0.05 between samples.
2.3 EGT-硫氰酸铁体系检测EGT含量的准确性验证
采用高效液相色谱法验证EGT-硫氰酸铁体系的准确性。使用高效液相色谱仪测定不同浓度EGT标准品溶液的峰面积,绘制麦角硫因-峰面积标准曲线(见图3)。

图3 麦角硫因标准品HPLC检测结果Fig.3 HPLC test results of ergothione standard注:A:EGT标准品液相色谱图,检测波长257 nm;B:EGT浓度(mg/mL)-峰面积标准曲线。Note:A:Liquid chromatogram of EGT standard,the detection wavelength is 257 nm B:EGT concentration (mg/mL)-peak area standard curve.
使用与标准品溶液相同的色谱条件测定实验各灵芝菌株的EGT含量,使用GraphPad Prism绘制其峰面积值柱状图(见图4),可见菌株EGT含量由FQ16至NH8依次降低,与高通量检测结果相符。

图4 高效液相色谱检测不同灵芝菌株的EGT含量Fig.4 Determination of EGT content of different Ganoderma spp.strains by high performance liquid chromatography
进一步对以上图2和图4的结果进行对比分析,结果见图5,可见各灵芝菌株EGT-硫氰酸铁体系的A450 nm值随着EGT浓度的增加而减小,且两种检测方法测得各样品EGT浓度高低趋势一致,EGT-硫氰酸铁体系检测结果组内差异更小,EGT浓度相近的样品也能通过本体系吸光值准确反映出EGT含量高低,证明本体系检测结果正确可用,检测体系灵敏稳定。

图5 不同灵芝菌株EGT含量两种检测方法结果对比Fig.5 Comparison of the results of two detection methods for EGT contents from Ganoderma spp.strains
2.4 EGT-硫氰酸铁体系在高产EGT灵芝新菌株筛选中的应用
将灵芝融合子新菌株分别用EGT-硫氰酸铁体系法和高效液相色谱法检测EGT含量,反应体系颜色与色谱结果比对(见图6),可见融合子菌株EGT-硫氰酸铁反应体系颜色由深到浅依次为RS13、RS14、RS16、RS12、RS10、RS15、RS11,与色谱图结果完全吻合,推论本体系方法适用于产EGT灵芝菌株育种过程EGT含量的检测比较。

图6 灵芝融合子菌株EGT含量两种检测方法对比Fig.6 Comparison of two methods for detecting EGT content of Ganoderma spp.fusant strain注:a:融合子RS10-RS16液相色谱图;b:高通量体系显色结果。Note:a:Fusant RS10-RS16 liquid chromatogram;b:Color results of high throughput system.
3 讨论与结论
根据麦角硫因具有强还原性的理化性质,在构建出EGT-硫氰酸铁体系之前,还先后实验构建碱性高锰酸钾体系、溴甲酚绿体系、蓝瓶子亚甲基蓝体系、愈创木酚体系、氯化铁-EGT体系,结果表明:碱性高锰酸钾体系因为稳定性低失败;溴甲酚绿体系显色结果因为与pH有关失败;蓝瓶子亚甲基蓝体系中,由于还原态亚甲基蓝的还原性太强,与空气中的氧气接触也极易被氧化成亚甲基蓝,导致实验无现象而失败;愈创木酚体系同样因为还原性太强受氧气接触干扰而失败;氯化铁体系因为显色程度太低而失败。EGT-硫氰酸铁体系可以用于EGT高通量检测方法的研究。
EGT-硫氰酸铁检测体系构建过程中发现,待测样品按照普通EGT粗提方法即醇沉-氮吹-定容提取时,提取液中残留的酚类物质会影响体系的显色反应,降低体系的灵敏度,因此粗提液在氮吹定容后,需增加氯仿除酚步骤。
灵芝是我国传统名贵的药用真菌,含有多种生物活性物质和生理功能,其麦角硫因含量在众多食用菌中含量较高,但是作为商业化生产的菌株其产量还偏低,因此培育高产麦角硫因的灵芝新菌株具有重要的意义及实际应用价值,基于以上原因,本实验室通过原生质体融合再生,分离鉴定得到一批拟融合子,本方法验证过程使用的灵芝融合子,均来源于此。
本研究建立的方法基于EGT本身理化性质,检测体系灵敏稳定,适用于产EGT工业发酵菌株选育过程中,大批量样本的快速比较,且理论上只需经过简单的样品EGT提取优化,即可适用于绝大部分菌株EGT含量的高通量快速检测,打破了原有EGT研究检测的局限性,为EGT的整体开发应用研究提供了新的方法和思路。
