基于正交实验法优化从栀子黄色素中制备藏红花酸的工艺
2022-02-19阳志强李茂星李晓琳韩天翔王维刚
阳志强,乌 兰*,李茂星,,4*,李晓琳,韩天翔,王维刚,4,王 芃,4
1西北民族大学化工学院,兰州 730030;2联勤保障部队第九四〇医院临床药学科;3甘肃省高原药学行业技术中心,兰州 730050;4甘肃中医药大学药学院,兰州 730000
藏红花酸(结构式见图1)是鸢尾科植物藏红花(CrocussativusL.)的主要有效成分之一具有治疗神经系统疾病[1,2]、抗心血管疾病[3,4]、抗氧化[5]、抗肿瘤[6,7]等药理作用。大量研究表明传统中药栀子(GardeniajasminoidesElli)富含以藏红花酸为苷元的藏红花苷类成分,且植物资源丰富[8]。项目组前期建立了聚酰胺柱层析法从栀子中富集提取栀子黄色素的制备工艺[9],并首次证明栀子黄色素具有良好的抗氧化、抗缺氧、抗疲劳的生物活性[10-12],具有良好的开发价值。然而,药代动力学研究表明,藏红花苷类成分不能以原型吸收入血,口服后体内生物利用度不高,最终会水解成藏红花酸[13,14]。为了进一步开展相关研究,需要制备高纯度的藏红花酸。Zhang[15]通过大孔吸附树脂分离富集得到藏红花总苷,在藏红花总苷中加入10% KOH水解得到藏红花酸粗品。Fang等[16]从栀子中提取栀子黄色素后,用10% KOH溶液水解制备了藏红花酸粗提物。高纯度藏红花酸的制备通常需要进一步采用柱层析法或重结晶等繁琐复杂的纯化工艺[15],但由于藏红花酸难溶于水,在乙醇、甲醇等一般有机试剂中溶解性也不好,实际纯化过程往往需要使用吡啶、DMF等有机试剂,难以避免有机残留[17,18];同时大量有机试剂的使用,还会造成严重环境污染。现有制备工艺操作步骤繁琐、制备周期长,难以实现高纯度藏红花酸的工业化生产[19]。
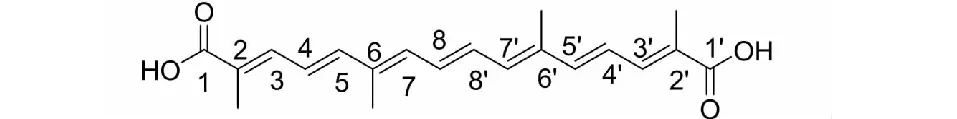
图1 藏红花酸结构式Fig.1 Structure of crocetin
本研究设计正交实验对碱水解的工艺条件进行系统研究,以藏红花酸含量和得率为考察指标,对栀子黄色素的碱水解工艺进行正交优化,同时对栀子黄色素碱水解后的处理方法进行改进,以期得到一种高得率、高纯度,并且制备步骤少,过程不存在有机溶剂残留的制备方法,为栀子中藏红花酸的提取制备及工业化生产提供参考,以利于藏红花酸在食药领域的广泛开发及应用。
1 材料与方法
1.1 材料与试剂
栀子黄色素(实验室自制,色价 > 500);藏红花酸对照品(批号:PS000187,含量 ≥98.0%)购自成都普思生物科技股份有限公司;灭菌注射用水(批号:M20080903B)、甲酸(批号:2019081601)、吡啶(批号:2020032301)、NaOH(批号:2020022701)均购自成都市科隆化学品有限公司;浓盐酸(批号:20090818)购自天津市风船化学试剂科技有限公司;微孔滤膜(批号:20200628)购自上海密粒膜分离技术有限公司;色谱级甲醇(批号:Me-00040203)、色谱级乙腈(批号:Ac-00030281)购自OCEANPAK公司。
1.2 仪器与设备
Ultimate 3000 DGLC高效液相色谱仪(Thermo Fisher Scientific公司);Waters Symmetry C18液相色谱柱(4.6 mm×150 mm,5 μm);KQ-100A型超声波清洗机(上海科导超声仪器有限公司);BP210S电子天平(Sartorius公司);DF-1集热式恒温加热磁力搅拌器(常州国华电器有限公司);SHB-IV循环水式多用真空泵(郑州长城科工贸有限公司)。
1.3 实验方法
1.3.1 色谱条件
色谱柱为Waters Symmetry C18液相色谱柱(4.6 mm×150 mm,5 μm);以乙腈(A)-0.6%甲酸水溶液(B)为流动相,梯度洗脱,洗脱程序为:0~15 min,25%→70% A;15~18 min,70% A;18~25 min,70%→25% A;25~30 min,25% A。流速1.0 mL/min;检测波长423 nm;柱温为30 ℃,进样量10 μL;分析时间30 min。
1.3.2 溶液制备
1.3.2.1 对照品溶液的制备
精密称取藏红花酸对照品适量于棕色容量瓶中,先加入少量吡啶充分溶解,再用75%甲醇溶液定容,摇匀,即得40.00 μg/mL藏红花酸对照品贮备液,备用。
1.3.2.2 供试品溶液的制备
栀子黄色素的制备[9]:称取适量的栀子粉末,用纯化水(10倍体积)煎煮1 h,过滤;在过滤后滤渣中加入纯化水重复上述操作,合并两次滤液,得栀子水提液。将上述水提液直接上样于聚酰胺柱,先用纯化水作为洗脱剂,到聚酰胺柱流出液为无色时,继续以15%的乙醇除杂,最后以75%的乙醇为洗脱剂,收集并以紫外实时检测其成分,合并洗脱液,干燥后得到栀子黄色素,用高效液相色谱测定其成分和含量,液相色谱图见图2。
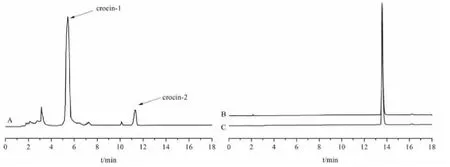
图2 栀子黄色素(A)、藏红花酸供试品(B)及藏红花酸对照品(C)的HPLC色谱图Fig.2 HPLC chromatograms of gardenia yellow pigment(A),crocetin for test article(B),and crocetin reference substance(C)
精密称取栀子黄色素适量于25 mL棕色容量瓶中,用75%甲醇溶液定容,摇匀,得40.00 μg/mL栀子黄色素供试品溶液。
精密称取本实验制备得到的藏红花酸样品适量于25 mL棕色容量瓶中,加入少量吡啶充分溶解,用75%甲醇溶液定容,摇匀,得40.00 μg/mL藏红花酸供试品溶液,备用。
1.3.3 专属性实验
分别取上述对照品溶液和供试品溶液适量,用高效液相色谱仪进行检测,并记录色谱图。结果如图2所示,溶剂中不存在杂峰干扰,在此色谱条件下,藏红花酸分离度与峰型良好。
1.3.4 方法学考察
线性关系考察:精密吸取对照品贮备液适量,分别进行稀释,得到系列浓度(1.00、2.50、5.00、10.00、15.00、20.00、40.00 μg/mL)的对照品溶液,按“1.3.1”项下色谱条件进样测定。以峰面积(Y)为纵坐标,对照品浓度(X,μg/mL)为横坐标,进行线性回归分析。
精密吸取对照品和供试品适量,分别进行准确度、重复性、稳定性和精密度的考察。
1.3.5 栀子黄色素制备藏红花酸工艺优化
称取4.00 g栀子黄色素加入圆底烧瓶中,按料液比1∶6 g/mL的比例加入NaOH溶液,水浴恒温反应一段时间后,反应液分别按以下方法处理:
方法1:在反应液中直接加入20%盐酸酸化,过滤后得到a;方法2:将反应液进行抽滤,分别收集滤液和滤饼,在滤液中加入20%盐酸酸化,过滤后得到b;方法3:将滤饼超声分散在大量纯化水中,酸化过滤后得到c;方法4:将方法2中的滤饼分散在纯化水中后,使用微孔滤膜再次过滤,滤液酸化后过滤得到d。通过HPLC检测并比较不同方法制得的藏红花酸的含量,工艺流程如图3所示。

图3 栀子黄色素制备藏红花酸流程图Fig.3 Flow chart of preparing crocetin from gardenia yellow pigment
1.3.6 单因素实验
1.3.6.1 碱浓度对藏红花酸得率的影响
称取栀子黄色素4.00 g,按料液比1∶6 g/mL的比例加入NaOH溶液,浓度分别为1、1.5、2、2.5、3 mol/L,在55 ℃的环境中水解30 min,反应液按方法4处理。
1.3.6.2 料液比对藏红花酸得率的影响
称取栀子黄色素4.00 g,加入2.5 mol/L的NaOH溶液,料液比分别为1∶2、1∶4、1∶6、1∶8、1∶10 g/mL,55 ℃水解反应30 min,反应液按方法4处理。
1.3.6.3 水解时间对藏红花酸得率的影响
称取栀子黄色素4.00 g,按料液比1∶6 g/mL的比例加入2.5 mol/L的NaOH溶液,水解时间分别为10、20、30、60、90、120 min,水解温度为55 ℃,反应液按方法4处理。
1.3.6.4 水解温度对藏红花酸得率的影响
称取栀子黄色素4.00 g,按料液比1∶6 g/mL的比例加入2.5 mol/L的NaOH溶液,分别在45、55、65、75、85 ℃的温度下水解30 min,反应液按方法4处理。
1.3.7 正交实验设计
为探究栀子黄色素碱水解过程对藏红花酸含量和得率的影响,参考文献[20,21]进行正交实验设计确定最佳的水解条件。精密称取9份栀子黄色素,每份4.00 g,按表1设计的因素水平进行试验,重复三次平行试验,根据单因素实验结果选取料液比(A)、NaOH浓度(B)、水解温度(C)、水解时间(D)为考察因素,进行L9(34)4因素3水平正交设计和方差分析,因素水平表见表2。同时以样品的得率和藏红花酸的含量为考察指标进行综合评分,将权重系数分别设置为30%和70%,样品得率和综合评分分别按以下公式进行计算:

其中Y为藏红花酸的得率;mt为得到的藏红花酸样品的质量,m0为反应的栀子黄色素的质量。
2 结果与分析
2.1 HPLC检测方法学考察
线性关系考察:藏红花酸回归方程为Y=2.017 5X+0.582(R2=0.999 8,线性范围:1.00~40.00 μg/mL)。
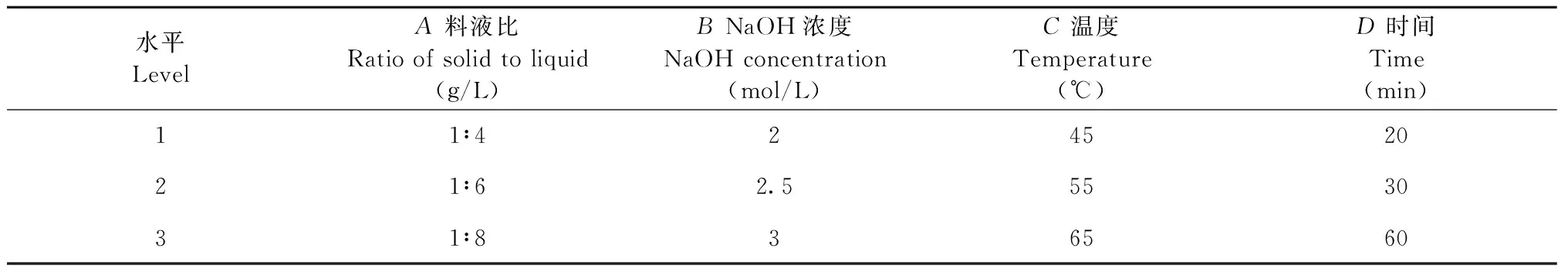
表1 正交实验因素与水平
准确度、重复性、稳定性和精密度:准确度实验中,平均回收率为97.35% ± 2.27%,RSD为2.33%,准确度良好;重复性实验中RSD为2.09%,重复性良好;5.00、15.00、30.00 μg/mL三个浓度下,稳定性和精密度的RSD均小于2%,稳定性和精密度良好。
2.2 制备工艺的结果分析
方法1:栀子黄色素碱水解后直接酸化,反应液中藏红花酸和杂质同时沉淀,过滤得到a,其中藏红花酸含量较低,要再进行繁琐的纯化;方法2:将反应液过滤后的滤液直接酸化后得到b,其中含有的藏红花酸很少,若要将滤液中藏红花酸进一步提取纯化,所需成本很高;方法3:反应液过滤后的滤饼酸化得到的c中,藏红花酸含量可达到70%以上;方法4:进一步地优化后,d中藏红花酸的含量可达到95%以上,该优化方法简单,生产周期短,且不需要后续的纯化步骤。不同处理方法样品中藏红花酸含量见图4。

图4 方法1~4样品中藏红花酸的含量Fig.4 The content of crocetin in samples by methods 1-4
2.3 单因素实验结果与分析
2.3.1 NaOH浓度
如图5所示,NaOH的浓度从1 mol/L增加到2.5 mol/L之间时,藏红花酸的得率随着NaOH浓度的变大而增加,当NaOH浓度>2.5 mol/L时,得率会稍微有些降低。考虑到提取成本,选择2、2.5、3 mol/L三个浓度为正交实验的3个水平。
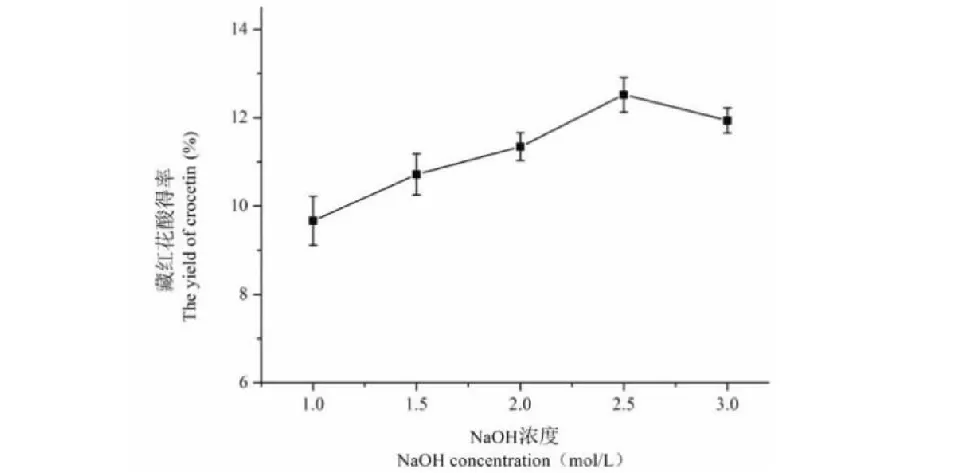
图5 NaOH浓度对藏红花酸得率的影响Fig.5 The effect of NaOH concentration on the yield of crocetin
2.3.2 料液比
如图6所示,随着碱液的增加,物料与碱液接触增多,但是得率会先增大后再减小,当料液比为1∶6 g/mL时得率最大,可能是当料液比增大,体系中可参与反应的OH-增加,使水解反应更加完全,此时得率会随料液比的增大而增大;当料液比>1∶6时,由于藏红花酸盐具有一定的水溶性,过滤后随杂质进入滤液,使最后的得率降低。因此选择1∶4、1∶6、1∶8三个料液比为正交实验的三个水平。
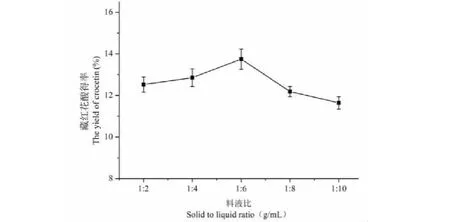
图6 料液比对藏红花酸得率的影响Fig.6 The effect of solid to liquid ratio on the yield of crocetin
2.3.3 水解时间
由图7可知,栀子黄色素得率随反应时间迅速升高,在30 min时藏红花酸的得率达到最高,之后得率随水解时间的延长而出现下降,可能当水解时间过长时,水解副产物增多,不利于水解反应的正向进行。考虑生产周期和得率,选择20、30、60 min三个时间为正交实验三个水平。
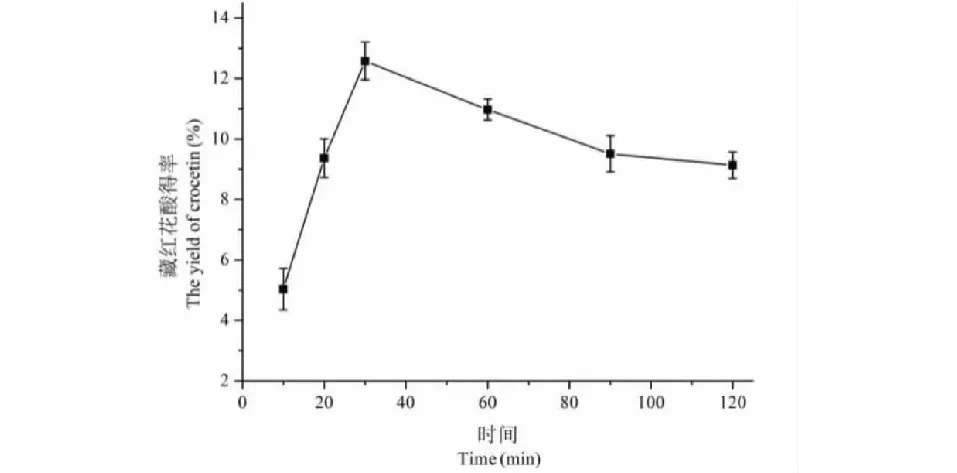
图7 水解时间对藏红花酸得率的影响Fig.7 The effect of time on the yield of crocetin
2.3.4 水解温度
由图8可知,藏红花酸的得率随水解温度升高先增大,当温度大于55 ℃后,得率随温度的升高开始降低。可能是碱水解反应为吸热反应,在相同的条件下升高温度有利于反应的进行,当温度过高时,会对藏红花酸的稳定性造成影响,最后导致得率下降。因此选择45、55、65 ℃三个温度为正交实验的3个水平。
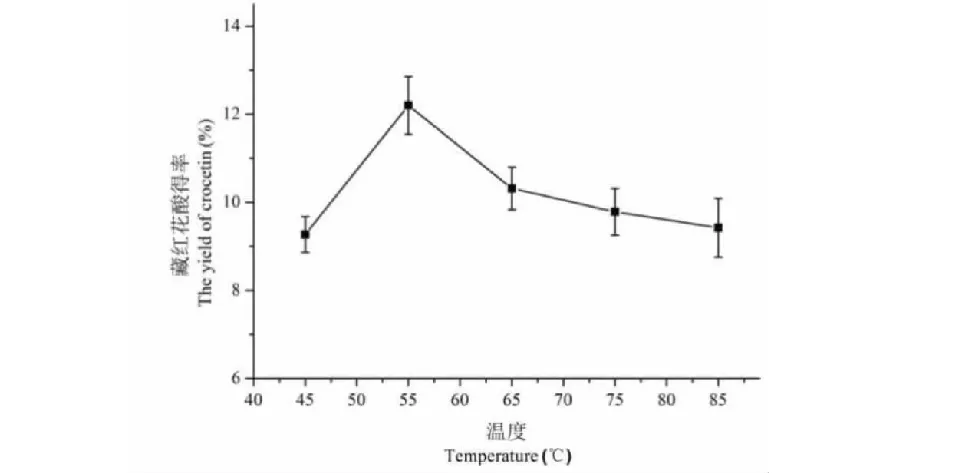
图8 水解温度对藏红花酸得率的影响Fig.8 The effect of temperature on the yield of crocetin
2.4 正交实验结果与分析
正交实验的结果见表2,通过各因素的K值和极差进行直观分析,结果显示各因素对栀子黄色素碱水解的影响大小主次顺序为:B(NaOH浓度)>C(水解温度)>D(水解时间)>A(料液比),以极差最小的因素A为作为误差项,方差分析的结果见表3,其中NaOH浓度、水解温度、水解时间对藏红花酸的得率具有显著性影响;由K值大小确定栀子黄色素碱水解的最优条件为A2B3C2D3,即栀子黄色素中加入3 mol/L的NaOH溶液,料液比为1∶6,在55 ℃的条件下反应60 min。
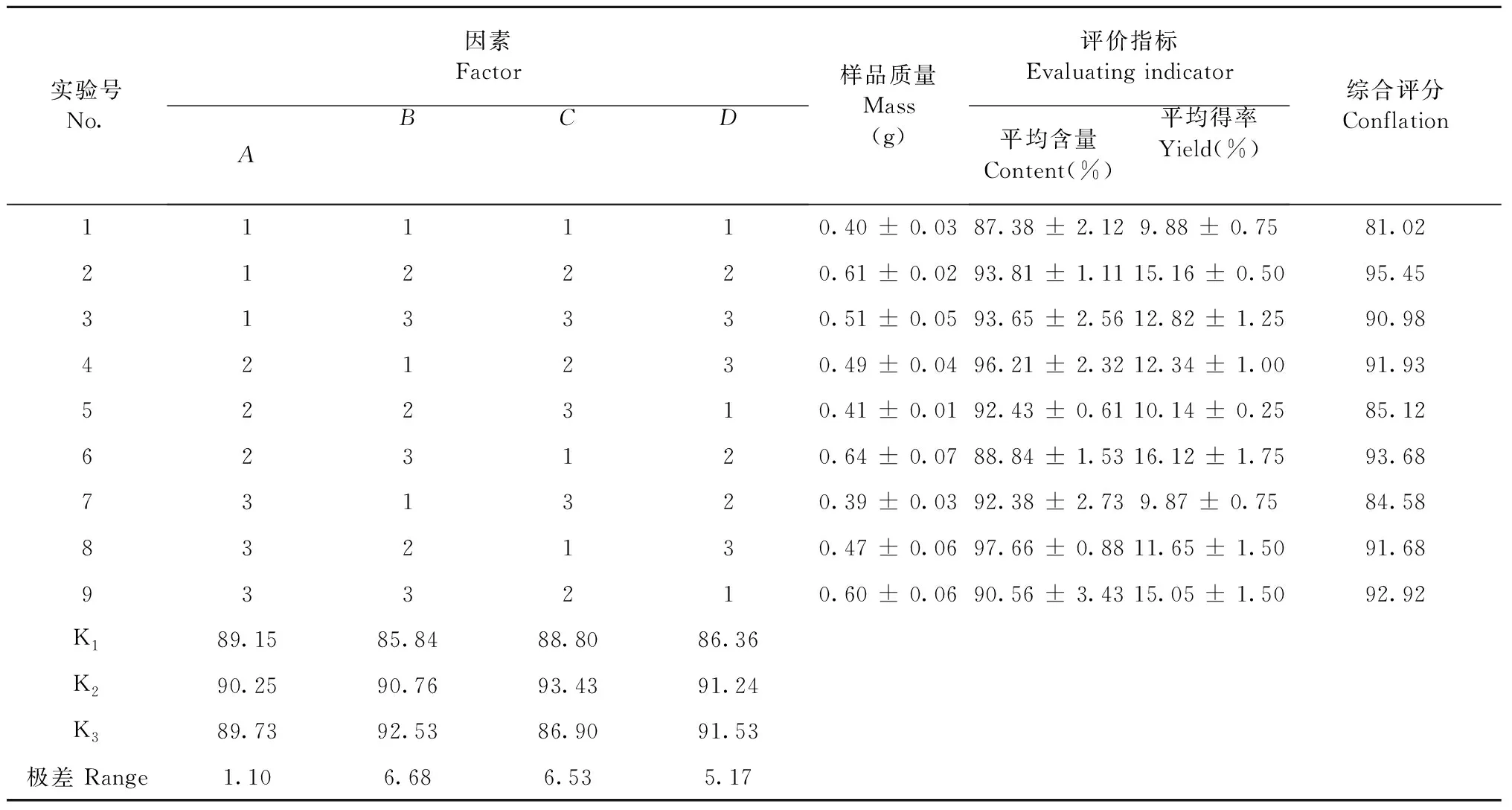
表2 L9(34)正交实验结果分析(n = 3)

表3 方差分析
2.5 验证实验
根据优化后碱水解条件进行3批验证实验,进一步考察反应条件的可靠性和稳定性。精密称取栀子黄色素4.00 g,按料液比1∶6的比例加入3 mol/L的NaOH溶液,55 ℃下恒温反应60 min;冷却至室温后抽滤,滤饼用少量纯化水淋洗2~3次;将滤饼溶于适量的纯化水中,用微孔滤膜进行抽滤,在滤液中加入20%的盐酸调节pH值为2~3,过滤得藏红花酸纯品,称重计算得率,用HPLC法测定其含量。3批验证实验平均得率为15.33% ± 1.25%;藏红花酸的平均含量为97.24% ± 0.78%,RSD(n=3)为0.80%,表明优化后的水解工艺稳定可行。
2.6 结构表征
2.6.1 核磁共振氢谱(1H NMR)
藏红花酸结构式见图1,其氢谱谱图有8不同类型的氢信号。1H NMR(600 MHz,DMSO)δ:12.22(2H,s,OH-1,OH-1′),7.21(2H,dd,J=11.4,1.6 Hz,H-3,H-3′),6.83(2H,dd,J=8.0,2.9 Hz,H-8,H-8′),6.73(2H,d,J=15.0 Hz,H-5,H-5′),6.61(2H,dd,J=15.1,11.5 Hz,H-4,H-4′),6.50(2H,dd,J=7.7,3.1 Hz,H-7,H-7′),1.98(6H,s,6-CH3,6′-CH3),1.92(6H,s,2-CH3,2′-CH3),氢谱数据与文献[22]报道一致。
2.6.2 核磁共振碳谱(13C NMR)
藏红花酸结构式见图1,其碳谱谱图有10种不同类型的碳信号。13C NMR(150 MHz,DMSO)δ:169.6(s,C-1,C-1′),143.8(s,C-5,C-5′),138.5(s,C-3,C-3′),137.1(s,C-6,C-6′),135.8(s,C-7,C-7′),132.1(s,C-8,C-8′),127.4(s,C-2,C-2′),124.6(s,C-4,C-4′),13.3(s,2-CH3,2′-CH3),13.0(s,6-CH3,6′-CH3),碳谱数据与文献[22]报道一致。
3 讨论与结论
课题组前期通过聚酰胺柱层析法快速从栀子中提取富集了高纯度的栀子黄色素,通过HPLC检测其在440 nm处的吸收峰,发现其主要成分为藏红花苷-1及藏红花苷-2,在此基础上以栀子黄色素为制备藏红花酸原料。
目前制备藏红花酸的方法多采用碱水解,将栀子中的藏红花苷水解为藏红花酸,而藏红花酸的后续纯化常用柱层析或重结晶等方法[16,23]。但由于藏红花酸难溶的物理性质,采用柱层析或重结晶的制备工艺时,不仅操作步骤繁琐、制备周期长、消耗大量试剂、严重污染环境,而且使用DMF等有机试剂时,更难以避免有机残留。
本研究对水解后的反应液采用不同的处理方法,对藏红花酸的制备工艺进行了考察和优化,优化后工艺步骤简单,从栀子黄色素中一步制备得到高纯度藏红花酸,省去了柱分离或重结晶等繁琐的纯化过程,避免了有机试剂的消耗和过程中残留试剂的问题,制备过程绿色无污染,获得的藏红花酸含量能达到95%以上。同时为提高藏红花酸的得率,在优化工艺的基础上,对栀子黄色素碱水解过程进行了考察。选取料液比、NaOH浓度、水解温度和水解时间进行单因素考察,并通过考察结果设计正交实验,以含量和得率为评价指标,确定了碱水解的最佳条件。
本实验对栀子黄色素制备藏红花酸的路线进行了优化,并设计单因素实验和正交实验优选出碱水解的最佳条件,得到了一种快速、高得率、高纯度制备藏红花酸的方法,相较于常用的方法,不需要进行后续的纯化处理,不涉及有机溶剂,节约了生产时间和成本,对从栀子中提取制备藏红花酸具有较好的参考意义。
