岩藻多糖的提取、化学改性、降血糖活性及机理研究进展
2022-02-19陈舒桐钟赛意
陈舒桐,俞 珵,李 瑞*,钟赛意
1广东海洋大学食品科技学院;2广东省海洋生物制品工程实验室;3广东省海洋食品工程技术研究中心;4广东省水产品加工与安全重点实验室,湛江 524008
岩藻多糖(fucoidans,FU)主要来源于海洋褐藻如墨角藻[1]、裙带菜[2]、马尾藻[3]和海洋无脊椎动物如海参[4]、海胆[5]等,是一种复杂的硫酸化多糖,又称岩藻聚糖硫酸酯。FU的单糖组成主要是岩藻糖,还含有少量半乳糖、木糖、鼠李糖、甘露糖、阿拉伯糖和葡萄糖醛酸以及大量的硫酸基团,是一种多聚阴离子同型杂多糖[6]。FU的骨架有两种类型:I型链或II型链(见图1),I型链包含重复的(1→3)-α-L-吡喃岩藻糖,而II型链包含交替的(1→3)和(1→4)连接的α-L-吡喃岩藻糖,单糖通过α-1,2、α-1,3或α-1,4糖苷键连接[5]。

图1 I型和II型岩藻多糖链Fig.1 Type I and type II chains of brown seaweed fucoidans注:R是潜在附着的碳水化合物(α-L-吡喃岩藻糖和α-D-葡萄糖醛酸)和非碳水化合物(硫酸基和乙酰基)取代基。Note:R is potential attachment of carbohydrate (α-L-fucopyranose, α-D-glucuronic acid) and non-carbohydrate (sulfate and acetyl groups) substituents.
FU具有广泛的健康功效及治疗作用,包括抗肿瘤[3]、抗氧化[7]、抗疲劳[8]、调节免疫[9]、抗菌[10]、抗肝损伤[11]、降血脂[12]、抗血栓[13]、抗炎[14]、抗血管生成[15]、抗凝血[16]、降血糖[17]、抗过敏[5]、抗辐射[18]及促进伤口愈合[19]等多种作用;此外,FU还具有抗新型冠状病毒的潜在作用[20],因而引起越来越多的关注。FU的化学组成和结构因地理位置、物种、季节和提取技术的不同而有显著差异,其分子量和硫酸基含量对功能活性具有很大影响,对其进行化学改性可进一步提高其功能活性[12]。因此,本文重点综述FU的提取方法、化学改性和降血糖活性及机理,探讨FU的提取及化学改性方面今后的研究方向,深入研究FU结构与降血糖及其他生物活性之间的构效关系也是今后的研究重点。本文可为FU的制备提供新的思路,有助于天然和改性后FU的有效利用,并为FU降血糖功能食品及保健产品的开发提供参考依据。
1 岩藻多糖的提取方法
FU的生物学特性和生物利用度取决于其组成和结构,并受提取技术的影响[21]。多糖的提取涉及溶剂渗透、多糖溶解和扩散等一系列过程,众所周知的导致结构改变的因素,如高温、酸、碱、超声波、微波和酶已被广泛应用于多糖的制备[22]。已有研究证明,提取方法可引起多糖分子链的水解断裂和分子间氢键的断裂,从而得到具有不同理化性质和功能特性的改性多糖[23]。这意味着天然多糖制备过程中可能经历物理化学变化,从而显著影响其功能。为了得到功能更完善的多糖,必须了解制备方法(条件)对FU结构等方面的影响。下面将综述FU的提取技术,并讨论这些技术在提高FU得率和生物活性等方面的潜力。
1.1 冷法提取及热水浸提法
冷水提取、冷冻解冻及冷压萃取都属于典型的冷法提取。冷法提取保留了多糖的初始结构,包含更多的活性基团和功能反应特定区域[24]。FU主要存在于褐藻细胞壁中[25]。然而,在相对低的温度下,由于冷法提取多糖的释放、扩散和溶解速度较慢,可能导致高分子量多糖很难提取出来,从而导致多糖提取物得率较低[26],因此冷法提取可用于选择性分离高水溶性、低分子量多糖[27]。
热水浸提法是根据FU易溶于热水、不溶于乙醇等有机溶剂的特点,利用热力作用,使细胞的原生质层发生改变,导致质壁分离,水溶液进入细胞溶解所需物质,使其扩散到溶剂中,从而达到提取FU的目的。Shan等[28]采用80 ℃,3 h,海藻∶水=1∶20(w/w)的条件提取FU;Fernando等[29]用蒸馏水在温度90~95 ℃提取2次,连续振荡提取3~4 h。然而,二者均未报道FU得率。水提法对仪器设备要求不高,成本较低,便于在实验室进行,也适于大规模工业生产,但热水浸提存在耗时长、能耗高、效率低的缺点。
1.2 酸提和碱提法
酸提法是根据FU可溶于稀盐酸溶液的特点,在酸溶液中细胞壁充分吸水胀膨而破裂,从而使FU游离出来,以此达到提取目的。然而,在酸性条件下硫酸基可能会部分裂解和解聚,因此需要充分控制操作过程,以免影响FU的组成、结构和性能[21]。常见的方法是使用0.05~0.10 mol/L HCl的微酸性溶液进行提取[30-32],硫酸溶液(0.10 mol/L)[33]和柠檬酸溶液(0.10 mol/L)[34]也可用来提取FU。在提取过程中其他组分如蛋白质和酚类化合物也会被同时提取出来,因此FU得率比实际值偏高,然而蛋白质和酚类化合物有助于其抗氧化活性[34]。
酸性处理条件对FU得率和分子量均有显著影响,由于pH、时间和温度这三个主要因素之间存在相互关系,因此需要同时进行优化。由于高温和长时间酸萃取会影响聚合物结构完整性,因此反应时间通常需控制在1~5 h[35]。在较高酸浓度(0.35 mol/L HCl)下FU的岩藻糖含量会有损失[36]。温度会影响FU提取率,温度控制在30~90 ℃可达到较高得率,FU的提取量在温度达到最佳值后逐渐增加,然后逐渐减少[21]。Lorbeer等[37]在60 ℃用HCl溶液提取边花昆布(Eckloniaradiata)岩藻多糖,在短时间内其岩藻糖和硫酸基含量都是最大的,延长提取时间得率下降,且FU分子量显著降低。较短时间和适中的温度(42 ℃,pH1.0,159 min)有助于在工业环境中连续提取FU,最高得率为3.75%[38]。此外,还可以优化多级萃取的次数,并进行1~6次萃取,确保FU被完全提取出来[39]。
与其他需要化学试剂的技术相比,温和的酸水解是一种更环保、更便宜、操作简单的解聚技术[40],由于第一个岩藻糖单元位置2的选择性脱硫,以及未磺化的岩藻糖残基和随后的4-硫酸基之间的糖苷键断裂,硫酸基可能被去除,因此酸性条件下多糖分子易水解,糖苷键易断裂,这让获得分子大小合适的FU变得困难[41]。然而,有研究表明脱硫酸基和脱酰基导致FU抗癌活性下降[42],而硫酸基团对FU羟基的取代可改变多糖的组成、分子量、电荷、溶解度和构象,提高多糖生物活性[43]。因此,酸提法需严格控制酸浓度以防止对得率和产物性质造成影响。酸提法较水提法来说得率有一定升高,但同样存在耗时长、得率低的缺点。
在碱提法中,氢氧根离子会干扰多糖之间的氢键,将它们释放到溶液中,从而提高得率。与热水提取相比,使用CaCl2水溶液可提取粗岩藻多糖,提取物糖醛酸和多酚含量较低[31]。Saravana等[44,45]以0.10% NaOH溶液为萃取剂,分别采用加压液相萃取和亚临界水萃取法,FU得率分别达8.23%和13.56%。在进行酸性或碱性提取时,为了防止目标多糖降解,均需要对最终提取物进行中和[21]。
1.3 超声波和微波辅助提取法
超声波和微波辅助提取多糖的效果也与高温有关。超声空化同时产生的高温和高压会导致细胞壁破裂,增强溶剂渗透[46]。微波能量通过偶极极化和离子传导迅速转化为热能量,几乎立即升温,导致细胞壁破坏,从而促进多糖向溶剂释放[47]。超声波辅助提取法提取出的多糖可能具有较高醛酸含量和较低分子量,从而增强其抗炎、抗氧化、益生功能和/或降血糖活性[27]。同样,微波辅助提取的FU具有较低分子量和较强的抗氧化活性[48]。与热水浸提法相比,超声波和微波辅助提取都更容易获得产率更高、功能更理想的多糖提取物。
Alboofetileh等[49]报道,与亚临界水萃取相比,超声波辅助萃取获得的FU因硫酸基含量较高而具有更强的抑制大肠杆菌的能力。Guo等[50]研究了超声波对美国肉参(Isostichopusbadionotus)FU分子量、结构和抗氧化性能的影响。结果表明,超声处理后FU的分子量明显降低,超声强度越大、温度越低、FU浓度越低,其超声化学效应越明显,超声波处理后的抗氧化活性略有提高。结合FU结构分析和抗氧化活性结果,目前学者推测超声波作用于FU的机理可能是机械降解和自由基降解相结合(见图2)。
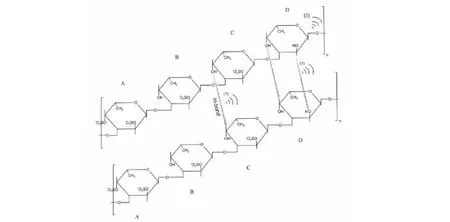
图2 超声波作用于岩藻多糖的可能机理Fig.2 Possible mechanism of ultrasonic action on fucoidans注:(1)机械作用破坏了岩藻多糖分子间的氢键;(2)超声处理产生的自由基作用于分子主干上的非磺化岩藻糖。Note:(1) Mechanical effect broke the hydrogen bonds among the fucoidan molecules;(2) Free radicals produced by ultrasonic treatment acted on the non-sulfated fucose in the backbone.
Yuan[48]以泡叶藻(Ascophyllumnodosum)为原料,采用微波辅助技术提取FU,发现微波辅助法提取FU的最佳时间为15 min;90 ℃提取的FU单糖以岩藻糖为主,而150 ℃提取的FU以葡萄糖醛酸为主,且随着提取温度的降低,FU的分子量和硫酸基含量均呈上升趋势,90 ℃提取的FU抗氧化活性最高。本研究表明,微波辅助萃取技术是一种高效的FU提取工艺。Quitain等[51]采用微波加热法从裙带菜(Undariapinnatifida)中提取FU,发现微波加热比传统加热具有优势,在接近140 ℃获得目标分子量(5~30 kDa);此外在1 min的短照射时间内,以恒定微波功率进行连续微波照射,也获得了良好的效果。
1.4 酶解法
提取功能性多糖常用的酶包括纤维素酶、木瓜蛋白酶、碱性蛋白酶、果胶酶、α-淀粉酶、葡萄糖氧化酶和淀粉转葡萄糖苷酶等,可单独使用或联合使用[52]。酶解法的作用机制可能与以下方面有关:一是破坏生物屏障即细胞壁和细胞膜,促进所需多糖的分离;二是将多糖部分降解为易于提取的片段[52]。酶辅助提取功能性多糖与热水浸提法相比的优势是非常明显的,但与其他方法相比,酶解法并没有提高多糖得率,而是显著改变了提取物的化学成分和多糖结构[27]。α-淀粉酶降低了多糖分子量,提高了多糖生物活性如益生功能、免疫调节和抗氧化作用[27]。此外,与热水浸提法相比,碱性蛋白酶辅助提取的多糖分子量和硫酸基含量更高,且具有更强的抗氧化和免疫刺激活性[49]。酶可以选择性地分离生物活性多糖,并可有针对性的生产具有特定凝胶性质和理想物理性质的多糖[52]。目前研究已证明酶提取技术在多糖的可持续提取方面具有明显技术优势,并提高了提取物的药理活性,复合酶对多糖得率和提取率也有积极的影响;酶辅助提取的另一个优点是从反应混合物中沉淀多糖所需的乙醇量较少,这使得该过程更加环保[52]。
1.5 加压液相提取
水是一种中性溶剂,在室温下无毒,而超过其临界温度和压力的H2O分子,被称为超临界水,可以作为有机溶剂和酸性介质。亚临界水在高压下可控制温度高达374 ℃,亚临界温度可以促进水不溶性多糖向水溶性多糖转变[53],并增加水的电离常数使其更接近酸性溶液,提高多糖提取效率[54]。与传统的酸、碱、酶水解技术相比,生物质加压液体萃取技术具有许多优势。因为有机溶剂在任何萃取过程中都是一个重要因素,但必须焚烧、回收或需要其他适当的处理,产生大量对环境具有非腐蚀性的废物,而加压液相提取方法的主要优点是不使用有机溶剂,因而该方法更加环保[44]。各种文献表明,从海藻等多种自然资源中采用加压液相提取法萃取活性成分是一种很有前景的方法。
Saravana等[44]采用加压液体萃取法利用不同溶剂(水、0.10%氢氧化钠、0.10%甲酸、70%乙醇、50%乙醇和25%乙醇)从日本海带(Saccharinajaponica)中提取FU,发现在140 ℃、50 bar、0.10%氢氧化钠条件下,粗岩藻多糖得率最高,为8.23%,所有粗岩藻多糖均具有抗氧化活性,并具有良好的乳化稳定性,特别是对植物油。Saravana等[45]对亚临界水提取FU进行进一步的工艺优化,得出最佳工艺条件为:127.01 ℃,80 bar,料液比0.04 g/mL,搅拌速度300 rpm,反应时间11.98 min,FU得率为13.56%,所提取的FU具有良好的抗氧化活性,对少数细胞系具有适度抗增殖活性。综上所述,通过超临界水提取的粗岩藻多糖产率高且功能活性好,是FU工业化生产的首选方法[45]。
1.6 组合方法
不同提取方法可能产生协同作用,因此在许多情况下多种方法结合提取FU,不仅可提高FU得率,也可增强其功能性质,从而提高FU提取率和改性效果。Lorbeer等[37]采用热盐酸水溶液与微波相结合提取FU,180 min后FU得率为4.80%。Alboofetileh等[49]采用不同提取方法(酶法、超声波、微波、亚临界水、酰基转移酶-超声波联用、超声波-微波联用、热水浸提法),发现亚临界水提法FU提取率最高,达13.15%,超声提法FU提取率最低,为3.60%;且微波和亚临界水提取的FU对大肠杆菌生长具有抑制作用,酶-超声波联用法、超声波-微波联用法和亚临界水提FU对铜绿假单胞菌均有抑制作用,所有方法提取的FU对单纯疱疹病毒Ⅱ型均具有较强的抗病毒活性。
2 岩藻多糖的化学改性
生物活性多糖由于其低毒、低副作用的特点,在食品和医学等领域的应用引起了人们的广泛关注。多糖具有多种生物活性,然而,其生物活性并不总是令人满意。因此,为了改善多糖的功能性质,有必要寻找一种提高多糖生物活性的方法,物理、化学和生物方法已广泛应用于其结构的修饰[55]。对于FU,目前所用的主要化学改性方法包括硫酸化和脱硫、乙酰化和脱乙酰、酰胺化和胺化以及磷酸化。
2.1 硫酸化和脱硫作用
硫酸多糖因其抗病毒等活性而受到广泛关注,因此多糖的硫酸化是近年来多糖结构修饰的一个重要方向。硫酸化改性原理是将多糖溶解在溶剂中,在一定条件下与相应的磺化试剂反应,硫酸基附着在羟基上,通过调节反应物的摩尔比控制多糖硫酸基与羟基的结合程度。FU是一种具有广泛生物功能特性的天然硫酸多糖,在C-2和/或C-4位点上含有硫酸基。FU的生物功能特性取决于其分子结构,硫酸基的取代模式和程度对其功能活性起着重要作用,硫酸化修饰后的多糖不仅能获得抗病毒活性,还能产生其他新的生物活性,例如,在超氧自由基检测、羟基自由基检测、还原力检测和MTT检测中,马尾藻FU显示出良好的抗氧化和抗肿瘤活性[56]。然而,也并不是硫酸基越多越好,有些海洋硫酸多糖因为硫酸基含量过多而有一定的毒性,当经过脱硫处理后,可降低其毒性。Li等[57]对FU的构效关系进行较为详细的综述,首先指出FU糖的抗凝血活性随硫酸基的增加而增强;其次,1→3连接的岩藻吡喃糖C-4上的硫酸基具有抗疱疹活性;第三,低分子量、硫酸基取代率高的FU具有较好的抗氧化性能;最后,FU的总负电荷随硫酸基替代度的增加而升高,有助于降低血液胆固醇水平。因此,多糖的硫酸化/脱硫研究为开发新型生物功能材料提供了新的思路。
目前常用的硫酸化法主要有氯磺酸-吡啶法、三氧化硫-吡啶法和浓硫酸法[58]。不同的硫酸化修饰方法也有着不同的优点与缺点,比如浓硫酸法反应条件比较稳定,但这种方法会导致在硫酸化过程中硫酸多糖的降解及碳化,从而导致产率较低;三氧化硫-吡啶法反应条件温和,可防止多糖降解,产率较高且操作简单,但是此方法用到的试剂价格昂贵(见表1)。Koyanagi等[59]通过与二甲基甲酰胺和三氧化硫-三甲胺复合物反应对FU进行过硫酸化(见图3A),使FU某些残基的羟基接上硫酸基团,发现硫酸化FU的抗血管新生和抗肿瘤作用比天然岩藻多糖强。
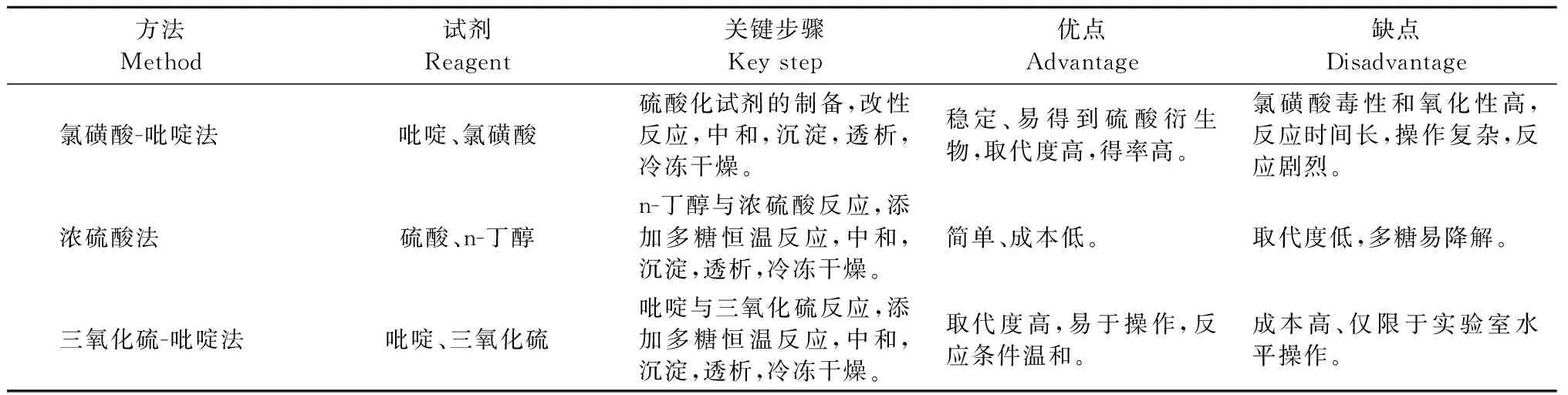
表1 硫酸化法比较
在FU结构表征过程中需对其进行脱硫,有助于获得清晰的核磁共振谱。脱硫应在不引起聚合物水解的情况下进行,目前最适合的脱硫技术是“溶剂离解脱硫”,即在二甲亚砜(dimethylsulfoxide,DMSO)和吡啶溶液中加热FU(见图3B)[60]。一些研究推荐使用1,4-二恶烷代替DMSO,因为DMSO会导致聚合物降解[61]。反应混合物中硫酸基受体如氧化亚砷和三氧化锑的存在有助于脱硫,因为它能产生大量完全脱硫的多糖。

图3 FU的硫酸化(A)和脱硫(B)反应[62]Fig.3 Sulfation (A) and desulfation (B) reactions of fucoidan[62]
2.2 乙酰化和脱乙酰作用
乙酰化是指醇羟基与酰化剂之间的反应,活性羟基上可发生亲核取代反应,修饰多糖支链结构,是最常用的化学修饰方法之一[58]。酸酐-吡啶法是常用的多糖乙酰化修饰方法,该方法第一步是将多糖溶解在有机溶剂中(甲酰胺、甲醇、氯化锂/二甲基乙酰胺、DMSO等),接着加入乙酰化试剂(乙酸和乙酸酐)完成酰化,催化剂如N-溴代丁二酰亚胺、4-二甲氨基吡啶、吡啶等添加,可以加速反应,提高乙酰化的取代度(常发生在羟基氧和氨基氮上)[63]。而N-溴代丁二酰亚胺具有便宜、高效的优点,因此推荐使用其作为催化剂[64],Wang等[65]采用N-溴代丁二酰亚胺作为催化剂对岩藻多糖进行乙酰化。据报道,FU的天然结构偶尔在一些随机位置含有乙酰基[66],然而,外加的乙酰基可以很容易地在-OH连接到其主干。
乙酰基可以改变多糖分子结构如定向性和横次序,从而改变其性质及溶解度。许多研究表明,多糖的乙酰化可使多糖生物活性增强或产生新的生物活性[58]。到目前为止,对FU的过乙酰化衍生物的研究数量有限。有报道称过乙酰化FU的抗氧化性能比天然产物提高了[67];Lee等[63]制备了乙酰化FU纳米粒子并用来包埋阿霉素,FU的疏水改性成功地包封了轻度疏水药物阿霉素,其一级药物释放行为可持续5天。
FU的去乙酰化通常被通过核磁共振协助表征其结构。FU的脱乙酰是将FU溶解并与浓氢氧化铵溶液进行反应。除了化学脱乙酰作用外,Nagao等[68]还从海洋细菌中鉴定出了一种FU脱乙酰酶,该酶可以选择性地脱乙酰岩藻多糖,而不会导致脱硫酸盐或聚合物降解,这一新的FU脱乙酰化方法有可能拓展对FU结构的研究。
2.3 酰胺化和胺化
酰胺化和胺化分别是将酰胺基和胺基(包括烷基胺)引入化合物的过程。研究表明多糖的n-烷基酰胺具有降低胆固醇和脂肪的作用[69]。据我们所知,目前文献中未见FU酰胺化的报道。FU的胺化可提高其抗凝血活性,因而得到了广泛研究。由于岩藻多糖的异质性质不能直接进行胺化,因此,需要引入具有活性官能团的间隔分子(如环氧氯丙烷)来激活衍生物的酰胺化[62]。Soeda等[70]通过与环氧氯丙烷反应在FU上引入一个间隔分子,然后溶解在30%的氨溶液进行胺化(见图4)。然而,Soeda等[71]报道,通过上述方法获得的胺化FU可提高细胞外尿激酶型纤溶酶原激活物水平,进而促进了3LL肿瘤细胞(肺癌细胞)的侵袭,而天然岩藻多糖则会降低癌症转移。
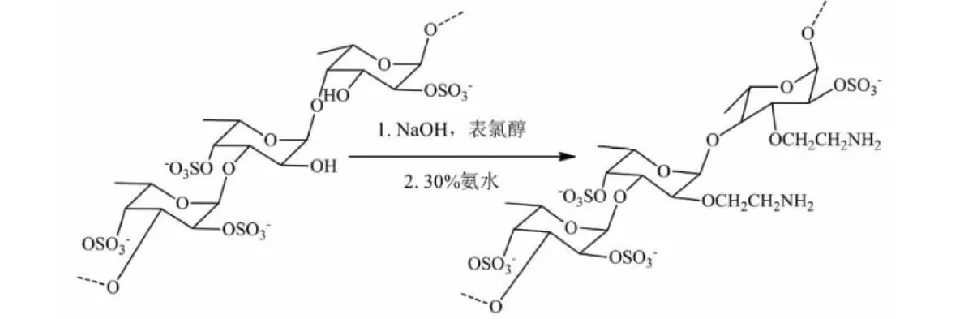
图4 岩藻多糖通过间隔分子进行胺化[62]Fig.4 Amination of fucoidan via a spacer molecule[62]
2.4 磷酸化法
生物相容性聚合物磷酸化后在促进羟基磷灰石生成方面提供了较好的性能,促进了其在骨组织工程中的应用并得到广泛研究。Wang等[72]采用POCl3法和聚磷酸法两种方法合成了岩藻多糖磷酸化衍生物。POCl3方法是首先将POCl3溶解在吡啶中,然后加入到含有FU的甲酰胺溶液,将此混合物倒入Ba(OH)2饱和溶液中,对产生的沉淀物进行过滤、洗涤、透析和冻干,得到磷酸化FU。在聚磷酸法中,FU首先溶解于甲酰胺溶液中并与三丁胺混合,再将多聚磷酸加入混合液中,所得沉淀物的pH用氢氧化钠调至10,然后透析和冻干。POCl3法优于聚磷酸法,且单糖中岩藻糖含量没有损失。这两种衍生物都显示出比其天然形式更强的抗氧化活性[62]。
3 岩藻多糖降血糖活性及机理研究进展
如前所述,FU具有抗癌、提高免疫力、降血糖等多种功能活性,本文重点讨论FU的降血糖活性及机理。目前,科学家对FU降血糖活性的研究主要集中在对酶的抑制作用和动物实验等方面,本文将从以下几个方面探讨FU的降血糖活性和机理。
3.1 抑制α-葡萄糖苷酶和α-淀粉酶的活性,延缓机体对葡萄糖的摄入
α-淀粉酶和α-D-葡萄糖苷酶活性与餐后血糖水平的升高相关。因此,对这两种酶的控制在II型糖尿病治疗中非常重要[73]。α-葡萄糖苷酶和α-淀粉酶的抑制机制在报道的各种抑制剂中有所不同,研究表明,多酚化合物影响α-葡萄糖苷酶活性的主要因素是清除氢,多酚化合物的作用是拦截从α-葡萄糖苷酶催化位点释放的氢离子;α-淀粉酶可能的抑制血糖升高的机制包括:(1)多酚化合物与α-淀粉酶形成复合物;(2)减缓葡萄糖从活性部位扩散,例如通过粘性水溶性膳食纤维延缓碳水化合物的水解和葡萄糖的吸收。岩藻多糖抑制α-淀粉酶的活性是通过静电作用来减少葡萄糖的吸收率,降低餐后血清的葡萄糖水平[74,75]。Turgeon等[76]发现高硫酸基含量(20.60%)和中分子量岩藻多糖(637 kDa)均可抑制α-淀粉酶活性,推测FU可能通过静电作用与α-淀粉酶结合,改变其在溶液中的构象,从而抑制其活性。
海藻种类、收获季节和区域影响FU抑制α-葡萄糖苷酶和α-淀粉酶的作用。Shan等[28]研究了11种不同褐藻来源的FU对α-葡萄糖苷酶和α-淀粉酶的抑制作用,发现均对α-淀粉酶无明显抑制作用,但墨角藻来源的FU对α-葡萄糖苷酶的抑制活性最高(IC50值67.90 μg/mL),可降低db/db小鼠空腹血糖和糖化血红蛋白水平,但对其体重影响很小。Turgeon等[74]研究发现,来自泡叶藻(Ascophyllumnodosum)的FU对α-葡萄糖苷酶有较强的抑制作用,其IC50为0.013 ~ 0.047 mg/mL,优于来自墨角藻(Fucusvesiculosus)的FU对α-葡萄糖苷酶的抑制作用(IC50为0.049 mg/mL);然而,墨角藻FU在研究的浓度范围内对α-淀粉酶活性无明显抑制作用,而泡叶藻FU对α-淀粉酶活性的抑制作用根据收获季节不同在5 mg/mL浓度下可降低7%~100%(IC50为0.12~4.64 mg/mL)。FU的黏度也会影响对酶的抑制作用,例如,墨角藻FU比泡叶藻FU具有更高的黏度,这可能会影响其在溶剂中的扩散率,进而增加FU到达酶的时间。Chen等[28](2016)研究表明,(1→3)连接的FU对α-葡萄糖苷酶无抑制作用,而 (1→3)/(1→4) 交替连接的FU对α-葡萄糖苷酶具有显著抑制作用。然而,各种(1→3)/(1→4)-连接的FU对α-葡萄糖苷酶的抑制作用与其结构性质之间的相关性还不确定。为了进一步揭示FU抑制α-淀粉酶和α-葡萄糖苷酶的机理以及为什么只有泡叶藻来源的FU可抑制α-淀粉酶,还需要进一步研究FU的结构特征[74]。
FU的分子量及硫酸基含量对其抑制酶活性具有重要影响,而单糖组成、糖苷键和硫酸基团的位置对酶抑制作用无影响[74]。Kumar等[73]从马尾藻(Sargassum wightii)中提取FU,硫酸根含量分别为53%±0.52%和36%±0.60%,对α-葡萄糖苷酶的抑制作用显著,且呈浓度依赖性,IC50值为132.90 μg,比阿卡波糖(IC50值1 mg)更有效。Lakshmanasenthil等[77]从喇叭藻(Turbinariaornate)中提取的FU岩藻糖和硫酸基含量分别为59%±0.69%和33%±0.42%,喇叭藻FU对α-淀粉酶具有抑制作用,IC50值为33.60 μg,低于阿卡波糖125 μg。Lee等[78]通过小鼠实验研究不同分子量岩藻多糖对db/db小鼠血糖水平的影响,结果表明45 mg/kg分子量为5 kDa、5~30 kDa的FU和粗岩藻多糖治疗可显著防止db/db小鼠高血糖,且降血糖效果5 kDa >粗岩藻多糖>5~30 kDa。
3.2 抑制二肽基肽酶-IV,降低对胰高血糖素样肽-1的分解
二肽基肽酶-IV(dipeptidyl peptidase,DPP-IV)是一种细胞表面的丝氨酸蛋白酶,它主要的作用是分解体内蛋白质,其中一种被分解的蛋白质叫做胰高血糖素样肽-1(glucagon-like peptide,GLP-1),它是由肠道细胞分泌的一种荷尔蒙,GLP-1通过刺激胰岛素分泌、抑制升糖素、抑制胃排空和让胰岛细胞重生的方式来降低血糖,促使DPP-IV失活从而不分解GLP-1的DPP4抑制剂已经成为治疗糖尿病的主攻方向之一。近年来,DPP-IV已成为糖尿病重要的新药靶点,医药行业的研究促进了具有良好安全性和有效性的DPP-IV抑制剂的开发[79]。
Pozharitskaya等[79]发现FU在0.02~200 μg/mL的浓度范围内对DPP-IV具有浓度依赖性的抑制作用,IC50为11.10 μg/mL,最大抑制程度为60%~75%,而西他列汀参比制剂的IC50为3.80 μg/mL。目前褐藻提取物对DPP-IV活性的抑制作用研究较少[79]。喇叭藻(Turbinariaornate)甲醇和丙酮提取液抑制DPP-IV的IC50值为55.20 μg/mL[80]。葡枝马尾藻(Sargassumpolycyum)和围氏马尾藻(Sargassumwightii)的甲醇提取物也有类似的活性,IC50值分别为38.30和36.90 μg/mL[81]。因此,抑制DPP-IV可能是FU降糖作用机制之一[79]。
3.3 预防氧化损伤,治疗糖尿病
研究发现,糖尿病与大量氧化物的产生以及糖分子的干预抑制自由基清除剂的形成有关,糖尿病患者的DNA明显受到氧化过程损害。目前可用的维持糖尿病患者血糖水平的药物需要定期服用,具有很大副作用,因此,需要发现新的分子和发展治疗糖尿病的方法[82]。Yang等[82]研究了FU在糖尿病治疗中的作用,与糖尿病组相比,100 mg/kg FU能显著降低链脲酶素(streptozocin,STZ)诱导的糖尿病大鼠血糖水平,FU对糖尿病大鼠超氧化物歧化酶(superoxide dismutase,SOD)活性有显著的促进作用,可降低并固定血糖水平,并能抑制丙二醛(malonaldehyde,MDA)水平的升高。本研究证实FU对STZ诱导的大鼠糖尿病模型具有治疗作用。
3.4 改善胰岛功能障碍,增加机体胰岛素水平
研究表明,胰岛功能障碍是II型糖尿病患者发生高血糖的主要原因,只有在胰岛功能障碍存在的情况下,胰岛素抵抗才会因为代偿性衰竭而成为重要因素。机体长期处于高血糖状态,体内会产生糖毒性作用,原因是葡萄糖代谢产生的N-乙酞葡萄糖胺会增多,导致胰岛β细胞肥大。肥大的胰岛β细胞会增加相关凋亡基因表达,从而加速胰岛β细胞的凋亡,使胰岛素分泌缺陷。胰岛素抵抗状态下常伴有胰岛素分泌代偿性增多,会出现空腹胰岛素水平增高[75]。Hu等[83]从海地瓜(Acaudinamolpadioides)中提取FU,分子量为1 614.10 kDa,硫酸基含量为26.30%±2.70%,可降低高脂高糖饮食诱导的糖尿病C57BL/6J小鼠的血糖水平,改善胰岛素抵抗状况;通过激活InsR/InsR-1/PI3K/Akt/GLUT4胰岛素信号传导途径,增强骨骼肌中葡萄糖转运蛋白4(glucose transporter 4,GLUT4)移位,并增加了总蛋白含量。此外,该FU还可以调节肝葡萄糖代谢相关酶活性。
4 结语
FU的传统提取方法得率总体较低,得率也会受不同提取方法、不同条件影响,因此需进一步研究得率更高的提取方法。根据目前文献报道,得率最高的是亚临界水萃取法,FU得率为13.56%。提取方法对FU结构有很大影响,因此,在实际提取过程中,可以根据需求采用不同提取方法。例如,要保留完整的FU结构,需要采用条件温和的提取方法,防止FU分子链被切断。
羧甲基化可以提高多糖的溶解度及其电负性,多糖的羧甲基化可以增强其生物活性,甚至产生新的生物活性。近年来对于多糖羧甲基化的研究越来越多,羧甲基化后的多糖主要在抗肿瘤、抗氧化和免疫调节等方面的生物活性较突出。海藻酸盐的甲基化/羧甲基化、接枝共聚和酯化已经有许多研究,然而,关于FU的甲基化/羧甲基化和接枝共聚尚未见报道,其酯化反应尚未被广泛研究。因此羧甲基化修饰和酯化等方法是今后对FU改性新的研究方向。
硫酸多糖能够在pH值高于其等电点时与蛋白质相互作用,对蛋白质具有很好的亲和力。带负电荷的FU通过静电作用与蛋白质(如抗凝血酶)的部分正电荷结合,FU与α-淀粉酶上一些带正电荷的氨基酸之间的静电相互作用可以改变其构象,因此,FU带负电荷的硫酸基团与α-淀粉酶之间的静电相互作用可能参与了α-淀粉酶活性的调节,从而改变其催化能力,岩藻多糖中的硫酸基与其抑制α-淀粉酶活性具有必然联系。然而,这种静电相互作用的确切位点及FU中硫酸基团抑制α-淀粉酶活性的机制尚不清楚。以现有的物理、化学手段还不能全面描述某一多糖结构以及多糖结构与降血糖活性之间的关系。FU的功能与其结构紧密联系,而目前对FU的分子结构的研究还较为欠缺,大多数FU的单糖在多糖主链的位置还不太清楚,目前对FU的研究大多数集中在对其结构的相关官能团含量的分析层面,对FU更高层面的结构和其空间构象等方面的研究还较少。在未来,这些方面还需进一步关注和探索,因此今后的研究重点为FU生物活性成分的分级和分离,以确定其结构与降血糖及其他各种生物活性之间的关系。
