类风湿关节炎和原发性干燥综合征患者肠道菌群的比较分析
2022-02-14王健梅永君郭文静孙超王信
王健,梅永君,郭文静,孙超,王信
(蚌埠医学院第一附属医院风湿免疫科 慢性疾病免疫学基础与临床安徽省重点实验室,安徽 蚌埠233004)
人类胃肠道是最丰富的微生物生态系统,主要由细菌、古细菌、真核微生物组成,其中细菌是最大的组成部分,具体微生物物种的组成受遗传和环境因素的影响;在健康个体中,微生物群落可以保持平衡并抵抗扰动[1]。肠道微生物与健康和疾病易感性密切相关[1],肠道微生物群有助于免疫系统的正常发育,涉及先天性免疫防御、适应性免疫防御和免疫耐受过程[2]。肠道微生物生态系统的抵御能力和抵抗干扰的能力很强,但健康微生物群的维持仍需要微生物群落内部以及微生物与宿主肠道界面之间的稳态平衡。健康微生物群的恢复力可以保护人体免受与生态失调相关的疾病,如过敏、哮喘、代谢综合征以及炎症性肠病等慢性炎症性疾病[3]。类风湿关节炎(rheumatoid arthritis)和原发性干燥综合征(primary Sjögren′s syndrome,pSS)均为常见全身性炎症性自身免疫性疾病。主要累及关节,但也可出现关节外表现,例如类风湿结节,肺部受累或脉管炎等合并症,因此被认为是一种包括关节外表现的综合征[4]。pSS的特征是外分泌腺的局灶性淋巴细胞浸润,导致干眼和口干。在患有其他风湿性疾病,例如RA、系统性红斑狼疮(systemic lupus erythematosus,SLE)等患者中,类似的腺体特征也可以作为晚期并发症“继发性干燥综合征”发生,pSS患者通常抗核抗体(antinuclear antibody,ANA)阳性,大约70%的患者中有抗Ro和(或)抗La(Extractable nuclear antigen,ENA)抗体阳性,另外pSS患者通常会有类风湿因子(rheumatoid factor,RF)阳性[5]。现有研究表明,肠道微生物群是维持宿主体内促炎和抗炎免疫反应平衡的主要因素,肠道菌群的失衡可以影响促炎和抗炎免疫反应之间的平衡,而促炎和抗炎之间的不平衡是pSS等风湿性疾病发生和发展的决定性原因[6]。有关和pSS与肠道微生物组联系的研究很多,但鲜见2种疾病间肠道菌群变化的比较研究。有研究发现有重叠发病机制的疾病间可能共享肠道菌群变化[7]。本研究尝试通过比较肠道菌群结构并使用非侵入性策略描述其与2种疾病间潜在关联来区分pSS。
1 资料与方法
1.1 一般资料 纳入2019年1月至2020年3月我院收治的患者和pSS患者各14例,因pSS以女性多见,男女性别比均为1∶9左右,为均衡2组患者性别比并结合本科室实际情况,所有纳入患者均为女性;其中pSS患者年龄20~68岁,诊断符合2002年美国风湿病学学会-欧洲抗风湿病联盟(ACR/EULAR)共同修订的干燥综合征分类标准[8],也符合2016年ACR/EULAR联合制定的pSS国际统一分类标准[9]。患者年龄为18~65岁,诊断符合2010年ACR/EULAR制定的分类标准[10]。RA患者排除有pSS、SLE、强直性脊柱炎(ankylosing spo-ndylitis,AS)、系统性硬化症(systemic sclerosis,SSc)等其他自身免疫性疾病(继发性干燥综合征除外)者,pSS患者排除有SLE、SSc、AS等其他自身免疫性疾病者;2组共同排除3个月内使用过任何抗微生物制剂,3个月内使用过益生菌制剂;消化道手术史或患有消化道器质性疾病者。所有患者留样前均未曾应用激素类药物治疗。本研究经本单位伦理委员会批准,所有受试对象均知情同意。
1.2 主要试剂 Omega粪便试剂盒(美国Omega公司),QIAamp Fast DNA Stool Mini kit(德国Qiagen公司),Running buffer(北京诺德莱科技有限公司),琼脂糖凝胶、Gene JET凝胶回收试剂盒(美国Thermo Fisher Scientific公司)、Illumina二代测序试剂盒(产品型号PE-402-4002)、Hi Seq Rapid SBS Kit v2(500 cycles)试剂盒(产品型号FC-402-4023)(美国Illumina公司)。
1.3 方法[11]
1.3.1 标本收集 应用粪便采集管收集纳入患者清晨中间段新鲜粪便标本约3~5 g,-80℃冰箱保存。
1.3.2 细菌总DNA获取 采用QIAamp®DNA Stool Mini®法获取:(1)细菌裂解:将待测序的标本与ASL液均匀混合(100℃×10 min),并孵育离心;(2)抑制剂清除:离心后的样本加入Inhibit Ex;(3)应用醇沉淀法获取DNA:将获得的DNA用缓冲液进行过柱极性洗脱,将回收的洗脱液置于AE液中溶解,最终获取粪便细菌的总DNA。上述操作严格按试剂盒说明书要求进行。
1.3.3 测序 应用Illumina hiSeq平台技术对细菌16S rDNA V3~V4区进行高通量测序,首先去除barcode标记的标签序列,再把标签序列后仍<50 bp的序列去除,并统计有效序列的分布情况,包括序列大小和序列长度。对筛选后的有效序列进行除杂,得到优化序列。
1.3.4 菌群多样性分析 利用Shannon指数等绘制稀释曲线,分析2组样本的复杂度,分析结果显示所测数据量完整,可以反映样本所有微生物的多样性信息。最后对样本进行OTU分析、物种注释分析、样品多样性分析、样本组间差异性分析以及LEfSe分析。并对结果进行生物信息学分析。
1.4 统计学方法 Venn图、组间差异柱状图和LDA值分布柱状图均应用R软件(v3.1.1)进行分析。生物信息学分析中的数据采用R软件中的秩和检验。n=2,采用R语言中的wilcox.test。P<0.05为差异有统计学意义。P值校正通过R(v3.1.1)包中的p.adjust进行。LEfSe分析使用LEfSe软件实现。
2 结果
2.1 OTU分析 在给定相似度下聚类所得到的每个样品OTU个数,绘制Venn图,2组共有368个OTU;RA组、pSS组特有OTU个数分别为30个和4个,见图1。
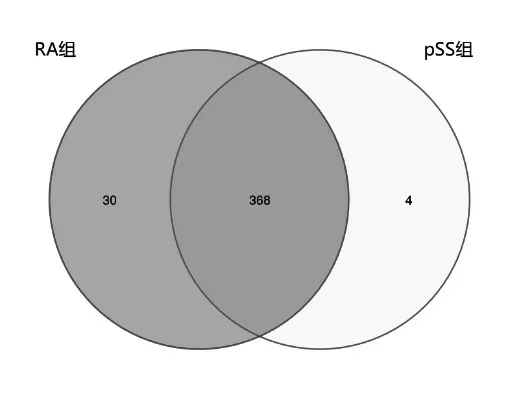
图1 RA和pSS组间OTU数量及Venn图分析
2.2 样品Alpha多样性 2组间ACE指数、Chao1指数、Shannon指数和Simpson指数比较差异均无统计学意义,见表1。

表1 RA组和pSS组α多样性指数组间差异比较
2.3 样本组间差异分析
2.3.1 物种注释差异分析 分别在“门、纲、目、科、属和种”6个分类等级上对获得的所有OUT数据进行物种注释分析并作物种profiling面积图和柱状图。根据分析结果,在门和属两个分类等级上进行生物信息多样性分析。在分析时将物种丰度在所有样品中均低于0.5%的物种合并成Others。
2.3.2 在门水平上的差异 对2组样本在门水平进行序列分析,2组菌群共发现11个菌门,其中RA组样本发现11个菌门,pSS组样本发现8个菌门。2组均由4个主要菌门组成,分别为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria),对上述4种主要菌门进行比较,差异无统计学意义(P>0.05),但2组间的含量波动范围差异明显,提示RA组与pSS组肠道菌群构成比不同。见图2。
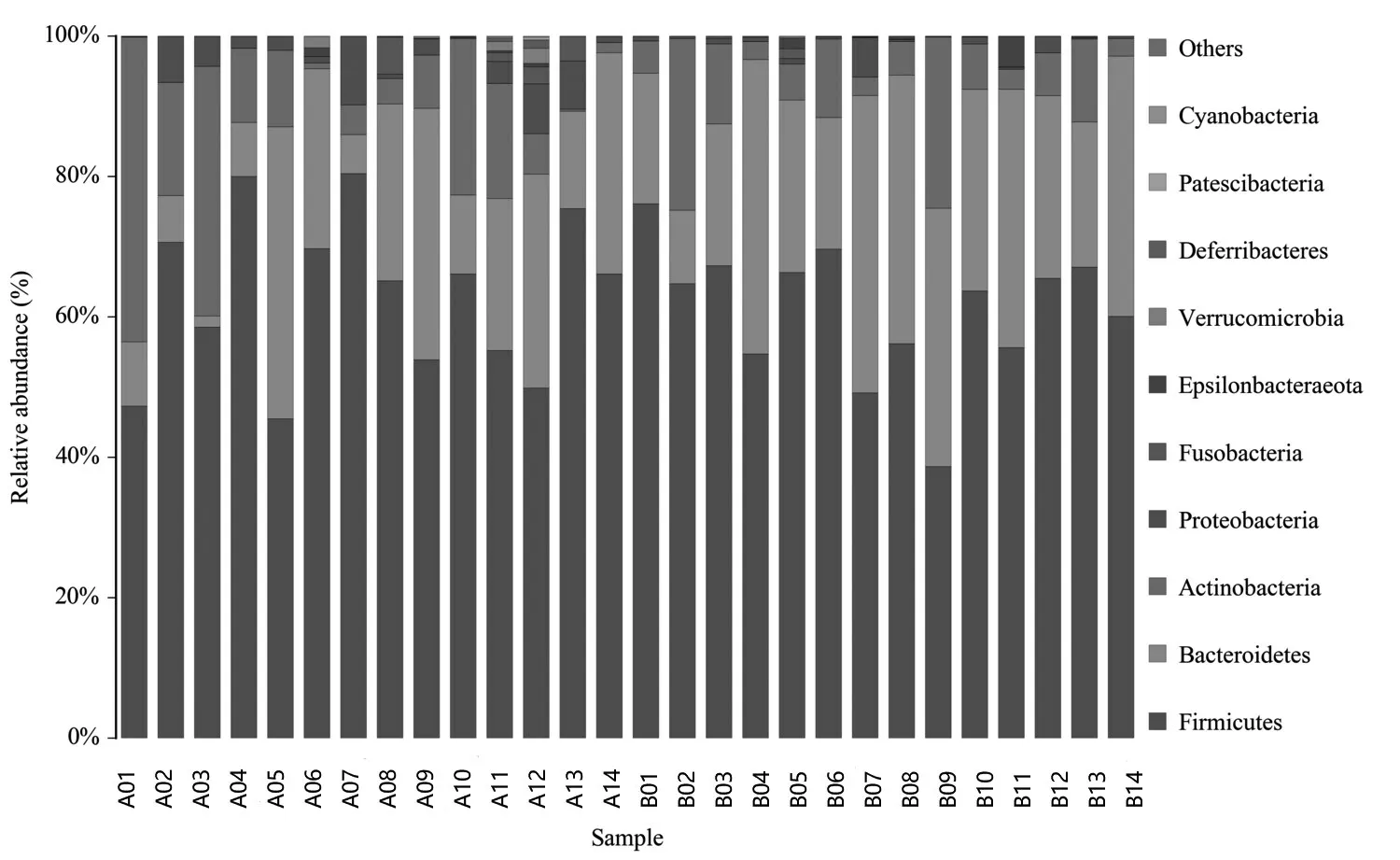
图2 RA组(A01-A14)和pSS组(B01-B14)样品在门分类水平中物种profiling柱状图
2.3.3 在属水平上的差异 为了进一步探讨2组间菌群的差异性,本研究选择在能够明显显示物种间差异的属水平上对所有样品进行序列分析,2组样本共得到158个菌属,发现130个共同菌属,并且2组的主要构成菌属是相同的,均为链球菌属(Streptococcus)、棒状杆菌属(Corynebacterium_1)、芬戈尔德菌属(Finegoldia)和普雷沃菌属(Prevotella)。对上述4种共同主要菌群进行统计学分析,差异无统计学意义(P>0.05)。但值得注意的是2组样本中具体菌群的含量波动范围差异明显,仍提示2组在肠道菌群的构成比方面是有差异的。见图3。
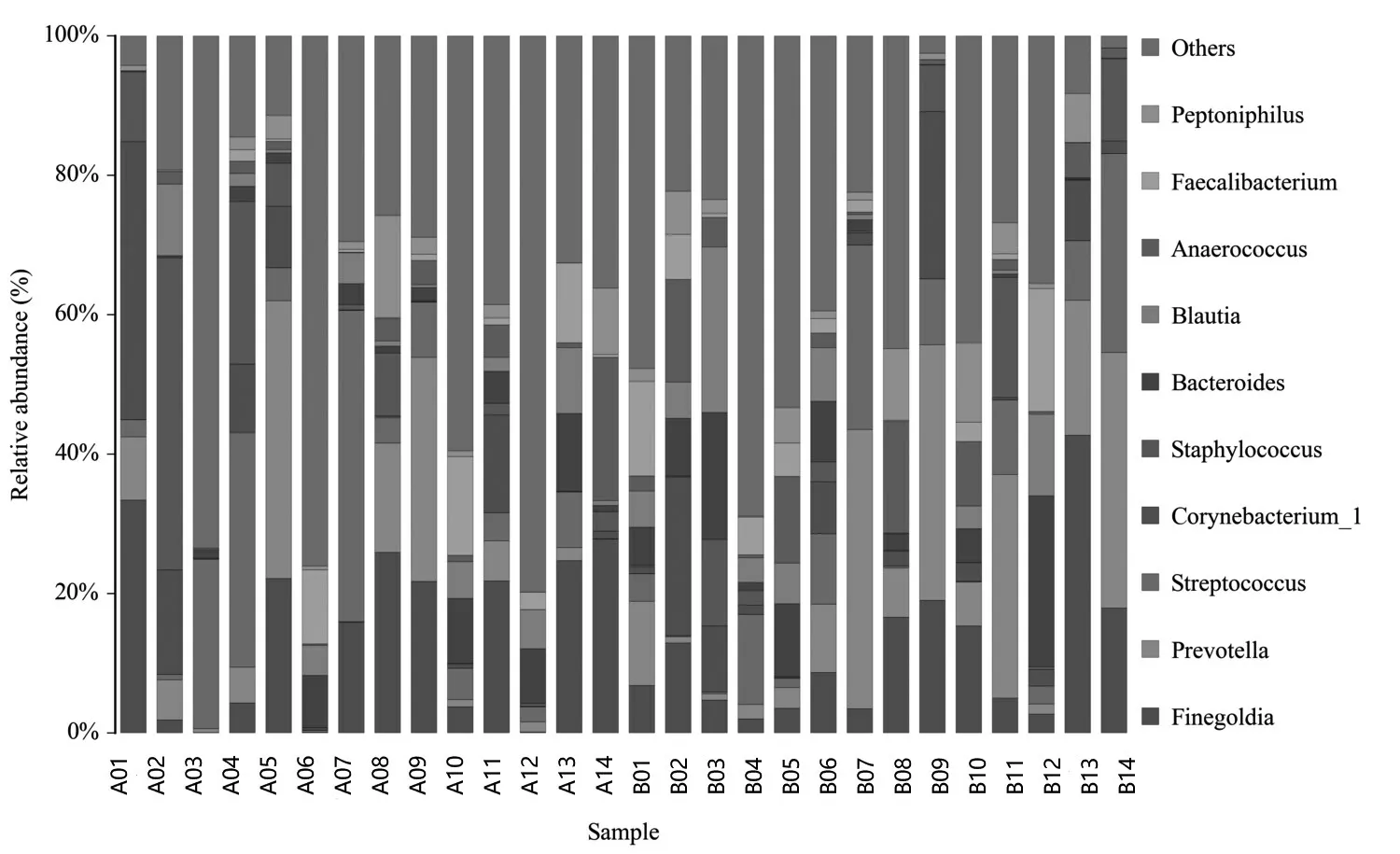
图3 RA组(A01-A14)和pSS组(B01-B14)样品在属分类水平中物种profiling柱状图
2.3.4 肠道菌群16S rDNA V3~V4区组间差异性分析 2组在乳杆菌目(Lactobacillales)、梭杆菌目(Fusobacteriales)、双歧杆菌目(Bifidobacteriales)、拟杆菌目(Bacteroidales)、芽孢杆菌目(Bacillales)存在微生物群落丰度的差异,但差异均无统计学意义(P>0.05),见图4。

图4 RA和pSS组间细菌在目水平上差异柱状图
2.4 LEfSe分析 为了更好地从门、纲、目、科、属等各个层次水平分析2组间肠道菌群组成和各成分的丰度差异,本研究应用LEfSe软件对2组间进行肠道微生物高维生物标识和揭示基因组特征的分析,进行多级物种判别,着力找出各自的biomaker(即各组之间有显著差异丰度的优势菌群),该分析是众多针对合成数据的分析方法中的假阳性发生率非常低的分析法[12]。根据LDA SCORE(effect size)大小,RA、pSS组相比较,RA组微生物群落的核心菌群是变形菌门(Proteobacteria)、Bifidobacterium-adolescontis种,pSS组微生物的核心菌群是拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)、拟杆菌目(Bacteroidales)。见图5。
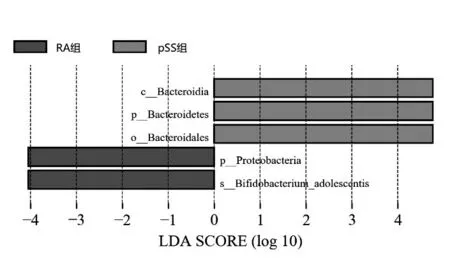
图5 RA和pSS组LDA值分布柱状图
3 讨论
越来越多的证据表明,肠道微生物组对人类健康和疾病产生重大影响,肠道菌群的失调与多种疾病之间存在联系,包括RA和pSS等自身免疫性疾病。肠道菌群紊乱和口腔菌群的变化已被认为是RA发病的重要因素,多种关节炎的动物模型研究均显示肠道微生物组在疾病发展中的关键作用[4]。在多个既往的研究中均发现RA的口腔、唾液和胃肠道中存在微生物种群变化,这些变化与疾病状态有关,且可通过治疗缓解[13-14]。pSS方面,目前的研究同样发现口腔、肠道及皮肤的共生细菌在疾病的发病机制中起重要作用[15-16]。本研究通过16S rDNA分析比较RA和pSS患者的肠道菌群的差异性。利用Shannon指数等分析2组样本高通量测序后的复杂度,结果表明,样本所测数据量较完整,覆盖深度均在95%以上,可以反映研究对象中所有微生物的多样性信息。菌群多样性分析表明,2组样品在α多样性分析上差异无统计学意义,提示2组间物种多样性无明显差异。在门水平和属水平上,2组在主要菌群上的差异亦无统计学意义。类似研究对pSS和SLE进行肠道菌群差异性分析发现,pSS和SLE患者的粪便菌群组成与人群对照有显著差异,但pSS和SLE之间无差异,推测有重叠发病机制的疾病间可能共享肠道菌群变化[7]。RA和pSS 2种疾病均与遗传、环境因素、感染、生活方式等因素有关。越来越多的研究发现,从发病机制和临床表现而言,几乎所有的自身免疫性疾病都存在共同的表型和机制[17],都存在多自身免疫机制。而RA是干燥综合征第二常见的多自身免疫性疾病[18-19]。而在患有关节炎、干燥症和RF阳性的患者,应考虑将pSS诊断为RA的替代方法[5]。因此我们推测2组在菌群多样性、门水平和属水平上差异无统计学意义可能与RA和pSS有重叠发病机制有关。
菌群结构组成方面,虽然2组在4种主要菌门和4个主要菌属之间均无显著性差异,但2组间具体菌群含量的波动范围差异明显,提示2组样本在肠道菌群的构成比上是有差异的。进一步分析发现,RA组在Lactobacillales、Fusobacteriales、Bifidobacteriales和Bacillales丰度上高于pSS,而在Bacteroidales丰度上不及pSS组,但差异无统计学意义。随后我们应用LEfSe软件分析查找2组优势菌群(定义为有显著差异丰度的物种,即biomaker),结果显示2组存在优势菌群[12]。和pSS相比,RA患者的拟杆菌属(Bacteroides)丰度较低。Rogier等[20]在胶原蛋白诱发的关节炎(CIA)小鼠模型中,在关节炎的免疫引发阶段,拟杆菌科减少,而Firmicutes增多。以前的研究也支持本研究中较低的拟杆菌和拟杆菌比率[21-22],另一个与骨关节炎肠道菌群相比较的研究中同样发现,RA组粪便中拟杆菌含量比骨关节炎组降低[23]。研究发现与健康对照组相比,pSS患者的粪便样本中产丁酸盐有益菌群减少,与此同时其肠内有害菌(如埃希菌、志贺氏菌、拟杆菌门和肠杆菌)显著增加[11,24]。
本研究还发现,虽然2组在乳杆菌目和芽孢杆菌目比较差异无统计学意义,但RA患者粪便中乳杆菌和芽孢杆菌的丰度较pSS患者高。这一结果也得到先前研究的支持。动物研究发现,通过暴露于乳杆菌属可以在无菌动物中诱发RA,从而刺激T型辅助细胞17(Th17)的活性和降低调节性T细胞(Treg)的活性[25]。2018年一项比较RA患者和健康对照组的粪便微生物群研究也显示,RA组中大量的芽孢杆菌和乳杆菌[26],另有研究表明,RA患者中乳酸菌的种类和数量高于健康对照者[27]。另外已有研究发现作为乳酸杆菌物种的双歧杆菌(L.bifidus)与RA有关[28]。双歧杆菌会引起小鼠关节肿胀[29]。本研究中同样发现双歧乳杆菌属下的Bifidobacterium-adolescontis种是RA组患者的优势菌群。
相对于pSS患者,RA患者另一个优势菌群是变形杆菌,早在2009年,就有研究用Karl Popper或Popperian序列的方法鉴定出十个“尿液序列”,证实指出变形杆菌是可能RA的病因[30],并在RA患者找到抗变形杆菌的抗体[31],而且与抗CCP等自身抗体相关。变形杆菌感染参与RA发病的可能机制是“分子拟态”,研究发现变形杆菌抗原共享同源序列与滑膜组织中存在的某些自身抗原发生交叉反应[32]。
目前肠道菌群参与自身免疫病发机制尚待进一步研究,已经提出了几种肠道微生物群与关节炎之间的联系的机制,包括通过影响Toll样受体(TLRs)和Nod样受体(NLRs)来激活抗原呈递细胞,抗原模拟,影响肠道通透性,触发T细胞分化控制宿主免疫系统以及增加Th17介导的黏膜炎症[33]。在使用gnotobiotic小鼠的相关研究发现,肠道菌群失调可以增加促炎性细胞因子,不仅在肠道中,甚至在组织中可以促进Th17细胞的分化和白介素17产生[34]。研究发现pSS的发生发展与体内肠道菌群异常有关[11,24,35-36]。目前的研究发现产丁酸盐的肠道菌群对维持Treg细胞和Th17细胞之间的平衡是必要的。该类菌群可保护黏膜免受病原微生物定植,其减少可能会影响pSS患者Th17和Treg细胞之间的平衡,从而有助于自身免疫性疾病的发生[37-38]。
本研究发现RA和pSS组的肠道菌群多样性上无明显差异,表明RA和pSS患者共有非常相似的肠道菌群组成。另外,通过探索RA患者和pSS患者肠道具体菌群组成的不同,发现RA和pSS肠道菌群之间的特异性差异。肠道微生物与人体健康密切相关,重建肠道菌群对自身免疫性疾病患者有潜在的治疗作用,但不同疾病间具体种群的差异对益生菌在风湿病治疗中应用提出更高要求。
