Atg7介导Toll样受体4对脓毒症小鼠心肌自噬的影响和机制
2022-02-14朱峰张本凯汪和贵
朱峰,张本凯,汪和贵
(1.皖南医学院弋矶山医院心血管内科,安徽 芜湖241001;2.中心实验室)
脓毒症是一种由感染引起的全身性炎症反应综合征,炎症细胞的活化和大量炎症介质的产生导致感染性休克和多器官功能障碍[1]。研究表明,脓毒症患者的不良后果与心肌功能障碍的发展密切相关[2-3],其中约50%的脓毒症患者表现出心肌功能障碍。因此,保护心功能及心肌损伤在对脓毒症的预防和治疗中具有重要作用。研究发现,Toll样受体4(TLR4)在脓毒症引起的心肌损伤过程中作用显著,敲除TLR4可有效改善脓毒症引起的小鼠心功能不全[4]。有研究指出,自噬相关基因7(Atg7)的过表达可加重脓毒症心肌损伤,并且TLR4的激活可促进Atg7的表达以及活性[5]。因此,本实验通过盲肠结扎穿孔术(CLP)制备小鼠脓毒症模型[6],研究Atg7是否介导TLR4参与脓毒症引起的心肌损伤及其可能的机制,从而为脓毒症心肌损伤的治疗提供一些思路。
1 材料与方法
1.1 实验动物 SPF级ICR雄性小鼠50只(许可证号:SCXK(苏)2017-0001),年龄6~8周,体重20~25 g,由南京市江宁区青龙山动物繁殖场提供。适宜环境中(温度20~25℃、湿度50%~70%)常规饲养1周。经医院动物伦理委员会批准。
1.2 主要试剂与仪器 ELISA试剂盒(美国博士德生物有限公司);血液分析仪(日本Sysmex公司);一抗TLR4、Atg7、p53、Puma上调细胞凋亡调节因子(Puma)、β-actin(美国CST公司);二抗(中国Biosharp公司);配胶试剂(上海碧云天生物技术公司);电泳、转膜仪、酶标仪(美国Bio-RAD公司),化学发光成像仪(上海天能科技有限公司)。
1.3 小鼠脓毒症模型[6]建立 将20只小鼠经水合氯醛(350 mg/kg)麻醉、固定四肢,备皮后消毒腹部皮肤。取腹部正中切口打开腹腔,找到盲肠并用4号缝线结扎,而后7号针头刺穿盲肠末端,挤出少量内容物,还纳盲肠并关腹,术后均皮下注射生理盐水用以补充丢失的体液。于术后0、8、16、24 h分别取5只小鼠行眼球摘除取血后处死小鼠取出心脏并清除残留血液,一部分心脏放于-80℃冷冻保存,剩余部分用福尔马林固定。
1.4 血白细胞检测和ELISA检测炎症因子 使用血液分析仪对各时间段血液进行白细胞检测。采用ELISA检测炎症因子试剂盒,提取血清并按照说明书稀释,取稀释好样品和标准品各100μl分别加入到对应孔板中并37℃反应90 min;去除孔板内液体后加入100μl稀释好的抗体,37℃反应60 min;PBS洗涤3次,每孔加100μl ABC工作液,37℃反应30 min;PBS洗涤5次,加TMB显色液37℃避光反应25~30 min;加TMB终止液后于酶标仪450 nm波长读取吸光度值;根据标准品结果制作标准曲线,并计算样品原始浓度。
1.5 心肌HE染色 取固定好的心肌组织制作切片,切片在二甲苯中脱蜡5 min×2次,按顺序放入100%、90%、80%、70%酒精中各5 min最后放入蒸馏水,苏木精染色10 min洗去多余染液再盐酸酒精分色,流水缓慢冲洗直至核为蓝色,伊红染色3 min,经由低至高浓度酒精依次脱水2 min,然后二甲苯透明5 min×2次,去除二甲苯后封片,在显微镜下观看不同时期心肌细胞形态结构变化。
1.6 心肌Masson染色 切片常规脱蜡至水,依次经过Weigert铁苏木素染色液染色5~10 min,乙醇分化10 s,Masson蓝化液返蓝5 min,蒸馏水水洗10 min,弱酸(蒸馏水:弱酸=2∶1)水洗1 min,磷钼酸洗涤2 min,再弱酸水洗,苯胺蓝染色2 min,再次弱酸水洗,最后95%乙醇快速脱水,无水乙醇脱水10 s×3次,二甲苯透明1 min×3次,之后中性树胶封片,在显微镜下观察不同时期的心脏胶原纤维的变化(镜下为蓝色)。
1.7 Western blot检测 各组取心肌组织剪碎加裂解液研磨、裂解,离心后提取上清、BCA法检测样本蛋白浓度。根据浓度调整加样量,行凝胶电泳,选取NC膜转膜后剪取目的条带,BSA室温封闭2 h,将目的条带分别放入对应一抗内(抗体稀释比例为1∶1 000),4℃冰箱内摇床孵育14 h,洗膜(40 min)后室温孵育二抗(稀释比例1∶5 000)2 h,再次洗膜(50 min)后用ECL显影液进行显影,imageJ软件测量各组蛋白条带的灰度值。
1.8 统计学方法 采用SPSS 19.0软件进行统计学分析,正态分布的计量资料采用均数±标准差表示,组间比较采用方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 血清炎症因子的变化 小鼠脓毒症模型建立后,大约会有90%的小鼠有竖毛、腹泻、脓尿,饮水、进食及活动次数减少的表现。与0 h比较,8、16和24 h小鼠血白细胞显著减少(P<0.01);与8 h比较,16 h和24 h小鼠血白细胞差异无统计学意义(P>0.05),见图1A。与0 h比较,8、16和24 h小鼠血清炎症因子IL-1β、IL-6、TNF-α水平均明显增加(P<0.05);与8 h比较,16 h和24 h小鼠血清炎症因子IL-1β、IL-6、TNF-α水平显著增加(P<0.05),见图1B、1C、1D。表明小鼠脓毒症模型建立成功。
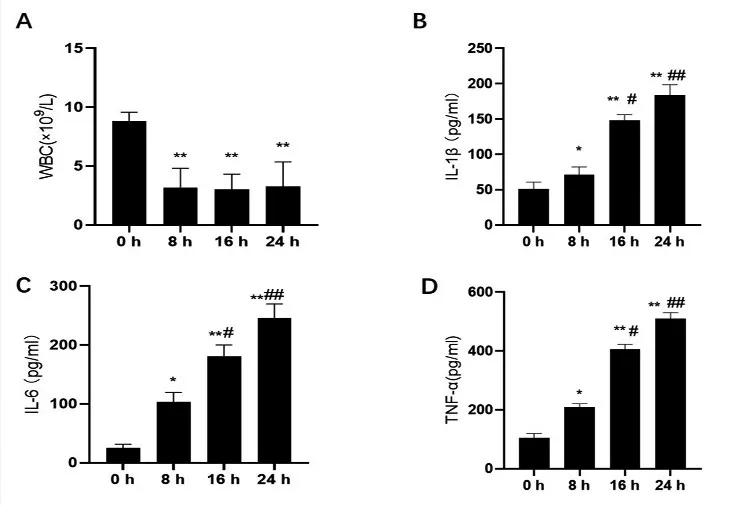
图1 各时间点小鼠血白细胞和血清炎症因子IL-1β、IL-6、TNF-α含量变化
2.2 心肌HE染色 0 h小鼠心肌细胞形态正常、排列紧密、肌节清晰;8 h时心肌细胞明显水肿、形态不规则;16 h心肌在水肿的基础上出现坏死,各种细胞器溶解形成碎片;24 h可见大量坏死心肌,导致组织间隙增宽、形态紊乱。见图2。
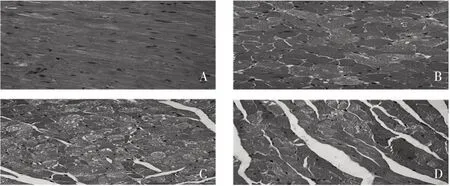
A:0 h;B:8 h;C:16 h;D:24 h
2.3 心肌Masson染色 在0 h小鼠的心肌结构正常,细胞核蓝黑色,胶原纤维为蓝色,细胞浆、肌肉、红细胞为红色。随着时间的延长,小鼠的心肌中明显的胶原纤维增生。见图3。
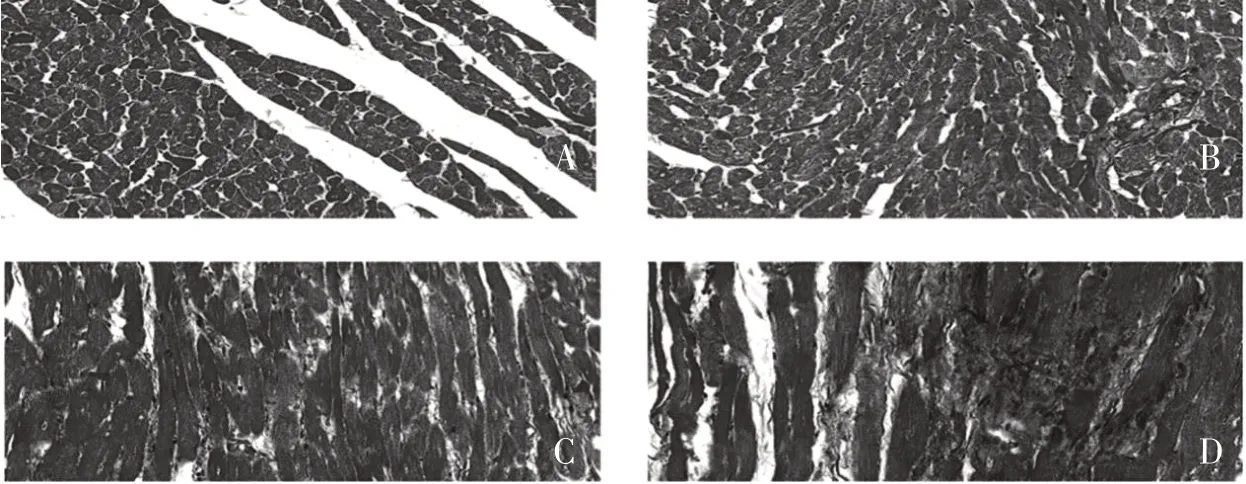
A:0 h;B:8 h;C:16 h;D:24 h
2.4 Atg7、TLR4、p53和Puma的蛋白表达的变化 与0 h比较,8、16和24 h小鼠心肌组织中TLR4、Atg7、p53和Puma的蛋白表达量增加(P<0.05);与8 h比较,16 h和24 h心肌组织中TLR4、Atg7、p53和Puma的蛋白表达量增加(P<0.05),见图4。
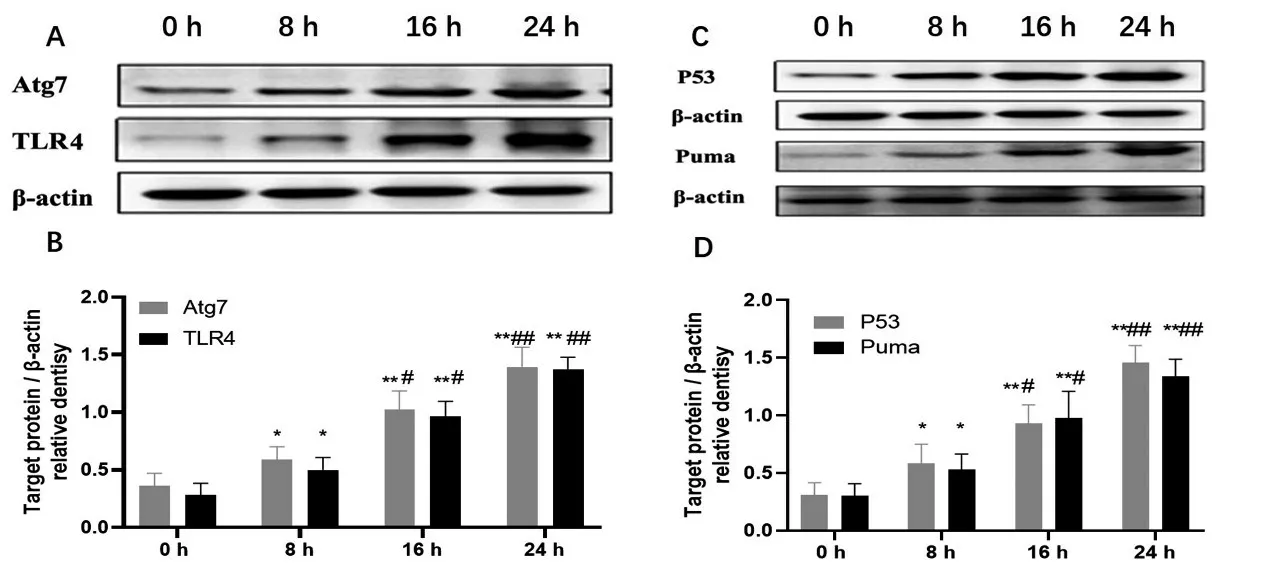
图4 Atg7、TLR4、p53和Puma的蛋白表达的变化
3 讨论
脓毒症是目前全球重症监护病房患者的主要死亡原因[7]。脓毒症患者常有多器官损害,而心肌细胞损伤引起的收缩和舒张能力下降可导致微循环灌注障碍,加速多器官功能衰竭[8-9]。机体的自噬是一个动态的过程,在生理状态下协调维持机体免疫,但是长期持久的自噬就会导致器官功能的障碍,特别是在心脏的重塑中,通过药物干预自噬的过程是未来治疗脓毒症的一个突破口[10-12]。有研究表明,脓毒症能够降低心脏功能,而心肌细胞自噬是脓毒症引起的心肌损伤和心功能不全的主要致病机制[13]。TLR4是一种脂多糖受体,在多种免疫过程中作用显著。在严重的脓毒症中,TLR4信号传导介导有害的过度炎症反应。在这种情况下,缺乏TLR4信号减弱细胞因子的产生,改善血液动力学,减少器官损伤并促进存活。研究证实,天然缺失TLR4能够防止脂多糖诱导的心功能障碍,表明TLR4信号传导是内毒素期间心肌抑制和死亡的主要原因[14-15]。
研究发现,脂多糖诱导的自噬标志物LC3Ⅱ的表达在4 h到达最高后逐渐下降,显示脓毒症进展过程中自噬作用并不能持续存在[16]。表明自噬相关的基因过度激活可能参与调控除自噬作用外的其他生物学功能。Yamaguchi等[17]指出,心肌中过表达Atg7,能够引起心肌细胞死亡,这种作用可能与p53有关。Atg7与细胞核中的p53结合,并定位于Puma的转录起始位点进而调控Puma基因的转录。Puma是Bcl-2家族的BH3成员,在人和小鼠之间高度同源,几乎完全介导了p53途径诱导细胞凋亡[18]。研究指出,在受损的心肌细胞中检测到p53表达显著上调[19]。本研究发现脓毒症导致的心肌损伤中,p53与Puma在心肌组织的含量明显上升,则可能p53和Puma同样参与了脓毒症导致的心肌损伤。
综上所述,Atg7介导TLR4通过调节p53和Puma参与了脓毒症自噬引起的心肌损伤,这在脓毒症心肌损伤的治疗上为我们提供了一个可能的方向。
